盐酸维拉佐酮片的制备及体外溶出度的一致性考察
2020-07-23杨阳林琪张雨凝吴振王立强
杨阳, 林琪, 张雨凝, 吴振, 王立强
(1. 华侨大学 生物医学学院, 福建 泉州 362021; 2. 厦门大学 药学院, 福建 厦门 361102)
抑郁症(depression)是一类精神障碍性疾病,主要影响人的情绪,患病者表面与常人并无区别.临床特点主要表现为心境低落、思维迟缓和意志力脆弱等[1],严重者甚至会产生自杀行为,且知晓率低、治疗率低[2-3].目前,临床上常见的治疗抑郁症的药物主要有三环类抗抑郁药(丙咪嗪)、单胺氧化酶(MAO)抑制剂(异卡波肼、苯乙肼等)和新型药物选择性5-羟色胺再摄取抑制剂(氟西汀、帕罗西汀等)[4-7].然而,以上药物在治疗抑郁症的同时,也具有很大的副作用.盐酸维拉佐酮是首个吲哚烷基胺类新型抗抑郁症药,具有选择性的5-HT再摄取抑制剂和5-HT1A受体部分激动剂双重活性[8-9],能够有效抑制5-HT再摄取位点.临床数据表明,盐酸维拉佐酮具有起效快、耐受性好和不良反应小等特点[10].仿制药占当今社会的主流地位,大多数化学药品都是仿制药.由于过去的药品评审对仿制药和原研制剂没有严格的质量一致性要求,很大程度上影响了患者的用药疗效.因此,开展仿制药的一致性评价是确保仿制药临床疗效的首要前提[11-12],而体外溶出度是考察固体制剂最核心的评价指标[13].本文以原研制剂为参考,探索盐酸维拉佐酮片的处方及制备工艺,对其体外溶出行为进行考察和对比研究.
1 实验部分
1.1 试剂与仪器
1.1.1 试剂 盐酸维拉佐酮对照品(美国Trovis Pharmaceuticals LLC公司,生产批号为 S170707);自制盐酸维拉佐酮片(本单位研发,生产批号:一批20181101、二批20181102、三批20181103);乳糖(江苏徐州丰瑞生物科技有限公司);微晶纤维素(台湾明台化工股份有限公司);二氧化硅(安徽山河药用辅料股份有限公司);硬脂酸镁(河南铭之鑫化工产品有限公司);交联羧甲基纤维素钠(上海昌为医药辅料技术有限公司);欧巴代包衣预混粉(胃溶型,上海卡乐康包衣技术有限公司);甲醇(广东汕头西陇化工股份有限公司,色谱级);磷酸、磷酸二氢钾(西安悦来医药科技有限公司).
1.1.2 仪器 高效液相色谱仪(DAD 检测器,美国安捷伦公司);pH计(赛多利斯科学仪器北京有限公司);电子天平(奥豪斯仪器常州有限公司);YQ100型气流粉碎机(上海塞山粉体机械有限公司);DP60A型单冲压片机(上海天阖机械设备有限公司);BG75B型高效包衣机(中航工业北京航空制造工程研究所);QS-15型混合机(浙江温州市佳禾电气有限公司);RC806型溶出试验仪(天津市天大天发科技有限公司).
1.2 盐酸维拉佐酮片的制备
1.2.1 辅料用量的选择 参考原研制剂的质量情况后,发现原料对高湿环境比较敏感,且本试验采用直接压片法.因此,试验选择了粒径较大、含水量≤1.5%的Avicel PH-112规格的微晶纤维素和休止角较小的Tablettose 80乳糖作为填充剂,选用交联羧甲基纤维素钠为崩解剂,以溶出度为主要评价指标,对辅料(填充剂和崩解剂)的用量(m)进行考察,结果如表1所示.

表1 辅料用量的筛选Tab.1 Selection of excipient dosage g
1.2.2 原辅料相容性的考察 参考原研产品处方组成,根据原辅料相容性试验指导原则对产品处方设计,如表2所示.按表2比例称取原辅料于自封袋中混合均匀,在温度60 ℃,光照度(4 500±500) lx,湿度为92.5%的条件下放置10 d.然后,于第5天和第10天取样检测,考察各样品原料药的含量、有关物质和晶型等项目各时间节点变化.

表2 原辅料相容性试验处方设计Tab.2 Prescription design of compatibility test
1.2.3 盐酸维拉佐酮的压片 将盐酸维拉佐酮的原料微粉化后,过100目筛,按处方量称取盐酸维拉佐酮、乳糖、微晶纤维素、二氧化硅、硬脂酸镁和交联羧甲基纤维素钠,加入到混合料斗中充分混合.采用直接压片法进行压片,据所得片芯质量对素片进行包衣.
1.2.4 盐酸维拉佐酮片的包衣 选用沪Q/WS-1-2273-99型欧巴代包衣粉为盐酸维拉佐酮的包衣材料,用纯化水将其配置成8%的溶液,搅拌,过100目筛,备用.按照最佳的处方制备素片,称量后置于包衣锅内;然后,调节主机转速为6~9 r·min-1,送风温度为60~65 ℃,蠕动泵转速为6~15 r·min-1,雾化压力为0.3~0.6 MPa,开枪压力为0.2~0.6 MPa,出风温度为37~45 ℃进行包衣.当片剂质量增加约4%时,停止包衣,干燥后即得薄膜衣片.
1.3 色谱条件
色谱柱为Hypersil ODS2(250 mm×4.6 mm,5 μm),流动相为体积比1∶1的甲醇-磷酸缓冲液,检测波长为240 nm,流速为1.0 mL·min-1,进样体积为20 μL,柱温为25 ℃.
1.4 溶出转速的选择
根据各国药典及美国FDA溶出数据库中的方法可知,50,60,75 r·min-1的溶出转速均有被使用.

表3 溶出转速的考察结果Tab.3 Examination results of dissolution speed
本实验选择参比制剂和批号为20181101的自制品为样品,在醋酸溶液(pH=3.1)中对3种转速的溶出度进行考察,结果如表3所示.表3中:t为时间;D为溶出度.
从表3可知:溶出转速为60 r·min-1较 50 r·min-1的溶出量和溶出速率明显增多变快,而75 r·min-1较60 r·min-1的溶出量和溶出速率略有增多.由于美国FDA中规定盐酸维拉佐酮的溶出转速为60 r·min-1,因此,选择转速为60 r·min-1.
1.5 实验方法
1.5.1 体外溶出度测定 取自制的盐酸维拉佐酮片,参照溶出度测定法[13],以醋酸溶液(pH=3.1)、盐酸溶液(pH=1.0)、磷酸盐缓冲液(pH=6.8)和水为溶出介质,介质体积为1 000 mL ,转速为60 r·min-1.然后,以醋酸溶液(pH=3.1)为介质,取样时间分别为0,5,10,20,30,45 min;以水、磷酸盐缓冲液(pH=6.8)和盐酸溶液(pH=1.0)为溶出介质,取样时间分别为0,5,10,20,30,45,60,90 min.上述样点取样后,过滤得供试品溶液.另精密称取原研药10.0 mg,加稀释剂定容到500 mL容量瓶中,配置成2 μg·mL-1的盐酸维拉佐酮对照品溶液;精密量取各溶液100 μL,注入液相色谱仪,按外标法以峰面积计算各点的累积溶出度.
1.5.2 专属性实验 取10 mg空白辅料、自制盐酸维拉佐酮片和参比制剂,按溶出度测定方法操作,过滤;精密量取上述续滤液和溶出介质(pH=3.1醋酸溶液)各20 μL,注入液相色谱仪,记录色谱图.
1.5.3 线性实验 精密称取质量分数为99.89%的盐酸维拉佐酮对照品15.0 mg,置于50 mL烧杯中,用甲醇溶解后,转移至100 mL容量瓶中定容,摇匀;精密移取上述溶液0.2,0.5,0.8,1.1,1.4 mL,置于50 mL容量瓶中,加入稀释剂(甲醇∶水的体积比为80∶20)定容,摇匀,作为供试品溶液.按照色谱条件进样分析,进样量100 μL,进行盐酸维拉佐酮线性回归并计算相关系数.
1.5.4 回收率实验 精密称取盐酸维拉佐酮10.0,15.0和20.0 mg各3份,按处方比例加入适量的空白辅料后,用少许甲醇溶解并转移至100 mL容量瓶定容,摇匀;然后,精密移取各溶液1 mL置于100 mL容量瓶中,用稀释剂定容,过滤,取续滤液作为50%,80%,100%的供试品溶液.精密称取原研对照药品10.0 mg,加入稀释剂500 mL,配置成2 μg·mL-1的盐酸维拉佐酮溶液,过滤后作为对照品溶液;然后,按照色谱条件进样,进样量100 μL,用外标法的峰面积计算溶出量,溶出量与标示量之间的比值为回收率.
1.5.5 稳定性实验 取自制样品,按照建立的溶出度测定方法,分别在2,4,6,8 h时取适量溶出液,用0.45 μm的微孔滤膜过滤;然后,取续滤液加入稀释剂稀释成浓度为2 μg·mL-1的溶液作为供试品,进样量100 μL,注入液相色谱仪,记录峰面积.
1.5.6 滤膜吸附性实验 以醋酸溶液(pH=3.1)为溶出介质,取溶出液100 mL,分为5份.其中,第一份溶液经4 000 r·min-1离心5 min 后取上清液100 μL,其余四份分别弃去3,5,7,10 mL初滤液,取续滤液100 μL进样,注入液相色谱仪,记录峰面积.
1.6 体外溶出度的比较
为了更好地体现自制样品与参比制剂的一致性,本试验用相似因子法比较释药曲线间的异同[14-15].相似因子(f2)的计算公式为
上式中:n为取样点的总数;Rt和Tt分别代表两种制剂在时间t的平均累积释放度.f2的大小表示两条释药曲线的吻合程度,其取值范围为0~100,且f2越大,两条曲线的相似性越高,一般认为f2在50~100之间,两条释药曲线相似.
2 试验结果与分析
2.1 处方的筛选
对辅料(填充剂和崩解剂)用量的考察结果,如表4所示.表4中:F为脆碎度.由表4可知:处方1和处方2 在压片过程中出现粘冲现象,处方5溶出度略高于处方4,但是脆碎度明显增大.综合考虑,处方4为最优处方.在此基础上,进一步对崩解剂进行筛选.由表4可知:随着崩解剂用量的提高,溶出度由90.78%提高到99.05%.因此,将处方8暂定为最佳片芯处方.

表4 辅料用量的考察结果Tab.4 Results of investigation of excipient dosage
2.2 原料药与辅料的相容性
原辅料相容性考察结果,如图1所示.从图1可知:根据原料药与辅料的相容性,在有关物质测定中除原料本身的杂质外,无其他杂质出现,含量、晶型和参比制剂无明显差别,说明拟选用的辅料与原料相容性良好,可以进行后续的处方筛选.
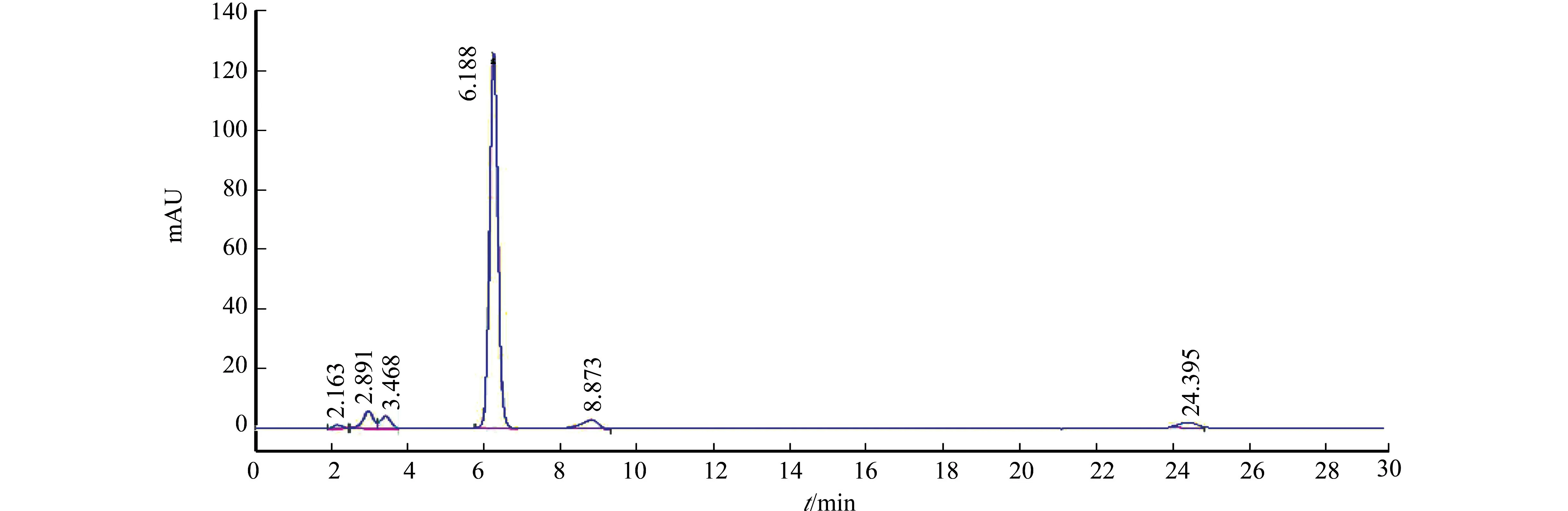
图1 盐酸维拉佐酮杂质图Fig.1 Impurity map of vilazodone hydrochloride
2.3 包衣材料对自制品溶出度的影响
自制素片和包衣片剂、参比制剂在不同溶出介质中的溶出曲线,如图2所示.从图2可知:4种溶出曲线基本一致,可见沪Q/WS-1-2273-99型欧巴代系列胃溶型包衣粉可用于盐酸维拉佐酮片的包衣.
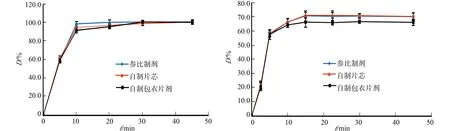
(a) 醋酸溶液(pH=3.1) (b) 水

(c) 磷酸盐缓冲液(pH=6.8) (d) 盐酸溶液(pH=1.0)图2 不同溶出介质中自制片芯和薄膜衣片与参比制剂的溶出曲线Fig.2 Dissolution profiles of homemade tablet cores, film-coated tablets and reference formulations in different dissolution media
2.4 专属性结果
对溶出介质、空白辅料、自制品和参比试剂进行专属性测试,结果如图3所示.从图3可知:溶出介质和空白辅料对主成分的测定均无干扰,本品专属性良好.

(a) 溶出介质

(b) 空白辅料
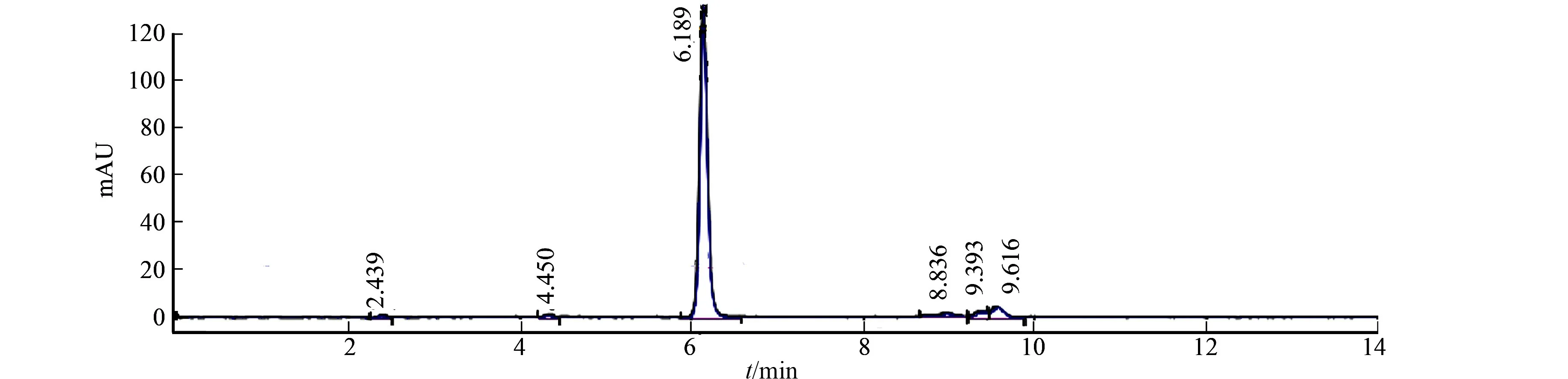
(c) 自制品

(d) 参比试剂图3 不同溶出介质专属性考察结果Fig.3 Results of investigations on specificity of different dissolution media
2.5 标准曲线的绘制
以盐酸维拉佐酮的浓度(X)和峰面积(Y)绘制标准曲线,得回归曲线方程:Y=186.75x+4.929 7,R2=0.999 7.表明盐酸维拉佐酮在1.00~12.08 μg·mL-1浓度范围内与峰面积的线性关系良好.
2.6 回收率
实验结果表明:盐酸维拉佐酮的回收率范围是98.50%~101.87%,平均回收率为99.54%,相对标准偏差(RSD)为1.07%.表明上述方法准确度良好,适合用于盐酸维拉佐酮的溶出度测定.

表5 滤膜吸附性的实验结果Tab.5 Experimental results of membrane adsorption
2.7 供试品溶液稳定性
由试验结果表明:供试品溶液在2,4,6,8 h时的峰面积RSD值分别为0.15%,0.19%,2.34%,3.16%.说明供试品溶液在4 h内稳定,故检测应在4 h内完成.
2.8 滤膜吸附性实验结果
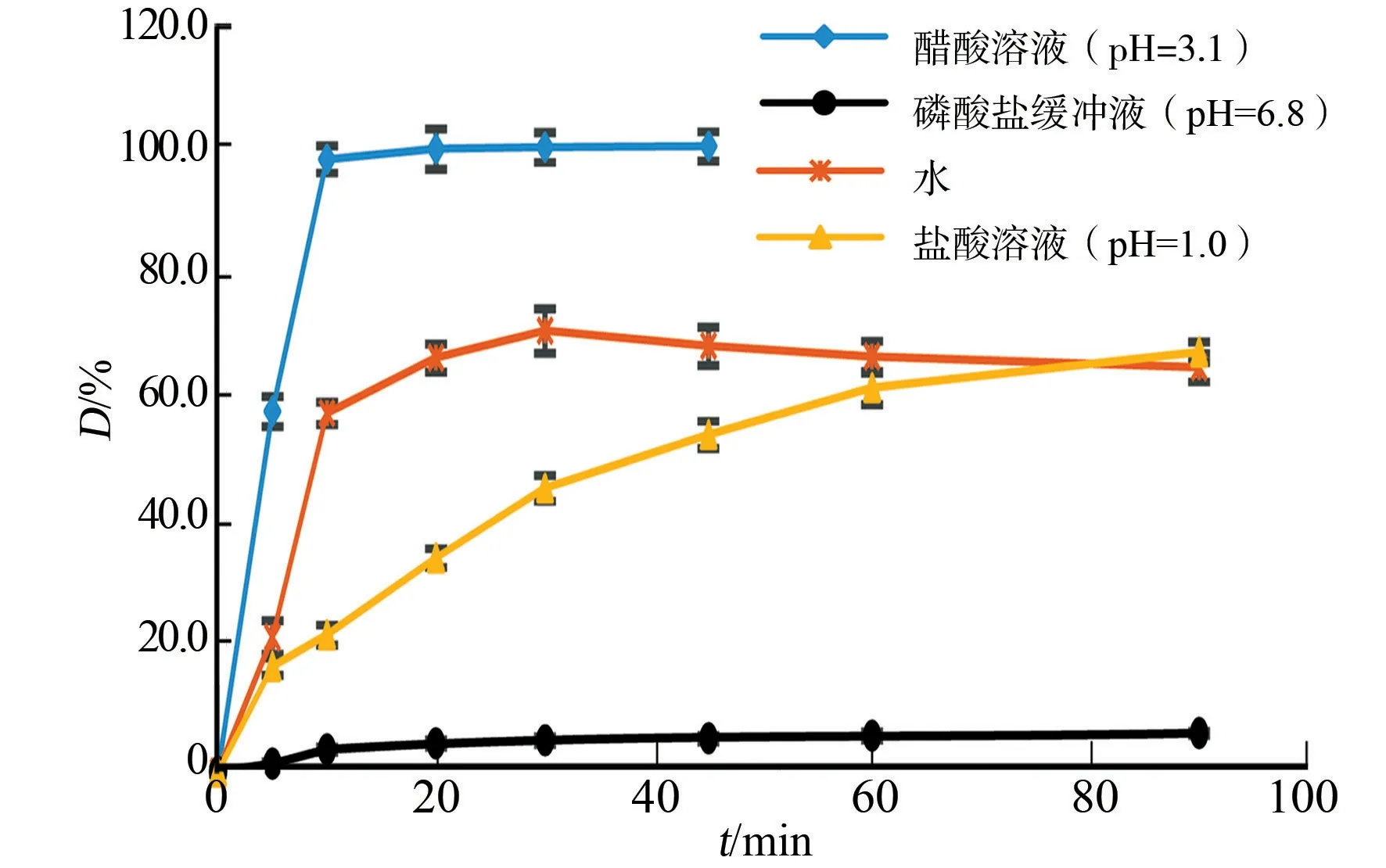
图4 参比制剂在4种溶出介质中的溶出曲线Fig.4 Dissolution curves of reference products in four kinds of media
滤膜吸附性的实验结果,如表5所示.从表5可知:在醋酸溶液(pH=3.1)中,盐酸维拉佐酮片经滤膜和离心处理后,其峰面积几乎无差异,RSD<2%.说明滤膜对盐酸维拉佐酮无吸附性.
2.9 原研制剂的体外溶出行为考察
以醋酸溶液(pH=3.1)、水、盐酸溶液(pH=1.0)和磷酸盐缓冲液(pH=6.8)各1 000 mL为溶出介质,转速为60 r·min-1,按中国药典2015年版四部通则0931第二法测定原研制剂的体外溶出行为[16].
分别于0,5,10,20,30,45,60,90 min时取适量溶出液(醋酸溶液n=5),用0.45 μm的微孔滤膜过滤;然后,取续滤液加入溶出介质,稀释成浓度为2 μg·mL-1的溶液作为供试品,用高效液相色谱进行测定.参比制剂在4种溶出介质中的溶出曲线,如图4所示.
2.10 与原研制剂体外溶出度的比较
采用相似因子法对三批自制品与参比制剂的溶出度进行评价.在4种溶出介质中,三批自制品与参比制剂的溶出曲线图,如图5所示.从图5可知:在醋酸溶液(pH=3.1)中,三批自制品在15 min内溶出度均为85%以上,与参比制剂一致;水中f2为79,磷酸缓冲液中f2为66,盐酸溶液中f2为64.
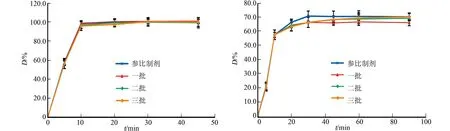
(a) 醋酸溶液(pH=3.1) (b) 水
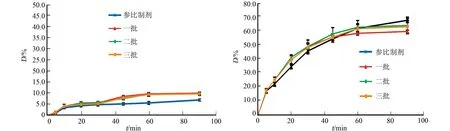
(c) 磷酸盐缓冲液(pH=6.8) (d) 盐酸溶液(pH=1.0)图5 不同溶出介质中三批自制品与原研制剂的溶出曲线Fig.5 Dissolution curves of three batches of self-produced products and original preparation in different dissolution media
3 讨论
首先,参照原研制剂,对盐酸维拉佐酮片的辅料进行筛选,通过原辅料相容性试验,初步拟定辅料种类.通过单因素试验对辅料的用量进行考察,确定主药10 g、乳糖60 g、微晶纤维素26 g、交联羧甲基纤维素钠1 g、二氧化硅2 g、硬脂酸镁1 g为最优处方.然后,将原辅料进行微粉化后,过100目筛,加入到混合料斗中充分混合.采用直接压片法制备盐酸维拉佐酮片.以高效液相色谱法建立盐酸维拉佐酮片的溶出度检测方法,该方法准确度高、操作简单,可作为体外一致性评价的重要检测方法.
根据国家食品药品监督管理总局(CFDA)发布的《普通口服固体制剂溶出曲线测定与比较指导原则》,通过比较多条溶出曲线的相似性,评价自研制剂与原研制剂的质量一致性.相似因子f2法是目前较常见的评价溶出度的方法之一,故本试验通过比较自制品和原研制剂在4种不同的溶出介质中的溶出行为,确定其质量一致性.结果表明,自制品在醋酸溶液(pH=3.1)中45 min内的累积释放度大于80%,符合药典要求,在水中的累积释放度大于60%,在盐酸溶液(pH=1.0)中的累积溶出度大于50%,而在磷酸缓冲液(pH=6.8)中的累积释放度很小.由于相似因子f2均大于50,说明自制品与原研制剂的体外溶出行为具有较高的一致性.但这并不能说明盐酸维拉佐酮片仿制成功,后期应进行生物等效性试验的考察.
