陆地棉苗期低温响应基因GhZAT10 的克隆及功能研究
2020-07-23杨永飞葛常伟沈倩张思平刘绍东马慧娟陈静刘瑞华李士丛赵新华李志坤庞朝友
杨永飞,葛常伟,沈倩,张思平,刘绍东,马慧娟,陈静,刘瑞华,李士丛,赵新华,李志坤,庞朝友*
(1.河北农业大学/ 棉花生物学国家重点实验室河北基地,河北 保定071001;2.中国农业科学院棉花研究所/ 棉花生物学国家重点实验室,河南 安阳455000)
低温胁迫是主要的逆境胁迫之一[1],严重影响植物生长发育和产量,通常分为冷害胁迫和冻害胁迫。 冷害胁迫温度通常为0~15 ℃;冻害胁迫的温度在0 ℃以下,会导致植物细胞内与细胞间产生冰晶造成机械损伤,进而破坏植物的正常生长[1-3]。
植物的冷害损伤表型通常为叶片呈水渍状,叶片或果实出现病斑。 这些受损的组织易出现局部坏死或被病菌侵染[4]。 普遍认为细胞膜是植物感受低温信号的最初部位[5],同时也是植物受到低温胁迫后最早遭到破坏的位置[6]。 通常膜脂不饱和度较高的植物抗寒性较强,在低温下可保持细胞膜的流动性[7]。 低温胁迫还会导致植物叶绿素合成受阻,光合和呼吸作用减弱等[8]。 棉花是1种亚热带植物,最适生长温度为25~30 ℃,当环境温度低于15 ℃,表现为无法正常生长,且易发真菌病害,最终导致大田缺苗、减产[9-10]。 近年来,我国主要棉区逐步“西进,东移,北上”[11],作为最大棉区的新疆属于典型的大陆性气候,春季常发生倒春寒,每年因烂种、烂芽、死苗而导致部分棉田重播[12],严重影响了棉花产量及纤维品质。
植物对环境条件变化的适应由调控基因和信号分子的复杂网络控制[13-14]。 目前,植物中已鉴定出众多抗逆相关转录因子, 包括MYB、AP2/ERF、WRKY、ZFP、NAC、bHLH 等[15]。其中锌指蛋白(Zinc finger protein,ZFP)为具有手指状结构,并与Zn2+结合的1 类转录因子,最早在非洲爪蟾(Xenopus laevis)的卵母细胞TFIIIA 中发现[16]。 前人通过半胱氨酸和组氨酸残基数量和位置, 将锌指蛋白分为C3H、C2H2、C4、C6、C8、C2C2、C4HC3、C3HC4、C2HC5、C2HC 等类型[17-18],C2H2型锌指蛋白由大约30 个氨基酸和2 对保守的Cys 和His 四面体结合的锌离子组成[19]。 在植物抗逆相关转录因子中,C2H2型锌指蛋白研究最多[20],其包含植物特有的QALGGH 保守序列[21]。AZF2 和STZ 在拟南芥(Arabidopsis thaliana)中作为转录抑制因子,在生长迟缓后增加对逆境的耐受性[22]。Park 等[23]发现ZAT10、WRKY33、ERF5、RAV1 和HSFC1 等以类似于CBF 的方式在冷胁迫下诱导冷响应基因的表达。 拟南芥中LOS2 抑制STZ/ZAT10 的表达,los2 突变体在冷和光下表现出低温敏感性[24]。 对小桐子(Jatropha curcas)进行低温处理, 发现JcZAT10 在低温下瞬时诱导,低温处理3 h 后在各组织的表达量达到最高[25]。 王晋成[26]对棉花的5 个锌指蛋白基因(GhSAP1、GhZFP2、GhZFP3、GhBBX1 和GhRCHY1) 进行了研究,发现其参与棉花对逆境胁迫的响应。
棉花在苗期更易遭受低温冷害[27],幼苗的状态会对后期的生长发育及作物的产量和质量产生重要的影响[28]。本实验室对4 ℃低温处理0、1、3、6、12 h 的新陆中16 叶片进行转录组分析 (数据未发表), 发现1 个功能注释为ZAT10(Gh_D05G2011) 的基因在低温胁迫1 h 后迅速上调表达,3 h 和6 h 时的表达量分别上调11.4倍和28.1 倍,且12 h 内表达量持续上调,推测该基因可能在棉花低温响应中具有重要作用。 因此,克隆了该基因并命名为GhZAT10,对其进行生物信息学分析;构建植物表达载体进行亚细胞定位分析; 对GhZAT10 进行低温诱导和不同组织表达谱分析, 利用病毒诱导的基因沉默技术(Virus-induced gene silencing,VIGS)研究了该基因在棉花耐冷方面的作用。
1 材料与方法
1.1 试验材料
试验所用棉花材料为陆地棉新陆中16 号,由中国农业科学院棉花研究所种质资源中期库提供,拟南芥野生型(Col-0 生态型)由中国农业科学院棉花研究所生理生态课题组保存。
1.2 试验方法
1.2.1 棉花材料培养及低温处理。 棉花材料在中国农业科学院棉花研究所郑州科研中心28 ℃恒温光照室进行育苗(光照16 h,黑暗8 h),采用营养土与蛭石体积比3∶1 混合基质培养, 并保证水分条件充足。 子叶平展时将材料放入低温冷室进行4 ℃处理(光照16 h,黑暗8 h)。
1.2.2 RNA 的提取。 使用天根生化科技有限公司(北京)生产的多糖多酚植物总RNA 提取试剂盒对以上所取材料进行RNA 提取,并利用Tran-Script®All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-step gDNA Removal)试剂盒将RNA 反转录合成第1 链cDNA, 以反转录获得的棉花cDNA 为模板。 利用Nanodrop 2000核酸分析仪测定cDNA 的浓度和纯度。
聚合酶链反应 (Polymerase chain reaction,PCR)程序、扩增产物检测和纯化均参考所用试剂操作说明书。PCR 产物胶回收纯化试剂盒购自OMEGA Bio-tek 公司,大肠杆菌感受态DH5α 购自北京康为世纪生物科技有限公司, 农杆菌LBA4404、GV3101 购自上海唯地生物技术有限公司。 PCR 所用的KOD FX 高保真聚合酶、同源重组酶、限制性内切酶、cDNA 反转录试剂盒分别购自东洋纺(上海)生物科技有限公司、南京诺唯赞生物科技有限公司、NEB 和Takara (中国,大连)公司;氨苄、卡那霉素和利福平等抗生素购自北京索莱宝科技有限公司;引物合成和测序由河南尚亚生物技术有限公司公司完成,其他试验均在棉花生物学国家重点实验室进行。
1.2.3 低温下棉花组织中GhZAT10 的表达分析。棉花子叶期进行4 ℃处理,处理时间分别为0(对照)、1、3、6 和12 h,剪取棉花根、茎、叶(3 个生物学重复), 放入液氮速冻,-80 ℃保存备用。实时荧光定量PCR (Quantitative real-time polymerase chain reaction,qRT-PCR)分析反应体系和反应程序按照SYBR Premix Ex Taq (目录号:DRR041A)荧光定量试剂盒说明书进行,使用的荧光定量PCR 仪器型号是LightCycler 480, 操作方法参考分析仪说明书。通过qPrimerDB 网站(https://biodb.swu.edu.cn/qprimerdb/)设 计GhZAT10 的qRT-PCR 引物pGqZAT10 (表1)。 内参基因为GhActin7(Gh_D11G0593),引物为pGhActin7(表1),每个反应设置3 个重复。参考Livak 等[30]报道的2-ΔΔCT方法计算基因的相对表达量。
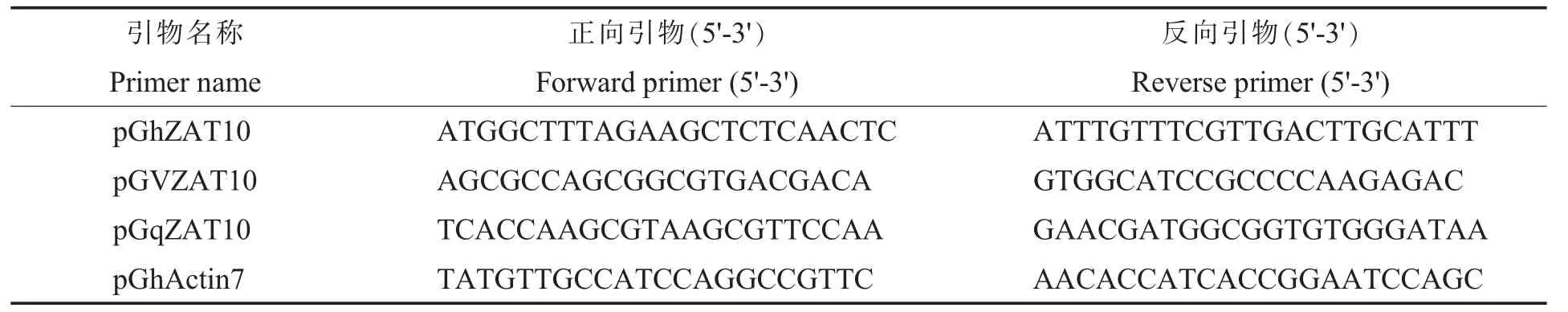
表1 本研究所使用的引物Table 1 Primers used in this study
1.2.4 GhZAT10 基因的克隆。 基于本实验室未发表的RNA-seq 数据, 发现1 个功能注释为ZAT10 蛋白的基因(Gh_D05G2011)在冷胁迫后表达量显著上调,推测其参与棉花低温响应信号调控,并将其命名为GhZAT10。 该基因序列来源于南京农业大学陆地棉基因组信息(http://mascotton.njau.edu.cn/info/1054/1118.htm), 登录号:XM_016893867.1。 根 据GhZAT10 基 因 参 考 序列,设计扩增引物pGhZAT10(表1),PCR 扩增获得GhZAT10 基因。
1.2.5 生物信息学分析。 CottonFGD 网站(http://www.cottonfgd.org/)是具综合功能的棉花基因组学平台,可用其快速获取和可视化基因组信息[29]。在该网站输入Gene ID(Gh_D05G2011)后,通过Homology 功能选项得到与GhZAT10 同源性较高的8 个物种,并通过链接转至phytozome 植物基因组下载网站(https://phytozome.jgi.doe.gov/)下载同源蛋白序列。 使用软件DNAMAN 进行核苷酸多序列分析和比对,用MEGA 7 软件构建进化树, 利用SMART(http://smart.embl-heidelberg.de/) 和NCBI 的CDD 数 据 库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) 对蛋白保守结构域进行预测, 使用EXPASY(http://web.expasy.org/cgi/-bin/compute_pi/pi_tool)对蛋白质的相对分子质量和理论等电点进行分析,使用SignalP4.0 Server(http://web.expasy.org/cgi/-bin/compute_pi/pi_tool)进行跨膜结构域预测。 通过Net-Phos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)分析GhZAT10 基因编码蛋白的磷酸化位点。
1.2.6 亚细胞定位载体构建。 利用Gateway 技术构建35S::GhZAT10-GFP 荧光表达载体。 Gateway 技术所用引物为目的基因扩增引物pGhZAT10(表1),以GhZAT10 基因作为模板进行BP 反应连接至pDONR-zeo,再转化至大肠杆菌感受态DH5α, 得到阳性菌株送河南尚亚生物技术有限公司公司测序,确认克隆正确。 提取质粒进行LR 反应, 连接至终载体pEarlyGate103,转化至农杆菌GV3101,注射生长5~6 周的本氏烟进行亚细胞定位。
1.2.7 棉花VIGS 载体的构建。 本试验采用的VIGS 载体系统为:TRV2(空载体)、TRV1(辅助载体)、TRV:PDS (阳性对照),VIGS 基因片段引物(不跨保守域)为pGVZAT10(表1)。选择EcoRⅠ和BamHⅠ对载体pTRV2 进行双酶切,并利用同源重组构建VIGS 载体TRV:GhZAT10, 转化大肠杆菌DH5α, 测序正确后转化农杆菌感受态LBA4404。 菌液保存在15%(体积分数)甘油中,置于-80 ℃冰箱长期保存。
1.2.8 数据分析。 用MS Excel 2013 进行数据处理和作图;利用SPSS 19.0 软件进行方差分析。
2 结果与分析
2.1 GhZAT10 基因的克隆及特征分析
以冷胁迫处理后新陆中16 的cDNA 为模板,通过克隆并测序验证得到与参考基因组序列相同的GhZAT10 基因序列。 通过NCBI 网站的CDD 工具在线分析,发现GhZAT10 具有2 个锌指结构域(图1),其编码蛋白属于C2H2型锌指蛋白。 其开放阅读框长度为813 bp,定位于D05 染色体的18 476 195~18 477 007 bp,编码包含270个氨基酸残基(Amino acid,aa)的多肽链。 基因结构分析显示该基因没有内含子。
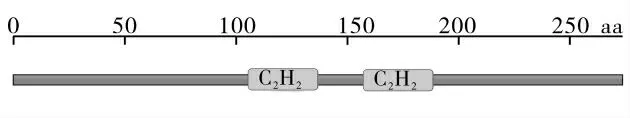
图1 GhZAT10 蛋白保守域分析Fig. 1 The conserved domain analysis of GhZAT10 protein
2.2 棉花组织中GhZAT10 基因的表达分析
对低温下棉花叶片中的GhZAT10 进行qRT-PCR 检测,以处理0 h 为对照,发现冷处理后表达量迅速提高, 处理1 h 后GhZAT10 的表达量上升13.4 倍,处理3 h 后表达量继续升高至50.3 倍,处理6 h 后为119.3 倍,至处理后12 h 达264.1 倍 (图2A)。 对 棉 花 根、 茎、 叶 中 的GhZAT10 基因的表达模式进行分析, 以低温处理0 h 的茎中的GhZAT10 表达量作为对照,发现正常条件下GhZAT10 在根、 茎、 叶中均有表达;4 ℃低温处理6 h 后,该基因在根、茎、叶中的表达量与0 h 相比均上调约13 倍(图2B),且在根中表达量最高, 是其在茎中表达量的3.98 倍。以上结果表明,GhZAT10 在棉花的根中表达量较高,且受低温诱导,可能在响应低温中发挥重要作用。
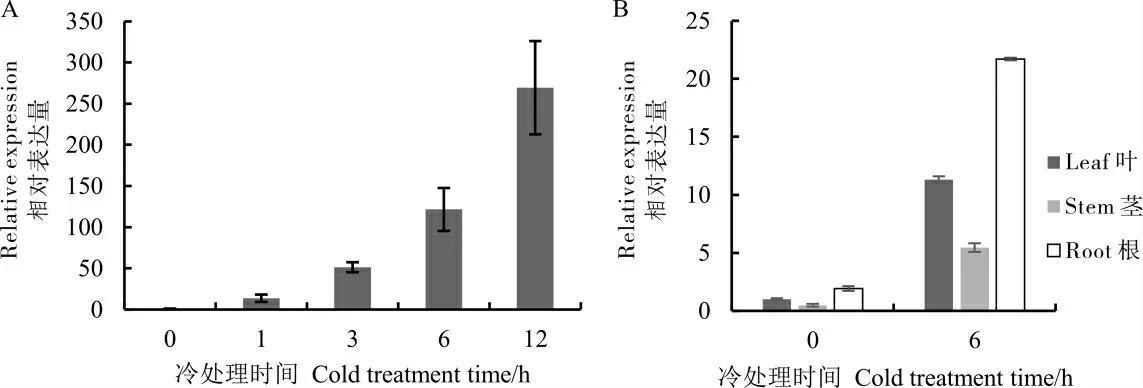
图2 GhZAT10 的低温表达分析Fig. 2 Expression analysis of GhZAT10 at low temperature
2.3 GhZAT10 蛋白的理化性质及跨膜结构和磷酸化位点预测分析
通过EXPASY 网站对GhZAT10 蛋白进行序列和理化性质分析,GhZAT10 蛋白质一级结构中丝氨酸(12.2%)、苏氨酸(10.7%)含量高,蛋氨酸(1.5%)和酪氨酸(1.5%)含量较低(图3A);该蛋白的相对分子质量为28.57 kDa, 理论等电点为6.82,有21 个带负电荷的氨基酸残基、25 个带正电荷氨基酸残基; 分子式为C1225H1933N367O401S11,脂肪酸系数为54.63,平均亲水性为-0.583,不稳定系数为59.40,为不稳定蛋白。 利用SignalP5.0 Server 人工神经网络算法对GhZAT10 基因编码的蛋白进行信号肽预测,发现其不具有信号肽剪切位点,表明该基因编码的蛋白无信号肽。 利用TMHMM2.0 SERVER 对GhZAT10 基因编码的蛋白进行跨膜结构预测,预计跨膜螺旋的数量为0, 且跨膜螺旋中氨基酸残基的预期数 (Exp)为0.000 63,远小于18,推测其没有跨膜螺旋。 通过NetPhos3.1 Server 分析,GhZAT10 基因编码的蛋白共含37 个磷酸化位点,其中丝氨酸(Serine)磷酸化位点22 个、苏氨酸(Threonine)磷酸化位点13 个、 酪氨酸(Tyrosine) 磷酸化位点2 个(图3B),推测GhZAT10 蛋白的活性与其磷酸化调控关系密切。
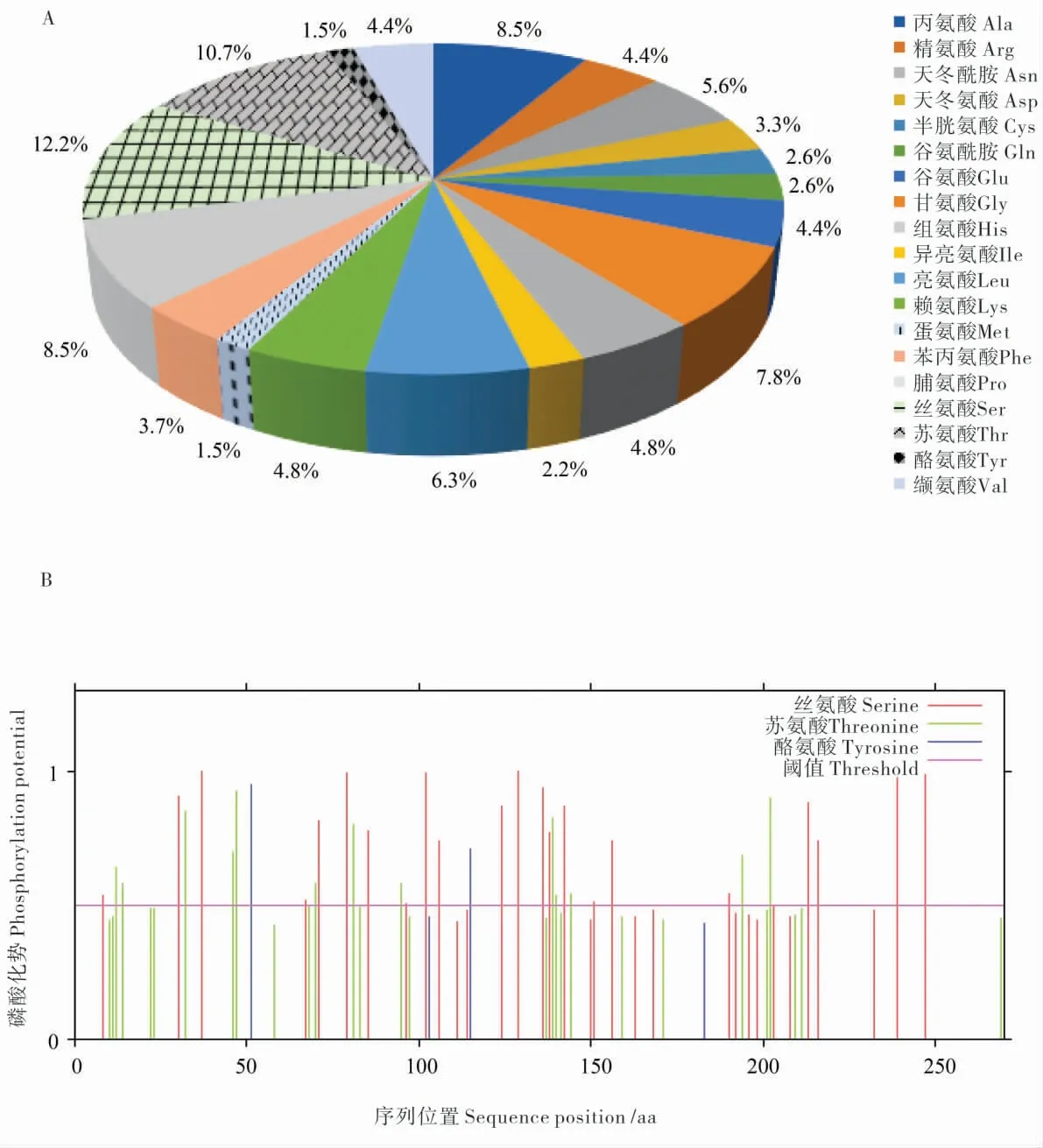
图3 GhZAT10 的生物信息学分析Fig. 3 The bioinformatics analysis of GhZAT10
2.4 GhZAT10 蛋白与其他物种ZAT10 蛋白的进化关系分析
CottonFGD 网站中,GhZAT10 蛋白与已报道的可可(Theobroma cacao)、 番木瓜(Carica papaya)、木 薯(Manihot esculenta)、杨 树(Populus trichocarpa)、 甜 橙 (Citrus sinensis)、 水 蜜 桃(Prunus persica)、大豆(Glycine max)和拟南芥这8 个物种同源基因编码的蛋白序列相似性很高,至少为50%。 通过DNAMAN 序列比对发现GhZAT10 与以上物种中的同源蛋白均具有QALGGH 保守序列(图4),均为典型的双锌指蛋白。 通过MEGA7 对以上物种ZAT10 蛋白序列绘制进化树, 结果发现GhZAT10 蛋白与可可、拟南芥、甜橙中的ZAT10 蛋白存在同源性(图5)。

图4 GhZAT10 蛋白序列比对Fig. 4 Alignment of GhZAT10 protein sequences
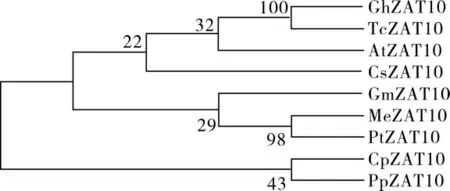
图5 GhZAT10 与8 个植物ZAT10 蛋白的进化树分析Fig. 5 Phylogenetic tree analysis of GhZAT10 protein and eight ZAT10 proteins in other plants
2.5 GhZAT10 亚细胞定位
通过构建好的GhZAT10::GFP 蛋白融合表达载体,利用农杆菌GV3101 注射本氏烟,激光共聚焦显微镜下观察GhZAT10::GFP 融合蛋白及对照35S::GFP 蛋白的发光情况, 进行GhZAT10 蛋白的亚细胞定位分析。 结果显示共聚焦观察下对照35S::GFP 的绿色荧光分布在整个细胞中(图6A~C),而35S::GhZAT10-GFP融合蛋白的绿色荧光信号主要分布在细胞核中(图6D~F),表明GhZAT10 蛋白定位于细胞核。
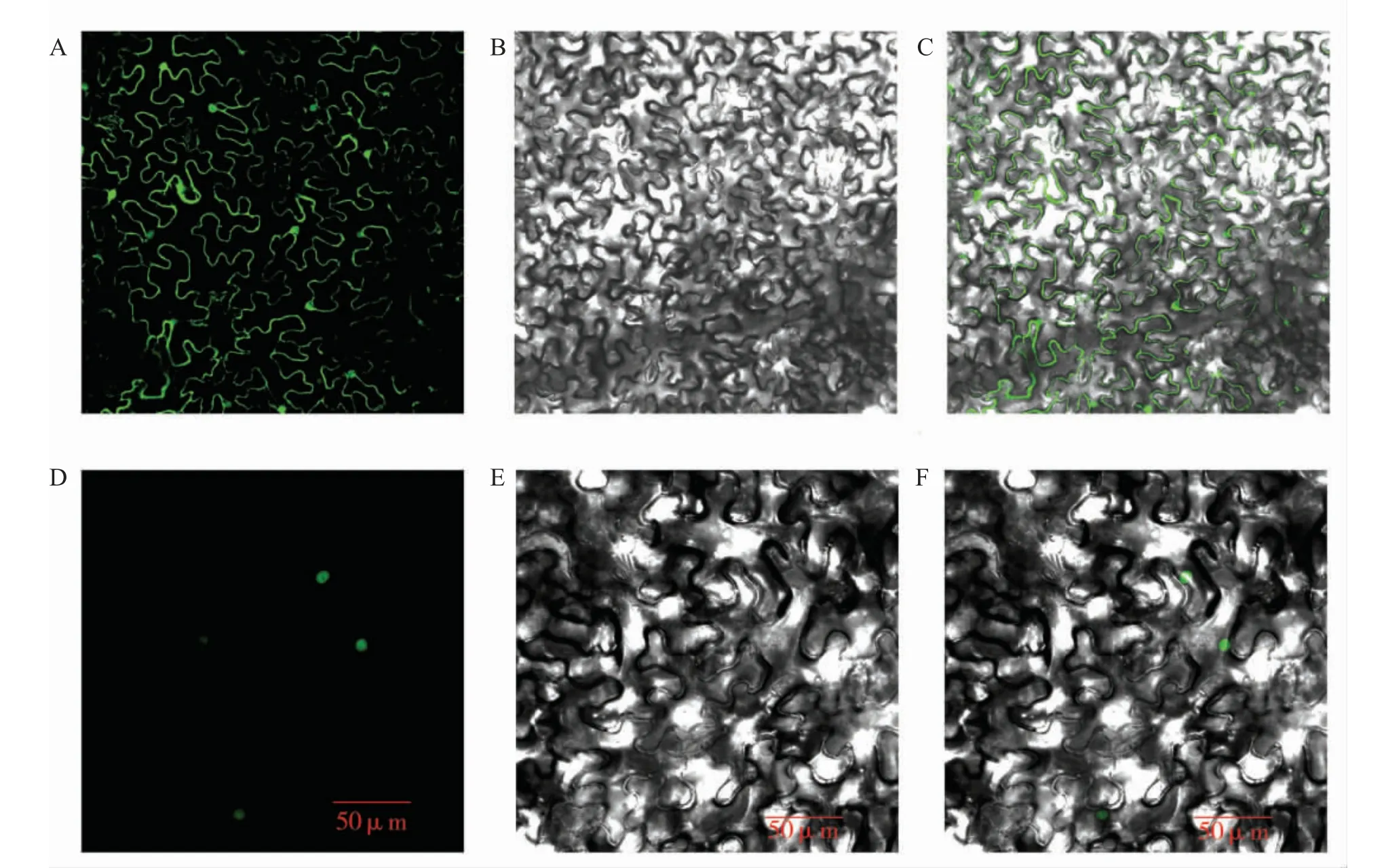
图6 GhZAT10 蛋白的亚细胞定位Fig. 6 Sub-cellular localization of GhZAT10 protein
2.6 VIGS 棉花的冷敏感表型
通过VIGS 技术沉默棉花的GhZAT10 基因,VIGS 植株(TRV:GhZAT10)和空载体对照植株(TRV:00)在4 ℃低温处理4~5 d,然后28 ℃正常温度下恢复处理15 d,观察到空载体对照植株(图7A)无明显冷害表型,而VIGS 植株(图7B)均出现明显的叶枯现象。本试验共3 次重复,每次重复中,VIGS 棉株和阴性对照棉株为60株,阳性对照为20 株,且95%的阳性对照(TRV:PDS)植株呈现白化表型(图7C),说明载体系统可靠。 荧光定量检测冷处理后VIGS 棉花中GhZAT10 的平均沉默效率,结果显示VIGS 植株GhZAT10 的表达水平下降了64.7%(图7D),表明VIGS 植株的该基因已被沉默。 综上所述,GhZAT10 在陆地棉冷胁迫响应信号途径中具有积极作用。
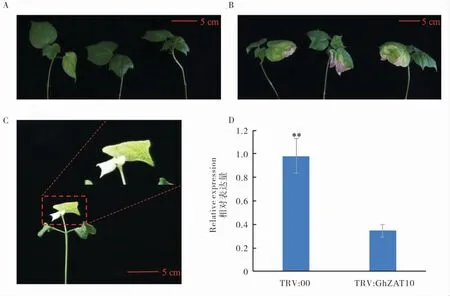
图7 棉花VIGS 植株的表型和GhZAT10 的qRT-PCR 检测结果Fig. 7 Phenotype of VIGS plants and the qRT-PCR analysis of GhZAT10 at low temperature
3 讨论
GhZAT10 包含2 个典型的C2H2锌指结构域,为典型的双C2H2锌指蛋白(图1)。 在植物对逆境的响应中,双锌指蛋白发挥重要作用[26],水稻的Q-型锌指[31]、拟南芥的AZF1、AZF2、AZF3 和STZ/ZAT 以及棉花中的CSTZ 都属于双锌指蛋白[32-33]。 GhZAT10 蛋白富含丝氨酸和苏氨酸,蛋氨酸和酪氨酸含量较少,不含色氨酸、吡咯赖氨酸、硒半胱氨酸(图3A),说明其主要由高度亲水性氨基酸组成,可能使该蛋白更好地保持水分[34],推测可能与植株对渗透胁迫的耐受性有关。 该蛋白不具备信号肽,等电点为6.82,属于不稳定蛋白;同时富含磷酸化位点(图3B),推测与磷酸化调控关系密切。 序列分析表明,陆地棉和可可、拟南芥等植物的ZAT10 蛋白均含有植物特有的QALGGH 保守序列(图4),相似性至少为50%。进化树分析发现,陆地棉GhZAT10 与可可、拟南芥、甜橙的ZAT10 蛋白存在同源性,前人研究发现ZAT10 在拟南芥中在冷胁迫下会诱导冷响应基因的表达,抑制ZAT10 的表达后,植株的耐冷性减弱[23],推测GhZAT10 可能具有相似的功能。
亚细胞定位分析显示,GhZAT10 蛋白定位在细胞核中, 与拟南芥中的ZAT10 蛋白定位结果[22]一致。 苗期低温处理,发现GhZAT10 在早期快速响应低温胁迫。 对低温处理前后陆地棉根、茎、 叶中GhZAT10 的qRT-PCR 检测结果显示:正常条件下,GhZAT10 在根中表达量最高;冷胁迫6 h 后,该基因迅速上调表达。 王晋成[26]研究发现GhZFP2、GhZFP3 在根中表达量最高,GhZAT10的组织表达特异性与之相似,且该基因受低温诱导, 推测GhZAT10 可能在响应低温中发挥重要作用。 Mittler 等[35]研究表明,过表达拟南芥ZAT10 可以增强植物对盐、热和渗透胁迫的耐受性;有趣的是,敲除该基因也可以增强对盐、渗透胁迫的耐受性。 推测ZAT10 的沉默可能激活了其他防御反应,从而未减弱植物对非生物胁迫的耐受性。 而ZAT10 在棉花中的功能研究还未见报道,本研究将进一步深入研究,探讨其分子机制。 利用VIGS 技术沉默GhZAT10, 发现VIGS植株在低温处理下的叶面冷害创伤较阴性对照严重, 表明锌指蛋白转录因子GhZAT10 可能对棉花的耐冷性起积极作用, 初步明确了GhZAT10 在棉花响应低温胁迫信号途径中有重要功能。
据调查,棉苗受到低温或阴雨天会诱发棉花的苗期病害[36]。通过对北疆棉花幼苗冻害的研究,冻伤程度达到15%时,就会推迟棉花的生育期[37]。目前棉花的耐冷研究主要集中于棉花苗期的耐冷性鉴定和低温萌发能力等方面[38-41],关于苗期棉花低温响应的分子机制研究较少。 本研究通过对显著响应低温胁迫的基因GhZAT10 进行克隆、生物信息分析、亚细胞定位、表达模式分析及基因功能研究,为棉花苗期响应低温的分子机制研究提供了新的依据。
4 结论
本研究发现1 个冷胁迫下显著上调表达的GhZAT10 基因,通过生物信息分析表明其编码1个由270 个氨基酸残基组成、 具有双C2H2锌指结构的不稳定蛋白。 GhZAT10 在棉花根中的表达量较高,低温处理后在根、茎、叶中均迅速上调表达,可能在响应低温中发挥重要作用。 氨基酸成分分析表明,GhZAT10 为1 个亲水性强的蛋白;进化树分析表明它与可可、拟南芥、甜橙的ZAT10 蛋白同源性较高;GhZAT10 蛋白定位于细胞核中;VIGS 沉默该基因的棉花在低温下表现出更明显冷损伤表型。 综上所述,GhZAT10 在陆地棉冷胁迫响应信号途径中具有积极作用。
