陆地棉NF-YA 基因家族的全基因组鉴定与功能分析
2020-07-23潘奥王静静孙福来张景霞高阳杜召海焦梦佳张军王芙蓉刘志
潘奥,王静静,孙福来,张景霞,高阳,杜召海,焦梦佳,张军,王芙蓉*,刘志
(1.湖南农业大学生物科学技术学院, 长沙410128;2.农业农村部黄淮海棉花遗传改良与栽培生理重点实验室/山东棉花研究中心, 济南250100;3.山东省滨州市种子管理站,山东 滨州256618)
核因子Y(Nuclear factor Y,NF-Y)是真核生物中广泛存在的1 类转录因子, 由NF-YA、NF-YB 和NF-YC 3 个亚基组成,NF-Y 复合体与启动子区域的CCAAT 保守基序特异性结合,调控下游基因表达,参与调控开花时间和逆境反应等重要生理过程[1-4]。 为了激活目标基因,NF-YB和NF-YC 在细胞质中形成二聚体, 并移动到核中与NF-YA 相互作用, 进而与靶基因结合发挥相应功能[5-8]。 越来越多的证据表明FT(FLOWERING LOCUS T)基因上游的CCAAT 框对植物开花起关键作用[9-10],而NF-Y 复合体通过NF-YA与这5 个碱基直接接触,NF-YB/NF-YC 二聚体主要在相邻区域进行非序列特异性接触以稳定复合物[11]。同时CO(CONSTANS)基因的CCT 结构域也可结合在CCAAT 框上, 可能与NF-YA存在竞争关系,从而在植物开花调控中起重要作用[10,12-14]。
NF-YA 是多基因家族, 研究表明过表达NF-YA1 和NF-YA4 基因导致植物晚开花,NF-YA7 和NF-YA9 有相同的作用, 对开花具有负调控作用[15]。 NF-YA2 也被证明是开花中的负调控因子[1],但Hou 等[3]认为NF-YA2 是开花时间的正向调控因子,因为该转录因子通过与不含CCAAT 顺式调控元件的SOC1(SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1)基因而不是FT 基因结合进行调控的, 并猜测这可能是赤霉素调控开花途径的重要方式[16]。 可见,NFYA 基因家族成员在植物开花中起不同的调控作用。 目前,在拟南芥(Arabidopsis thaliana)[13]、番茄(Solanum lycopersicum)[17]、水 稻(Oryza sativa L.)[18]、高粱(Sorghum bicolor L.)[19]、鹰嘴豆(Cicer arietinum L.)[20]和 油 菜(Brassica napus L.)[21]等 鉴定了NF-YA 基因家族,但在棉花上尚未见报道。近年异源四倍体陆地棉基因组测序的完成[22-24],为棉花开花途径相关基因的鉴定提供了基础。 本研究利用生物信息学方法对陆地棉NF-YA 基因家族进行了鉴定、进化和表达分析等,为深入研究棉花开花分子机制提供理论基础。
1 材料与方法
1.1 陆地棉NF-YA 基因家族成员鉴定
在Pfam 数 据 库(http://pfam.xfam.org/)中 搜索编号PF02045,找到CBFB_NFYA 结构域的隐马尔可夫模型(Hidden Markov model,HMM),从棉花功能数据库(http://www.cottonfgd.org/)中下载异源四倍体陆地棉 (Gossypium hirsutum L.)、四倍体海岛棉(G. barbadense L.)、二倍体亚洲棉(G.arboreum L.)和雷蒙德氏棉(G.raimondii L.)等物种的全基因组文件信息,利用HMMER 3.0[25]中的Hmm search 功能, 从拟南芥(Arabidopsis thaliana L.) 数 据 库TAIR10 (https://www.arabidopsis.org/)[26]下载拟南芥全基因组文件信息,通过全基因组NF-YA 基因家族的预测得到候选基因, 将获得的序列在NCBI 网站中的Conserved Domain 数 据 库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、SMART(http://smart.embl-heidelberg.de/)[27]搜索,进一步确定其保守结构域。 利用在线网站(https://web.expasy.org/compute_pi/) 获得蛋白的等电点和相对分子质量的信息, 然后在http://cello.life.nctu.edu.tw/网站[28-29]进行亚细胞定位预测。
1.2 陆地棉NF-YA 基因系统发育树的构建
通过MEGA 7.0[30]软件中的MUSCLE 模块进行序列比对,然后进行最佳碱基替代模型的搜索,找到JTT+G+I(Jones-Taylor-Thornton(JTT)with gamma distributed and invariant sites) 模型,最后利用最大似然法(Maximum likelihood,ML)构建系统进化树,bootstrap 值设置为1 000 次。
1.3 陆地棉NF-YA 基因结构及其编码蛋白保守基序分析
利用Tbtools[31]软件从陆地棉基因组测序数据库基因的注释文件中调取NF-YA 基因家族的每个基因所在的DNA 位置信息, 利用perl 脚本将NF-YA 基因家族成员编码的蛋白质序列提取出来,然后提交到MEME 在线网站[32](http://meme-suite.org/)对其保守基序进行分析。 设置最大查找数目为10,其他的为默认参数。
1.4 陆地棉NF-YA 基因启动子分析
利用perl 脚本提取棉花NF-YA 家族基因编码序列(Coding sequence, CDS)上游2 000 bp 序列,默认为启动子区域;利用在线启动子预测网站PlantCare[33](http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行分析,将得到的结果信息整理,利用Tbtools 进行可视化展示。
1.5 陆地棉NF-YA 基因家族染色体分布和同源性分析
根据下载的陆地棉全基因组编码蛋白信息,利用blastp 比对蛋白序列,再利用MCScanX[34]软件进行全基因组的共线性分析,得到区块信息和基因对信息文件, 再利用prel 脚本整理数据,然后用circos[35]软件对结果进行可视化展示。 再将这些基因对利用KaKs_Calculator2.0[36]软件进行Ka、Ks和Ka/Ks的计算。
1.6 陆地棉NF-YA 基因家族组织表达模式分析
从NCBI 的SRA 数据库(http://www.ncbi.nlm.nih.gov/sra/)下载陆地棉TM-1 的茎、叶片、花托、花瓣、雄蕊、雌蕊等相关转录组测序数据,下载序列号 分 别 为SRS781206、SRS781207、SRS781208、SRS781209、SRS781210、SRS781211。基于以上数据,利用Tophat[37]和Cufflink[38]软件包分析转录组测序数据并进行表达量计算, 提取NF-YA 基因家族成员的基因表达数据,将表达数据标准化后(log2(FPKM)),利用R 语言pheatmap 将表 达数据可视化。
1.7 棉花NF-YA 基因家族在不同光照周期处理下的表达分析
陆地棉早熟品种鲁棉研19 号(L19)[39]和晚熟品种鲁棉研37 号(L37)[40]盆栽后,在培养箱中28 ℃/25 ℃培养, 设置不同日照时间, 长日照16 h/8 h,短日照10 h/14 h。 分别采集一叶期、二叶期、三/ 四叶期、五/ 六叶期4 个不同发育时期的幼叶进行实时定量聚合酶链反应(Quantitative real-time polymerase chain reaction,qRT-PCR)验证,每个样品3 个生物学重复,分析NF-YA 基因家族成员的表达模式。 选取家族成员GhNF-YA4 、GhNF-YA7、GhNF-YA10、GhNF-YA12、GhNFYA15、GhNF-YA16、GhNF-YA18、GhNF-YA22、GhNF-YA24、GhNF-YA26、GhNF-YA28、GhNFYA29 进行定量分析。 采用Prime Scrip First Strand cDNA Synthesis Kit(Takara,大连)反转录合成cDNA 第1 条链,使用SYBR Premix Ex TaqⅡ(Takara,大连)在LightCycle 480 高通量实时定量PCR 仪上进行qRT-PCR 分析。 引物采用Primer Premier 5.0 设计, 引物由生工生物工程(上 海) 股 份 有 限 公 司 合 成 (表1),actin9(AY305737)[41]为内参基因。 qRT-PCR 反应体积为20 μL,扩增程序:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,35 个循环。
1.8 陆地棉GhNF-YA18 功能初步验证
以鲁棉研37 号为材料, 通过病毒诱导的基因沉默(Virus-induced gene silencing,VIGS)初步验证陆地棉GhNF-YA18 的功能。 菌种: 农杆菌GV3101;VIGS 载 体TRV2 及 包 含TRV1 和TRV::CLA1 载体的农杆菌菌株。 构建TRV::Gh-NF-YA18 基因的载体, 酶切位点为EcoRⅠ和KpnⅠ,从鲁棉研37 号中扩增GhNF-YA18 基因的引物序列为F:CCGGAA-TTCATGCAACTAAAACCCTATGTTACAA,R:CGGGGTACCGTTCCTCTGCCATTTCTA。 将鲁棉研37 号置于温室中生长,温室设置昼夜光照时长14 h/10 h,温度为28 ℃/25 ℃。待子叶展开、真叶未展平时即可用于VIGS 操作[42]。 分别在棉苗白化时期和现蕾时期采集叶片样品对NF-YA18 基因表达进行检测,引 物 为F:ATGAGTCTCGGCATTTGC,R:GCTGCTGATTAT-TTGTTCCC。
1.9 数据统计方法
本研究利用Graphpad Prism 7.0 对数据进行统计分析。 对于多因素试验数据,采用双因素方差分析,并且采用Bonferroni 法多重比较,显著性水平设置为0.05。 对于成组(处理组和对照组)比较试验数据,首先进行正态性检验,如果满足正态性且2 组间方差齐, 则采用t 检验进行组间比较,否则用非参数检验(Mann-Whitney U),显著性水平为0.05。
2 结果与分析
2.1 陆地棉NF-YA 基因家族成员的鉴定
从陆地棉中共鉴定出29 个NF-YA 基因,分别命名为GhNF-YA1~GhNF-YA29(基本信息参见附表1,可在本刊网站查看)。 NF-YA 家族基因的开放阅读框(Open reading frame, ORF)长度为612~3 000 bp(Base pair,碱基对),对应编码的蛋白质含203~999 个氨基酸残基, 相对分子质量在19 410.10~109 451.47 Da。该家族蛋白等电点为6.95~10.87,多偏碱性。所有的NF-YA 蛋白都定位在细胞核中。

表1 qRT-PCR 引物Table 1 Primers for qRT-PCR
2.2 NF-YA 基因家族成员系统发育树的构建
采用同样的方法, 从拟南芥中鉴定出10 个NF-YA 基因家族成员,从二倍体亚洲棉和雷蒙德氏棉以及四倍体海岛棉中分别鉴定出16、16 和33 个成员,然后利用MEGA 7.0 软件进行序列比对,用最大似然法构建系统进化树(图1)。二倍体棉花雷蒙德氏棉和亚洲棉NF-YA 基因家族成员数量一样, 陆地棉NF-YA 基因家族成员的数量低于亚洲棉和雷蒙德氏棉基因家族成员的总和,而海岛棉NF-YA 基因家族成员数量略高于2 种二倍体棉花中NF-YA 基因家族成员数量的总和。 聚类分析显示陆地棉NF-YA 基因分为5 个亚组,在亚组III 中有8 个GhNF-YA 基因家族成员,数量最多;而亚组V 中仅有4 个,数量最少。4个棉种的NF-YA 基因在5 个亚组中均有分布,陆地棉和海岛棉的A 和D 亚组分别与供体亚洲棉A 组和雷蒙德氏棉D 组聚在一起, 说明这2个亚组之间独立进化,而且在进化上比较保守。
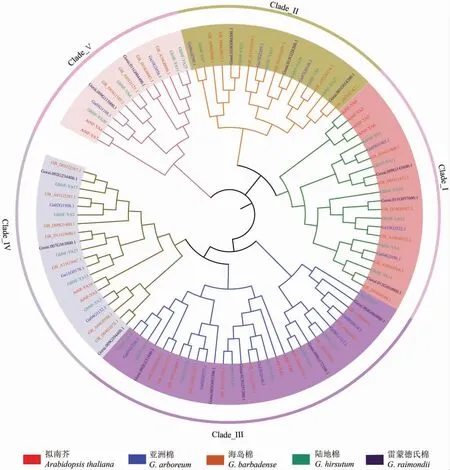
图1 NF-YA 基因家族成员的系统进化树Fig. 1 Phylogenetic tree of NF-YA gene family members
2.3 NF-YA 蛋白保守基序、 结构域和基因结构分析
motif1、motif2、motif3、motif4 在 GhNF-YA家族所有成员中都出现, 说明这些motif 为该家族的保守基序,推测其可能在维持该家族的基本功能上起作用(图2)。 NF-YA 基因家族编码产物中只有1 个CBFB_NFYA 结构域且全部位于基因3′端 (图2C)。 GhNF-YA9、GhNF-YA11 和GhNF-YA25 分别含有6、7 和8 个外显子, 其余的家族成员都只有5 个外显子。
2.4 NF-YA 基因家族启动子分析
NF-YA 家族成员的启动子区域存在很多光反应 (G-box、ATCT-motif、AE-box、GATA-box等)、赤霉素诱导(P-box 和GARE-motif 等)和昼夜节律等响应元件,还有响应细胞代谢、MYB 和茉莉酸甲酯(Methyl jasmonate,MeJA)的调控元件,如O2-site、MRE 和TGACG-motif(参见附图1,可在本刊网站查看)。 可见, 多种顺式作用元件参与NF-YA 基因家族成员的基因表达调控。
2.5 NF-YA 基因家族染色体分布和同源性分析
除1 个在scaffold4169_D07 上, 其余28 个陆地棉NF-YA 基因分布在18 条染色体上,其中定位在的At亚基因组的NF-YA 基因有15 个,比Dt亚基因组(13 个) 多;A05 染色体上定位3个基因,A01、A08、A10、A13、D01、D05、D10 和D13 染色体上各有2 个,而A04、A06、A07、A11、D03、D04、D06、D08 和D11 染色体上仅各有1 个基因(附图2,可在本刊网站查看)。
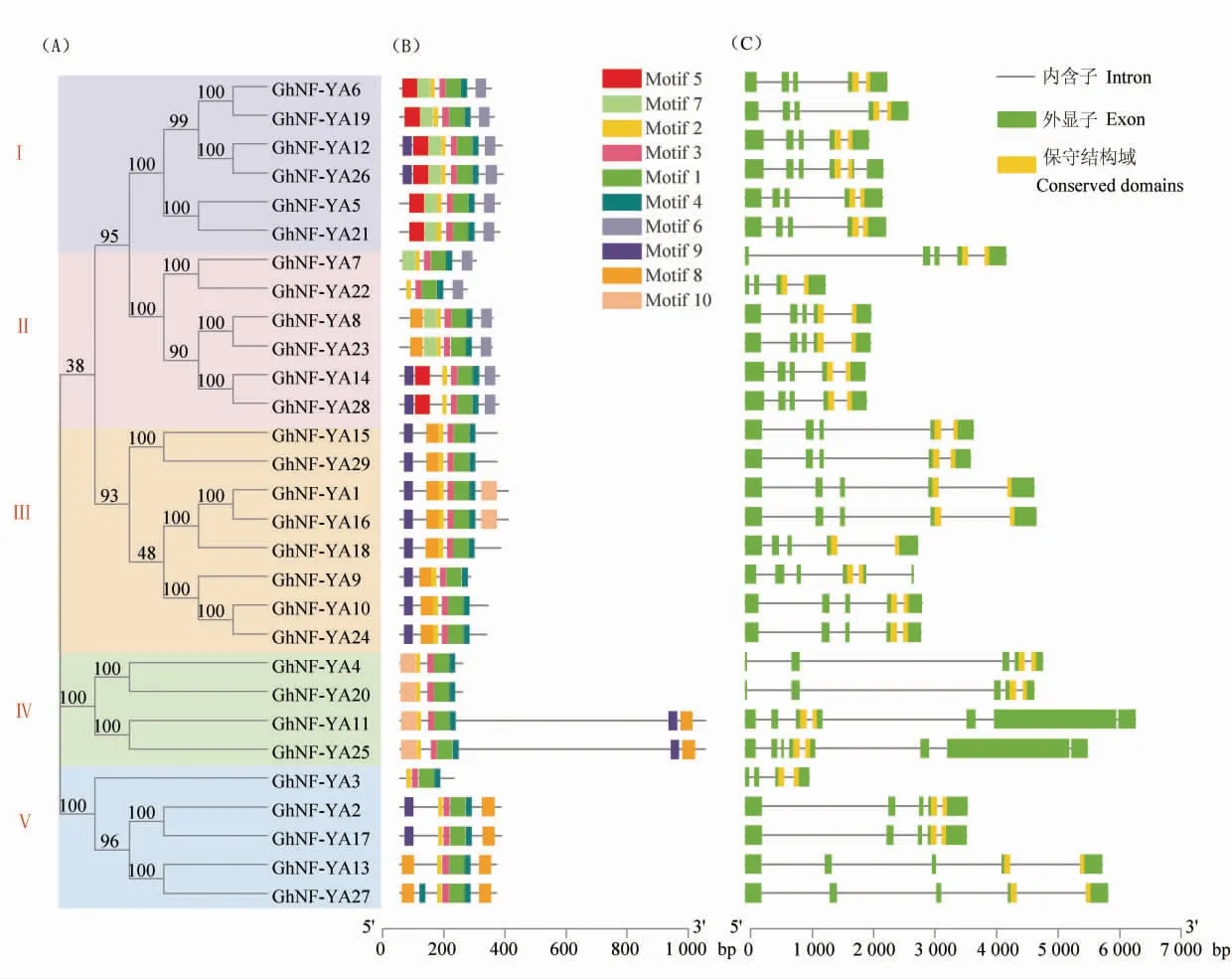
图2 陆地棉NF-YA 蛋白系统进化树(A)、保守基序(B)和基因结构(C)Fig. 2 Phylogenetic tree, conserved motif and gene structure of NF-YA protein in upland cotton
使用MCScanX 在亚洲棉、 雷蒙德氏棉和陆地棉中对鉴定到的NF-YA 家族基因进行共线性分析, 在亚洲棉和陆地棉中共发现26 对共线性基因对, 在雷蒙德氏棉和陆地棉中同样发现26对共线性基因对(附图3,可在本刊网站查看)。在陆地棉中进行共线性分析,发现29 个NF-YA 基因中比对到31 对同源基因(图3)。 在At和Dt亚基因组之间有12 对同源基因呈绝对共线性(黑色连线:GhNF-YA1/GhNF-YA16、GhNF-YA2/Gh-NF-YA17、GhNF-YA4/GhNF-YA20、GhNF-YA5/GhNF-YA21 、 GhNF-YA6/GhNF-YA21 、 GhNFYA7/GhNF-YA22、GhNF-YA9/GhNF-YA24、Gh-NF-YA10/GhNF-YA24、GhNF-YA11/GhNF-YA25、GhNF-YA12/GhNF-YA26 、 GhNF-YA13/GhNFYA-27、GhNF-YA14/GhNF-YA28),3 对同源基因在Dt亚基因组内复制(橘色连线:GhNF-YA17/GhNF-YA27 、GhNF-YA20/GhNF-YA25 、GhNFYA22/GhNF-YA28),5 对同源 基 因 在At亚 基 因组内复制(蓝色连线:GhNF-YA2/GhNF-YA13、Gh NF-YA4/GhNF-YA11、GhNF-YA7/GhNF-YA14、GhNF-YA8/GhNF-YA14、GhNF-YA7/GhNF-YA8),并且在A08 和A05 染色体上分别有1 对基因复制(红色连线:GhNF-YA5/GhNF-YA6、GhNFYA9/GhNF-YA10),其余9 对同源基因没有在同源染色体上进行复制(绿色连线:GhNF-YA2/Gh-NF-YA27、GhNF-YA4/GhNF-YA25、GhNF-YA5/GhNF-YA19 、 GhNF-YA6/GhNF-YA19 、 GhNFYA7/GhNF-YA28、GhNF-YA8/GhNF-YA28、Gh-NF-YA11/GhNF-YA20、GhNF-YA13/GhNF-YA17、GhNF-YA14/GhNF-YA22)。 陆地棉NF-YA 基因家族成员中仅GhNF-YA3 和GhNF-YA18 是通过散布重复序列 (Dispersed repeats sequence)发展而来, 其余基因为全基因组复制(Whole genome duplication,WGD) 或片段复制(Segmental duplication)扩张而来,因此,全基因组复制和片段复制是陆地棉NF-YA 基因家族的主要扩张动力。
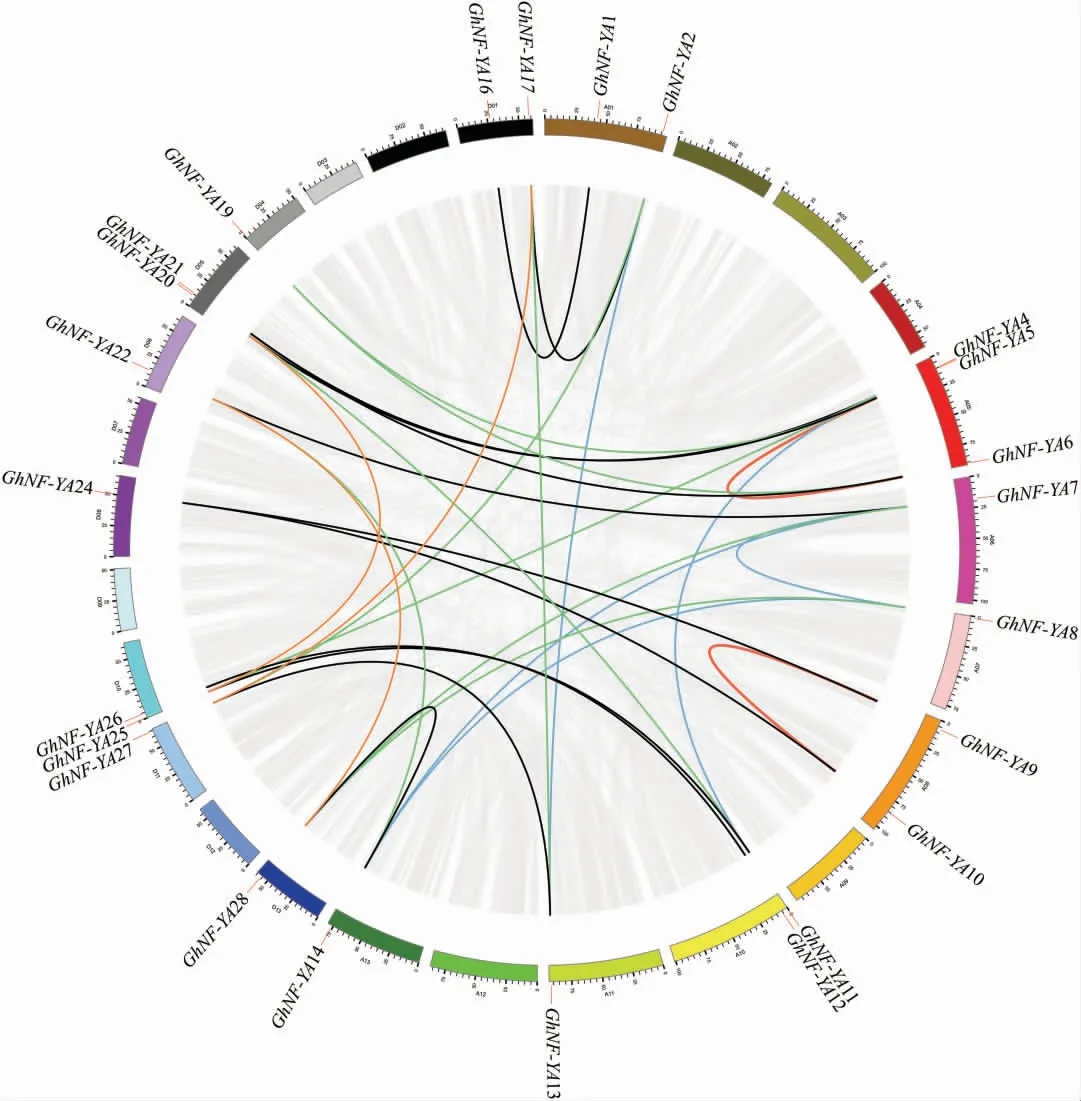
图3 陆地棉NF-YA 家族基因染色体分布和共线性关系Fig. 3 Chromosome distribution and collinearity of NF-YA genes members in upland cotton
计算同源基因对的Ka、Ks、Ka/Ks(附表2,可在本刊网站查看), 发现仅GhNF-YA7/Gh-NF-YA14 的Ka/Ks值为1.058 4, 经历正选择;其他同源基因对的Ka/Ks值都小于1, 说明这些基因在基因复制之后经历了负选择。
2.6 NF-YA 基因家族组织特异性表达模式分析
表达模式分析(图4)表明,NF-YA 家族基因GhNF-YA3 、 GhNF-YA5 、 GhNF-YA9 、 GhNFYA11、GhNF-YA23、GhNF-YA25 在茎、叶、花瓣、花托、 雄蕊、 雌蕊组织和器官的表达量都很低。GhNF-YA7 、GhNF-YA8 、GhNF-YA10 、GhNFYA14、GhNF-YA15、GhNF-YA17、GhNF-YA24、GhNF-YA26、GhNF-YA27、GhNF-YA29 在 茎 和叶中的表达量都很高, 其中在叶片中Gh-NF-YA7、GhNF-YA8、GhNF-YA10、GhNF-YA14、GhNF-YA15、GhNF-YA22、GhNF-YA24、GhNFYA29 的表达量最高,为优势表达基因。 GhNFYA18 在茎、叶、花瓣、雄蕊中表达量高,但在雌蕊和花托中表达量很低;GhNF-YA27 在茎中高表达,在叶片和花托中表达稍高,但在雌蕊、雄蕊和花瓣中表达量低,表明这些基因可能在营养生长时期发挥重要作用。 有些同源基因对在进化树上位于同一分支,Ka/Ks分析为同源基因对,但其表达 模 式 不 同, 如:GhNF-YA13/GhNF-YA27、GhNF-YA22/GhNF-YA7, GhNF-YA13 在 茎、叶片、花托组织和器官的表达量都低于GhNFYA27;GhNF-YA7 在茎、 叶和雌蕊中表达高于GhNF-YA22,而在雄蕊和花托中低于GhNFYA22,暗示这些同源基因可能出现了功能分化。
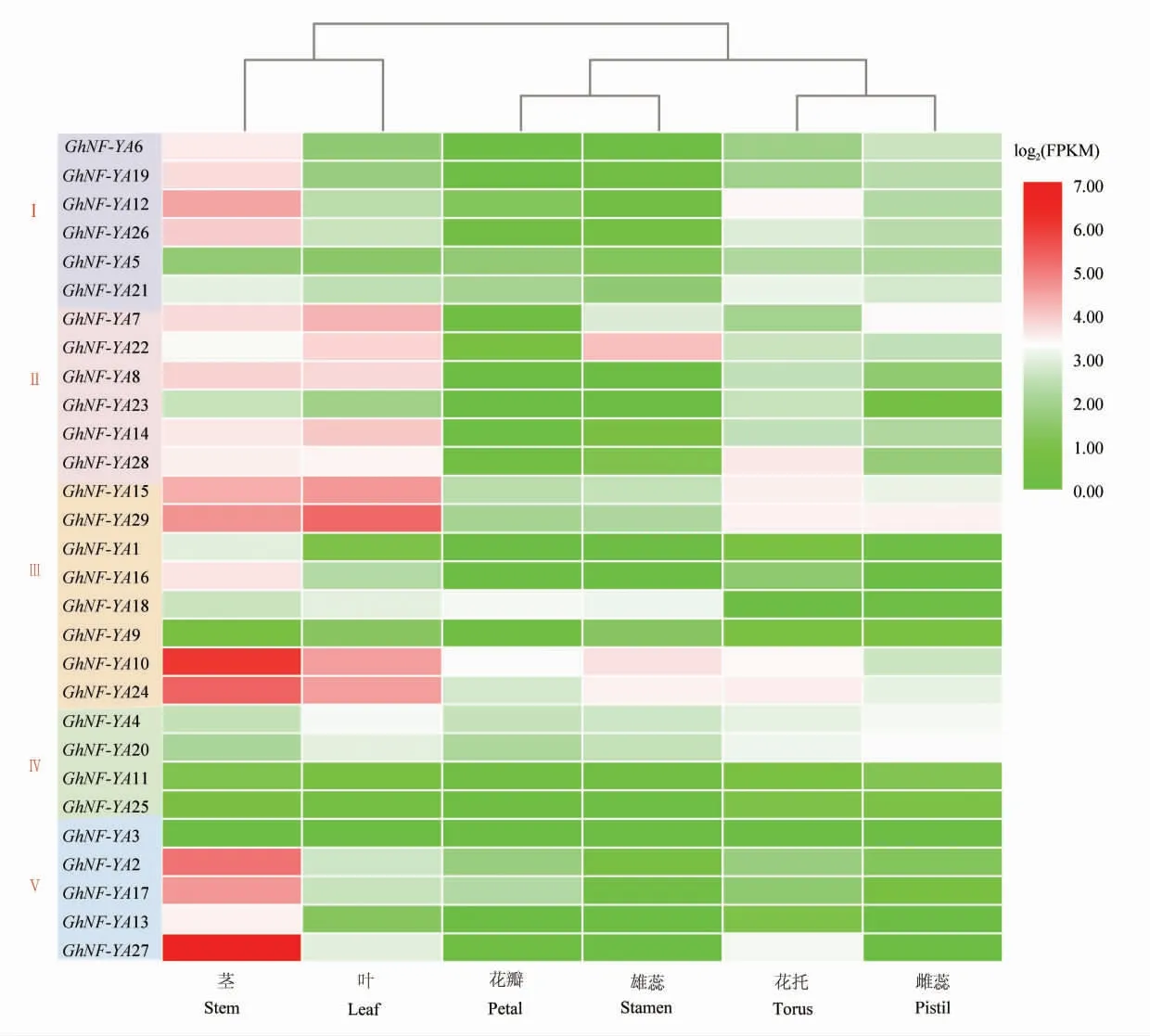
图4 NF-YA 基因家族成员在陆地棉标准系TM-1 中的表达模式Fig. 4 Expression pattern of NF-YA genes in upland cotton genetic standard line TM-1
根据NF-YA 基因家族的组织表达模式,采用qRT-PCR 分析了其中高表达的12 个基因GhNF-YA4 、GhNF-YA7 、GhNF-YA10 、GhNFYA12、GhNF-YA15、GhNF-YA16、GhNF-YA18、GhNF-YA22、GhNF-YA24、GhNF-YA26、GhNFYA28 和GhNF-YA29 在早熟品种鲁棉研19 和晚熟品种鲁棉研37 不同时期叶片中的表达情况。长日照处理下,一叶期GhNF-YA4、GhNFYA7、GhNF-YA12、GhNF-YA15、GhNF-YA16、GhNF-YA22、GhNF-YA24、GhNF-YA26、GhNFYA28 和GhNF-YA29 这些基因在2 个品种中的表达水平差异显著; 到花芽分化时期(四叶期),GhNF-YA7、GhNF-YA10、GhNF-YA16、GhNFYA18 和GhNF-YA28 在2 个品种之间的表达量较一叶期升高且差异显著;在六叶期,所有基因在2 个品种中的相对表达量差异极显著,除GhNF-YA7 在鲁棉研19 号中的表达量高于鲁棉研37 号外,其他基因均在鲁棉研37 号中有较高的 表 达( 图5)。 短 日 照 处 理 下, 一 叶 期GhNF-YA10、GhNF-YA12、GhNF-YA22 和GhNFYA28 在2 个品种间表达水平差异显著; 到花芽分化时期(三叶期),GhNF-YA7、GhNF-YA16、GhNF-YA18 和GhNF-YA28 较一叶期均升高且在2 个品种之间的表达量差异显著; 五叶期,除GhNF-YA18 和GhNF-YA26,其余基因在2 个品种之间都有显著差异;GhNF-YA4、 GhNF-YA7和GhNF-YA16 在早熟品种鲁棉研19 号中的表达量低于晚熟棉品种鲁棉研37 号, 其余基因均在鲁棉研19 号中有较高的表达(图6)。
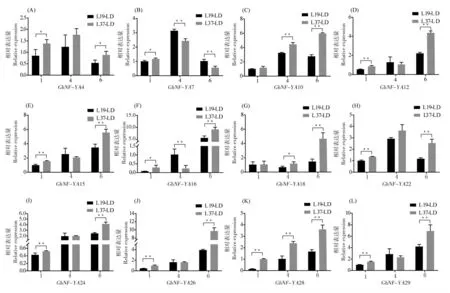
图5 长日照下NF-YA 基因在2 个品种不同叶龄期的表达水平Fig. 5 The expression levels of NF-YA genes at different leaf stages in two varieties under long day treatment
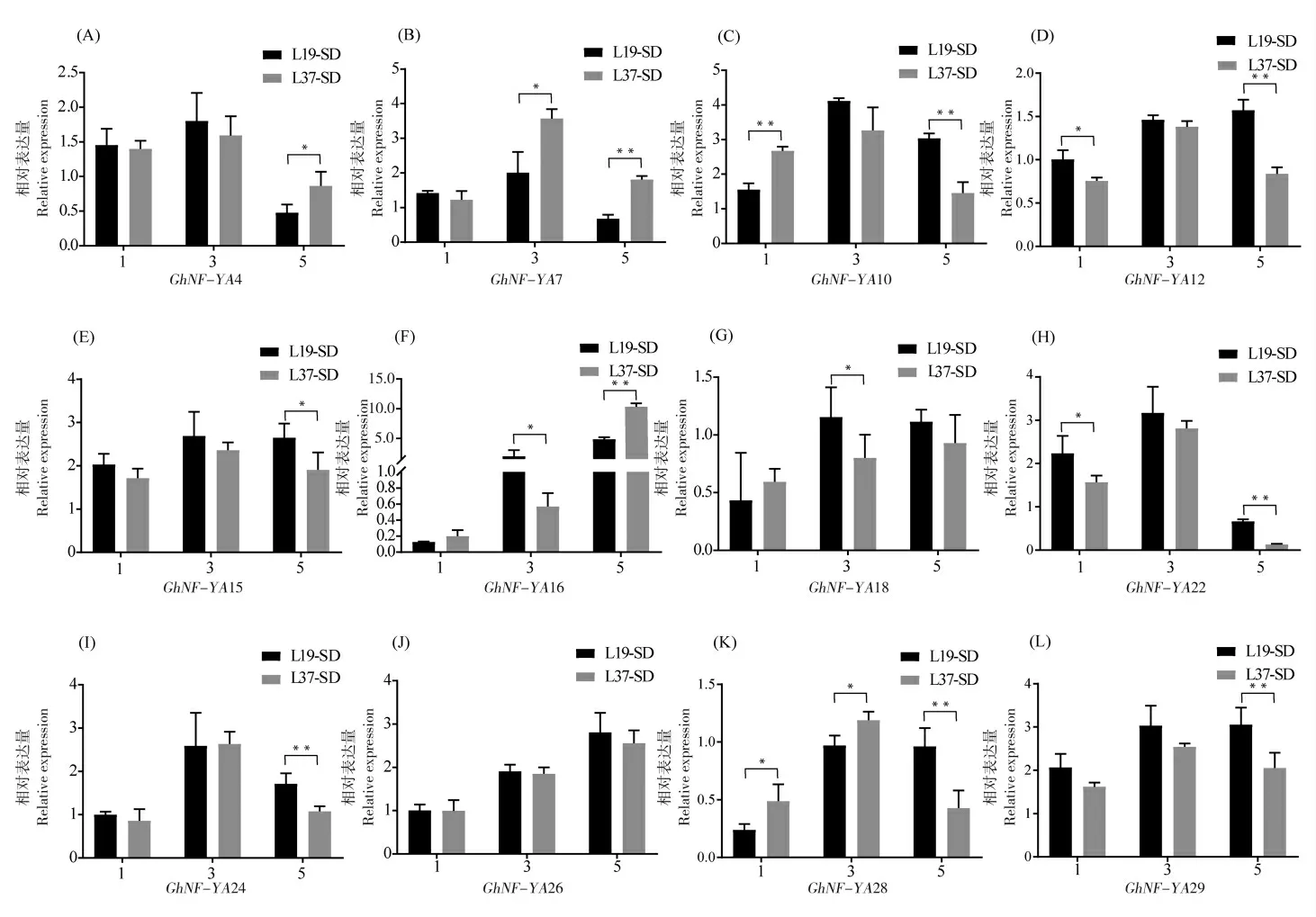
图6 短日照下NF-YA 基因在L19 和L37 不同叶龄期的表达水平Fig. 6 The expression levels of NF-YA genes at different leaf stages in two varieties under short day treatment
2.7 GhNF-YA18 基因功能的初步分析
qRT-PCR 分 析 显 示,GhNF-YA18 在 晚 熟 品种鲁棉研37 号六叶期的表达水平显著高于早熟品种鲁棉研19 号(图7A)。 GhNF-YA18 的同源基因AtNF-YA1 在拟南芥中可能通过调节FT 的表达来控制开花时间[43]。 基于以上分析,利用VIGS 技术在鲁棉研37 号中沉默GhNF-YA18,发现当处理组进入现蕾期时,对照组还未现蕾或者刚开始现蕾, 对照组现蕾所需平均时间为93 d,处理组现蕾所需平均时间为82 d,沉默该基因后现蕾期提前了11 d(图7B)。 在白化期和现蕾期沉默植株中GhNF-YA18 的表达量都显著低于对照(图7C 和7D),初步证明减弱GhNF-YA18基因的表达能促进晚熟品种提前现蕾开花,Gh-NF-YA18 可能是棉花开花途径的1 个重要调控因子。
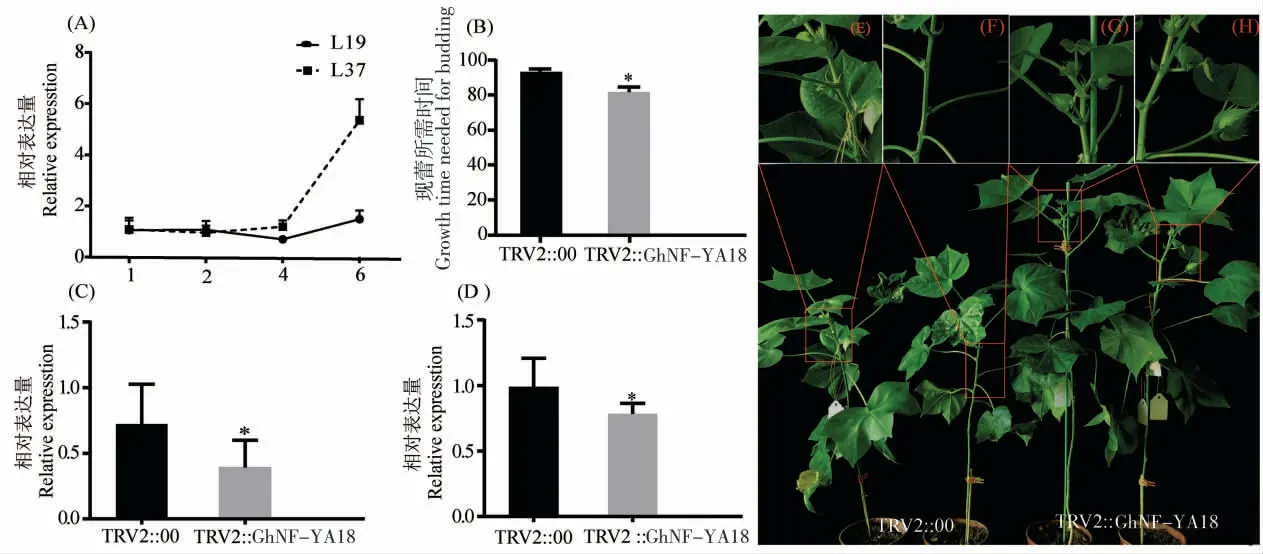
图7 VIGS 验证GhNF-YA18 基因的功能Fig. 7 Function analysis of the GhNF-YA18 gene by VIGS
3 讨论
在本研究中, 利用生物信息技术对Gh-NF-YA 基因家族成员进行综合分析,在陆地棉中鉴定到29 个NF-YA 基因。 这些基因的编码产物有相似的motif 组成,其中4 个motif 为其共有的保守基序。 基因组的结构,特别是内含子与外显子的数量和分布,都是记录进化发生的关键[44],该基因家族中GhNF-YA11 和GhNF-YA25 比其他成员多2 个较长的外显子,其编码的蛋白并不包括该家族的保守结构域,说明这些外显子不影响该基因主要功能,存在功能冗余,可能在基因的进化中将这一冗余基因序列丢失,但并不影响其功能。 陆地棉NF-YA 基因家族的启动子区域有大量重复的光响应顺式作用元件,GATA-motif对光敏感,并且具有组织特异性[45];光响应的另一元件G-box 同时也响应一些激素(包括脱落酸、乙烯和茉莉酸甲酯)[46];ATCT-motif 和AE-box 光响应元件可以赋予AtPolλ 启动子受光调控活性[47]。
进化树中相同分支的基因可能有相似的功能[48],AtNF-YA3 和AtNF-YA8 在 拟 南 芥 胚 胎 发育早期起关键作用,影响早期胚胎对生长素的响应,进而影响胚胎发育[49]。同样位于亚组Ⅰ中的陆地棉NF-YA 基因家族成员, 可能也有类似的功能;亚组Ⅲ中的AtNF-YA1 可能通过调节拟南芥中FT 的表达来控制开花时间, 亚组Ⅴ中的At-NF-YA2 和AtNF-YA10 的过表达导致植株矮化晚熟[50]。 所有的四倍体和二倍体棉花的NF-YA基因家族成员在各亚组均有分布,表明该基因家族在棉花的异源多倍体过程化中没有发生基因丢失, 保留了二倍体祖先种的NF-YA 基因来源[51]。 通过对棉属NF-YA 基因家族成员的比较发现, 四倍体的At和Dt亚组与亚洲棉和雷蒙德氏棉聚集在一个分支, 两者进化速率相同,说明A 和D 族之间属于独立进化[52]。
鉴定到的29 个NF-YA 基因家族成员随机分布在18 条染色体上, 而且定位在A 亚组的基因要多于D 亚组,可能是由于陆地棉在进化过程中发生了基因交换。 串联重复、片段复制和全基因组复制是基因家族扩张的主要推动力[53],对棉花NF-YA 基因家族共线性分析揭示同源基因对存在很多复制现象,主要是通过全基因组复制和片段重复。 1 对同源基因Ka/Ks值大于1,其余大部分小于0.5, 暗示这些复制基因在进化中较为保守,结构比较稳定,功能具有一致性,非同义替换的速率低于同义突变的速率,说明这些基因在复制之后经历了负选择[54]。 复制基因在进化过程中长期维持原有的功能是普遍现象,可能是自然选择、遗传冗余以及蛋白质相互作用的结果[53]。
陆地棉NF-YA 基因家族成员在营养器官中表达量比生殖器官高,有些在进化上相似的基因的表达模式不同,说明这些基因出现亚功能化[55]。根据表达模式分析挑选出12 个在叶片中表达差异较大的基因做定量分析验证,结果发现,在花芽分化时期,基因表达量开始升高且在2 种材料间差异显著; 在五/六叶期, 基因表达量有所下降,但在2 个品种之间仍然存在显著差异。 有研究表明,陆地棉FT 同源基因GhFT1 在根、茎、叶中的表达要比雄蕊和萼片中低得多。而本研究中检测的NF-YA 基因在组织中的表达刚好与GhFT1 的表达情况相反,该基因家族成员可能与CO 基因存在竞争, 进而影响FT 基因表达。 对GhNF-YA18 基因的VIGS 验证结果显示, 沉默GhNF-YA18 之后,鲁棉研37 号现蕾期提前了11 d, 初步推测该基因编码的蛋白是棉花开花途径中的1 个重要调控因子。
4 结论
从陆地棉全基因组中鉴定出29 个Gh-NF-YA 基因家族成员,该家族基因可以分为5 个亚组。 进化分析表明,全基因组复制和片段重复是NF-YA 基因扩张的主要动力, 大部分经历了负选择作用。 进一步的组织表达模式分析表明,GhNF-YA 基因家族成员在茎、叶中高表达,部分同源基因出现功能分化;qRT-PCR 分析显示,Gh-NF-YA 基因在早熟品种鲁棉研19 号和晚熟品种鲁棉研37 号三至六叶期有较高表达, 并且大部分基因的表达在2 个品种间存在显著差异;采用VIGS 方法初步验证GhNF-YA18 可能是棉花开花途径中的1 个重要调控因子。
