斜纹夜蛾表皮蛋白基因克隆及表达谱分析
2020-07-23赵鹏张帅赵晨晨胡方梅崔金杰李绍勤
赵鹏,张帅,赵晨晨,胡方梅,崔金杰*,李绍勤
(1. 华中农业大学植物科学技术学院/ 湖北省昆虫资源利用与害虫可持续治理重点实验室,武汉430070;2. 中国农业科学院棉花研究所/ 棉花生物学国家重点实验室,河南 安阳455000)
斜纹夜蛾Spodoptera litura 属鳞翅目夜蛾科,是多食性、暴食性害虫,寄主种类广泛,包括蕨类植物、裸子植物、双子叶植物、单子叶植物在内的109 科、389 种植物[1],具有世代多、寄主广、抗药性强等特点。 近年来斜纹夜蛾暴发面积逐年扩大,发生情况愈加复杂,已成为蔬菜上主要害虫之一,同时严重威胁着棉花、烟草等经济作物的生产[2]。化学农药的大量频繁使用,使斜纹夜蛾已经对包括有机磷、有机氯、拟除虫菊酯、氨基甲酸酯和苏云金杆菌在内的多种杀虫剂产生了抗性[3]。 因此,研制出新型绿色杀虫剂,制定新的防治策略是斜纹夜蛾防治的当务之急。
昆虫抗药性的产生与昆虫表皮密切相关,昆虫的表皮覆盖着整个身体表面,不仅可防御外来病原物的入侵,还能抵御外界不良环境,在昆虫的生长发育和生理代谢活动中发挥重要作用[4]。昆虫表皮主要是由几丁质和表皮蛋白(Insect cuticular proteins,ICP)组成[5],其中编码表皮蛋白的基因被称为表皮蛋白基因(Insect cuticular protein gene,ICPG)。表皮作为昆虫抵御外界不良环境的第一道防线,当昆虫受温度胁迫、渗透胁迫、季节性光周期等环境条件影响时,ICPG 表达调控功能就会做出响应[5]。 昆虫表皮与昆虫抗药性息息相关,尤其以触杀为主的杀虫剂,如拟除虫菊酯类农药等,昆虫对其产生抗性的原因之一就是昆虫表皮对杀虫剂的渗透能力降低[6]。因此,对昆虫表皮蛋白基因的研究,有助于阐明昆虫部分抗药性的产生机制,并为有效选择杀虫剂靶标提供理论基础。 而现阶段表皮蛋白基因的研究主要集中于果蝇科(Drosophilidae)[7]、西方蜜蜂Apis mellifera[8-10]、家蚕Bombyx mori[11-13]和冈比亚按蚊Anopheles gambiae[14]等昆虫。目前,有关斜纹夜蛾表皮蛋白基因的研究报道较少。 本研究根据斜纹夜蛾转录组测序信息, 找到了14 个预测为编码CP 的基因, 并命名为SlICPG (Spodoptera litura insect cuticular protein gene),编号1~14,应用逆转录聚合酶链反应 (Reverse transcription polymerase chain reaction,RT-PCR)技术分析14 个基因在3~6 龄幼虫(2 日龄)不同组织和2 日龄成虫生殖器官中的表达差异, 为之后的基因功能验证和发展基于表皮蛋白的害虫防治策略奠定基础。
1 材料与方法
1.1 供试虫源
斜纹夜蛾购于河南省科云生物农药有限公司,室内人工饲料饲养2 代后,选择第3 代用于试验。饲养温度为(26±1)℃,相对湿度为65%±5%,光周期(光暗比)14 h∶10 h。
1.2 主要试剂及仪器
RNA 提取试剂TRIzol 购自Life Technologies 公司;反转录试剂盒(PrimeScriptTMRT Master Mix)与rTaq 酶均购自TaKaRa 公司;实时荧光 定 量PCR 试 剂 (TransStart®Top Green qPCR SuperMix(+Dye I))购自北京全式金生物技术有限公司。 梯度PCR 仪器为Lab Cycler Gradient;荧光定量PCR 仪器为ABI Step One Plus; 微量分光光度计为NANODROP 2000C(美国Thermo公司)。
1.3 基因克隆
基于本实验室测得的斜纹夜蛾幼虫转录组(SUB5323417,尚未公布)数据,找到了14 个表皮蛋白基因。 以此为目的基因,利用Beacon Designer 7 设计特异性引物(表1)进行克隆。解剖斜纹夜蛾5 龄幼虫中肠,采取TRIzol 法提取样品总RNA,之后使用琼脂糖凝胶电泳和微量分光光度计对RNA 纯度及完整性进行检测。 取500 ng 的总RNA 为模板(其余贮存于-80 ℃备用),按照PrimeScriptTMRT Master Mix 反转录试剂盒操作说明,获得cDNA 第1 链,并以其为模板,用rTaq酶进行PCR 扩增,扩增体系:10×PCR Buffer 2.5 μL,dNTP Mix 2.0 μL, 上下游引物各1.0 μL,rTaq 酶0.125 μL, 模板1.0 μL,ddH2O 补 齐 至25.0 μL;扩增条件:94 ℃预变性3 min,然后94 ℃变性30 s,64 ℃退火1 min,72 ℃延伸2 min,共35 个循环。 扩增产物用质量分数为1.2%的琼脂糖凝胶电泳进行检测, 之后将PCR 产物送生工生物工程(上海)股份有限公司进行测序。
1.4 进化树构建
利用在线工具NCBI(https://www.ncbi.nlm.nih.gov/)GenBank 数据库中检索昆虫表皮蛋白氨基酸序列, 利用MEGA 5.0 软件的邻接法(Neighbor-Joining) 构建表皮蛋白系统发育进化树。
1.5 RT-PCR
1.5.1 引物设计与合成。 根据克隆得到的斜纹夜蛾相关表皮蛋白基因的核苷酸序列以及利用转录组测序库中已得到注释的序列进行相关基因的引物设计, 选取已报道的斜纹夜蛾的GAPDH和RPL10 基因[15]作为内参基因,根据实时荧光定量PCR 的引物设计原则,利用Beacon Designer 7设计目标基因的特异性引物, 由生工生物工程(上海)股份有限公司合成,引物序列见表1。
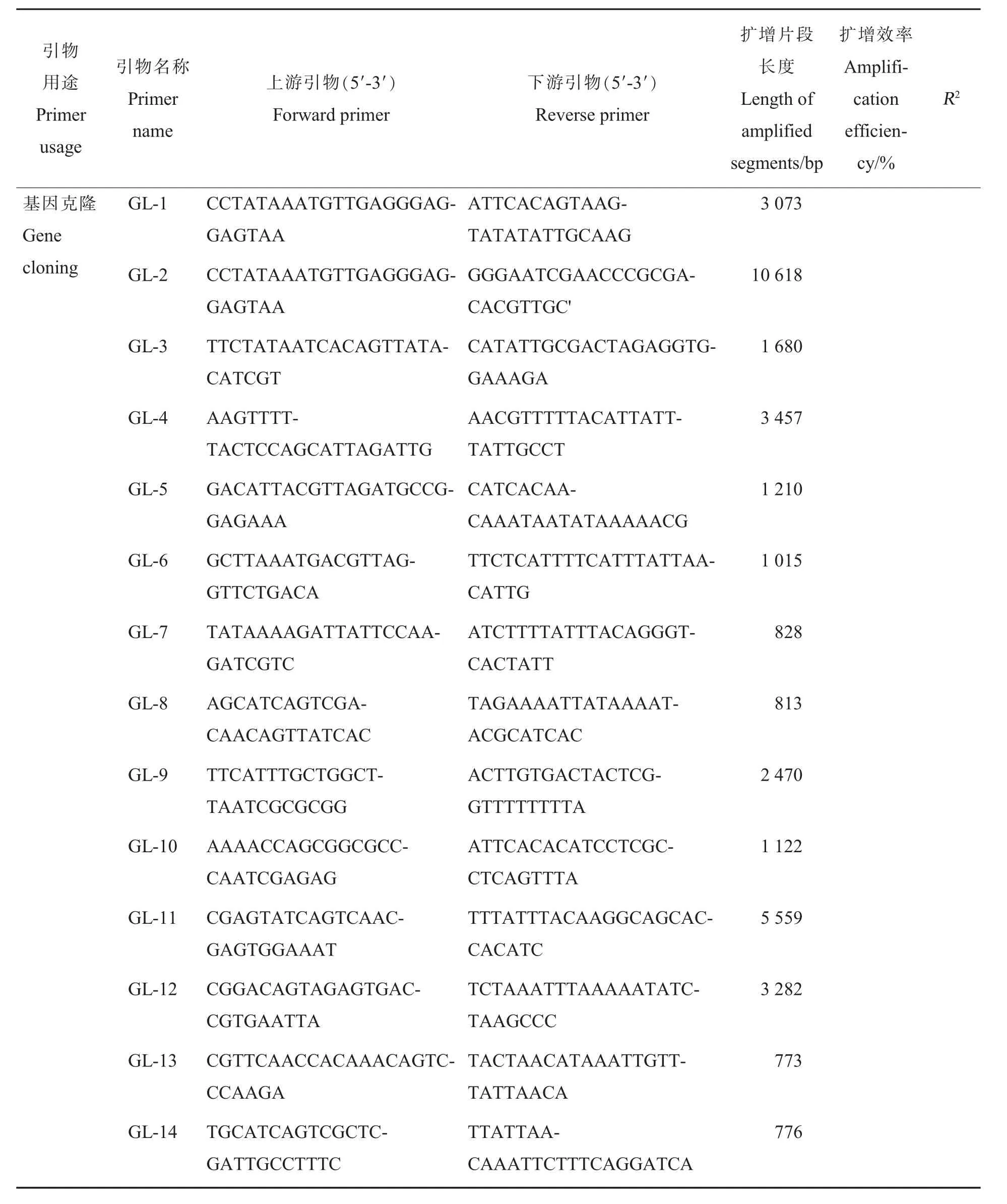
表1 试验中相关引物信息Table 1 Relevant primer information in the experiment
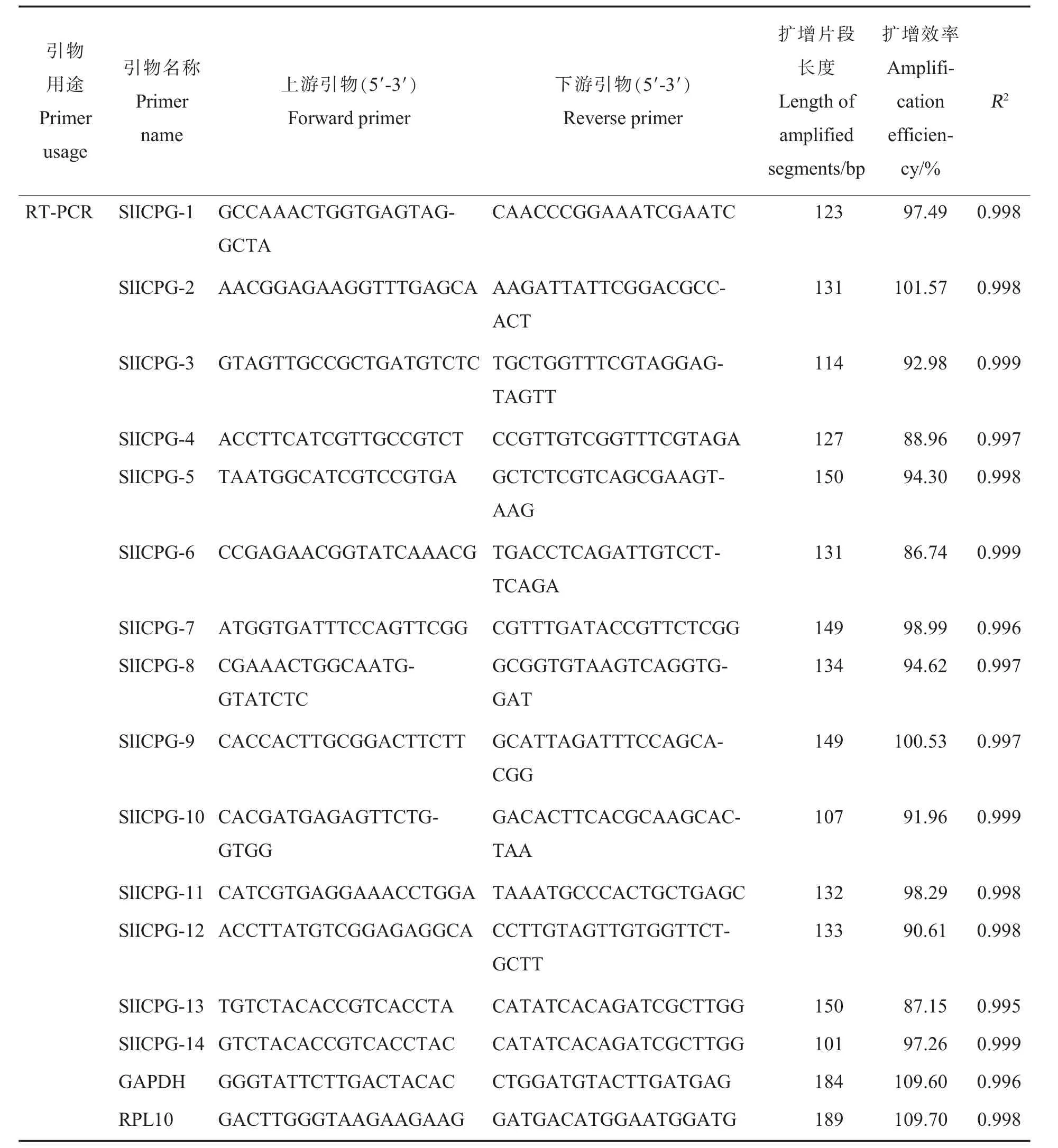
表1 (续)Table 1 (Continued)
1.5.2 样品采集。收集斜纹夜蛾3~6 龄幼虫和2日龄雌雄成虫(未交配),于超净工作台中解剖幼虫中肠、血淋巴、体壁和脂肪体;解剖雌雄成虫卵巢和精巢, 每个样品6 次重复, 每个重复解剖3头。 RNA 的提取与反转录方法同1.3, 获得的cDNA 模板贮存于-20 ℃备用。
1.5.3 引物扩增效率与特异性检验。 将斜纹夜蛾cDNA 按5 倍梯度稀释成5 个浓度, 并以此为模板制作标准曲线,确定引物扩增效率,根据熔解曲线分析引物是否形成二聚体或产生非特异性扩增产物。
1.5.4 实时荧光定量PCR 检测。 采用实时荧光定量PCR 技术检测表皮蛋白基因SlICPG 在斜纹夜蛾3~6 龄幼虫的中肠、血淋巴、体壁和脂肪体以及羽化2 d 成虫的卵巢和精巢中的表达变化动态。将cDNA 进行20 倍稀释,试验样本和内参分别设3 个重复,另设无模板的空白对照。 实时荧光定量PCR 主要根据TransStart®Top Green qPCR SuperMix(+Dye I)试剂盒说明书进行,采用20.0 μL 体系:2×TransStart®Top Green qPCR SuperMix (+Dye I) 10.0 μL, 上 下 游 引 物(10 μmol·L-1) 各0.4 μL,cDNA 模板1.0 μL,Nuclease-free Water 补齐至20 μL。 程序采用两步法进行:94 ℃预变性30 s,然后95 ℃变性5 s,60 ℃退火30 s,共40 个循环,第二步收集荧光。
1.6 数据统计与分析
对实时荧光定量PCR 结果采用2-△△Ct法进行分析,利用GraphPad Prism 7 制作图表,并利用SPSS 17.0 采用单因素方差分析,Duncan 氏多重比较检验和t 检验进行差异显著性分析(0.05 水平)。
2 结果与分析
2.1 斜纹夜蛾表皮蛋白氨基酸同源性比对及进化树构建
克隆得到斜纹夜蛾表皮蛋白基因的核苷酸序列, 利用在线工具(https://www.ncbi.nlm.nih.gov/orffinder/) 分析找到其编码区 (Coding sequences,CDS)、 编码的氨基酸, 利用在线工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对 蛋 白 质保守域进行分析, 结果表明所选目的基因具有35~36 个氨基酸保守基序, 属于几丁质结合蛋白, 在节肢动物中与几丁质相结合, 并且根据SlICPG-10 和SlICPG-11 的氨基酸序列具有AAPV/A 保守基序,可得知二者属于CPG 家族;其余表皮蛋白具有Rebers&Riddiford (R&R)保守基序,因此属于CPR 家族。 用DNAMAN 软件对目的氨基酸序列与其他昆虫ICPs 的氨基酸序列一致性进行比对,可知目的基因编码的蛋白质与蛾类昆虫同源性更高,SlICPG-2 与脐橙螟(Amyelois transitella)AtICPG 氨基酸序列一致性较高, 为74.63%;SlICPG-3 与亚洲玉米螟(Ostrinia furnacalis)OfICPG 氨基酸序列一致性为71.94%;SlICPG-8 与棉铃虫(Helicoverpa armigera)HaICPG 氨基酸序列一致性为88.06%(图1)。利用MEGA 5.0 软件对包括目的基因编码的蛋白质在内的共54 条表皮蛋白氨基酸序列进行系统进化树的构建。 系统进化树(图2)分析表明,SlICPG-2 氨基酸序列与AtICPG-1 氨基酸序列聚为一支;SlICPG-6 和SlICPG-7 氨基酸序列与家蚕 (Bombyx mori) 氨 基 酸 序 列 聚 为 一 支;SlICPG-9 和SlICPG-11 氨基酸序列与柑橘凤蝶(Papilio xuthus)氨基酸序列聚为一支;SlICPG-13和SlICPG-14 氨基酸序列与粉纹夜蛾(Trichoplusia ni)氨基酸序列聚为一支;SlICPG-3、SlICPG-4、SlICPG-5、SlICPG-8 和SlICPG-12 氨基酸序列与棉铃虫(Helicoverpa armigera)聚在一起,表明14个斜纹夜蛾CP 与棉铃虫CP 亲缘关系较近,暗示这14 个CP 与棉铃虫的CP 功能相近。
2.2 斜纹夜蛾表皮蛋白基因SlICPG 时空表达差异分析
2.2.1 引物扩增效率与特异性分析。 对表1 中的引物进行实时荧光定量PCR, 计算得出14 对引物的扩增效率均在85%~110%(表1),并且产物熔解曲线为单峰,无杂峰,表明引物较好,没有非特异性扩增,符合后续试验要求。
2.2.2 SlICPG 基因龄期和组织表达谱分析。为探究14 个表皮蛋白基因在不同龄期和组织中的表达差异,试验选取斜纹夜蛾4 个龄期,4 种组织为样品,以相对应的cDNA 为模板,对目的基因表达量进行检测, 结果如图3 所示。 在3 龄幼虫期,SlICPG-3、SlICPG-5、SlICPG-6、SlICPG-7、SlICPG-9、SlICPG-12、SlICPG-13 和SlICPG-14 表达情况较为相似,均为在体壁组织中相对表达量最高,而在脂肪体中次之,在其余组织中的相对表 达 量 较 低; 对 于 基 因SlICPG-1、SlICPG-2、SlICPG-8、SlICPG-10 和SlICPG-11, 均高表达于脂肪体组织, 与其余组织相比具有显著差异;而SlICPG-4 在3 龄幼虫各组织中相对表达量均较低(图3A)。在4 龄幼虫期,SlICPG-3、SlICPG-5、SlICPG-6、SlICPG-7、SlICPG-9、SlICPG-12、SlICPG-13 和SlICPG-14 与3 龄幼虫期相似, 均在体壁组织中出现高表达,而基因SlICPG-1、SlICPG-2、SlICPG-4、SlICPG-6、SlICPG-7、SlICPG-9、SlICPG-10 和SlICPG-11 出现在血淋巴组织中相对表达量上升的现象, 并且其中SlICPG-10 和SlICPG-11 在血淋巴组织中相对表达量最高,SlICPG-8 在4 龄幼虫各组织表达量均较低(图3B)。 在5 龄幼虫中,基 因 SlICPG-3、SlICPG-4、SlIC PG-5、SlICPG-8、SlICPG-9 和SlICPG-12 在体壁组织中相对表达量最高, 与其余组织相比达到差异显著水平,SlICPG-1、SlICPG-2、SlICPG-10 和SlICPG-14 在血淋巴组织中出现高表达情况,而剩余组织在5 龄幼虫中相对表达量较低(图3C)。在6 龄幼虫中,仍是大部分基因在体壁组织中高表达,如SlICPG-3、SlICPG-5、SlICPG-6、SlICPG-7、SlICPG-9、SlICPG-12、SlICPG-13 和SlICPG-14, 基 因SlICPG-1、SlICPG-2、SlICPG-8、SlICPG-10 和SlICPG-11 在中肠组织中的相对表达量与其余组织相比具有显著差异,但相对表达量较低(图3D)。 综上可知,14 个目的基因在4 个龄期、4 个组织中均有表达,并具有组织特异性。 在低龄(3~4 龄)幼虫中, 较多基因在体壁和脂肪体中有较高表达水平;在高龄(5~6 龄)幼虫中,较多基因只在体壁组织中表达水平较高。 其中基因SlICPG-3、SlICPG-5、SlICPG-9 和SlICPG-12 的相对表达量最为稳定,在各龄期的体壁组织中相对表达量均最高。

图1 斜纹夜蛾及其他昆虫表皮蛋白氨基酸序列比对Fig. 1 Amino acid alignment of cuticular proteins from Spodoptera litura and other insects
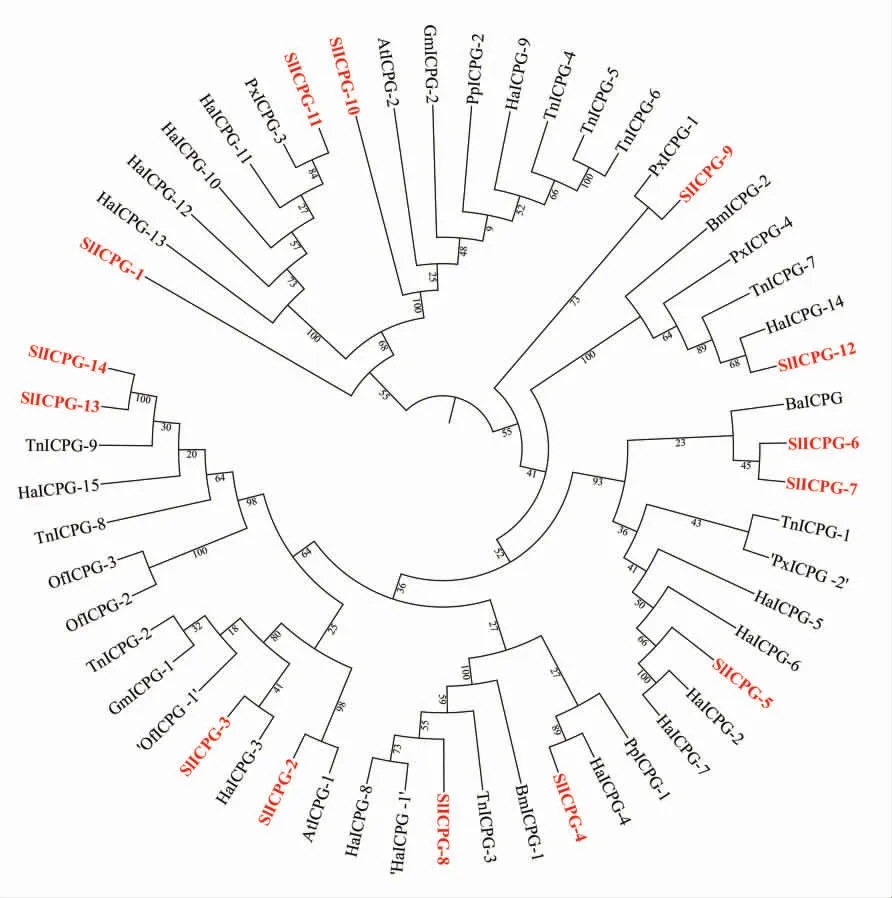
图2 斜纹夜蛾及其他昆虫表皮蛋白进化树Fig. 2 Phylogenetic tree of insect cuticular proteins of Spodoptera litura and other insects

图3 SlICPG 基因在同龄期斜纹夜蛾不同组织中表达量分析Fig. 3 Expression of SlICPG genes in different Spodoptera litura tissues at the same age
2.2.3 SlICPG 基因在斜纹夜蛾蛹期表达差异分析。 为明确SlICPG 基因在蛹期的表达差异,以斜纹夜蛾蛹(2 日龄)的cDNA 为模板,对14 个目的基因进行表达量检测, 以SlICPG-1 为对照基因进行差异显著性分析, 结果表明大部分SlICPG在蛹期相对表达量较低,SlICPG-3、SlICPG-5、SlICPG-11 和SlICPG-14 相对表达量较高, 其中SlICPG-11 和SlICPG-14 相对表达量最高, 与其余基因差异显著(图4)。
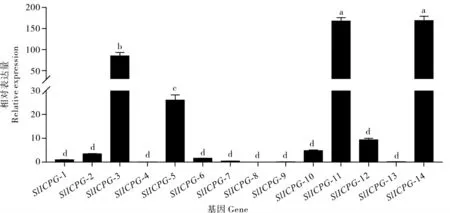
图4 SlICPG 基因在斜纹夜蛾蛹期表达量分析Fig. 4 Expression of SlICPG genes in pupa stage of Spodoptera litura
2.2.4 SlICPG 基因在斜纹夜蛾成虫生殖器官中表达差异分析。 为探究SlICPG 基因在精巢和卵巢中饭的表达差异, 以2 日龄成虫精巢和卵巢为样品,以相对应的cDNA 为模板进行表达量检测,结果表明部分基因在精巢和卵巢中的表达出现显著差异, 且相对表达量较低,SlCPG-3、SlCPG-7、SlCPG-9 和SlCPG-10 在精巢中的表达量极显著高于卵巢,SlCPG-5 在卵巢中的表达量极显著高于 精 巢,SlCPG-1、SlCPG-2、SlCPG-11、SlCPG-13在卵巢中的表达量显著高于精巢(图5)。
3 讨论
表皮作为昆虫抵御外界不良环境的第一道防线,其在昆虫生长、变态发育、抵御不良环境等方面都起重要作用[16-17]。 表皮由外向内依次为上表皮、外表皮和内表皮,上表皮主要是由脂肪、蛋白质、多元酚以及蜡质等构成;而外表皮和内表皮主要由几丁质和蛋白质构成[16]。 其中CP 是结构蛋白,起填充表皮间隙和进一步加固表皮的作用[18]。 根据其保守基序的不同,CP 主要可分为CPR(含有R&R 保守基序,可分为RR-1、RR-2 和RR-3)、CPF (保守氨基酸基序不超过44 个)[19]、TWDL(Tweedle,具有4 个保守区域)、CPLCP(复杂度低且富含脯氨酸)、CPG(富含甘氨酸并且大多有保守的AAPA/V 基序)、CPAP1(带有1 个保守的膜蛋白A 结构域)、CPAP3(带有3 个保守的膜蛋白A 结构域)、CPAPn(无固定数量的膜蛋白A 结构域)8 个家族[20-22]。 本研究根据保守基序对14 个CP 进 行 家 族 分 类, 发 现SlICPG-10 和SlICPG-11 属于CPG 家族,其余属于CPR 家族。CPR 家族分布最为广泛[21],在直翅目、膜翅目、鞘翅目和双翅目等昆虫中均有发现[23],R&R 保守基序的N 端富含亲水性氨基酸,其保守性与CP 所在角质层类型密切相关,在坚硬角质层中较为保守,而在柔软角质层中相差较大[5],并且保守基序具有几丁质的结合位点,在结合几丁质方面起重要作用[24]。有研究进一步表明,其保守基序的分子构象最可能为β 折叠[25],而β 折叠是蛋白质和几丁质相互作用所必需的[5]。 SlICPG-10 和SlICPG-11所属的CPG 家族,主要存在于坚硬的角质层中,与细胞角蛋白、卵壳蛋白等结构蛋白相似,具有保护和支撑的作用[5,26]。目前,在7 目24 种昆虫中已发现了超过450 种CP[27],ICP 的相关研究已逐渐引起了研究者的关注。

图5 SlICPG 基因在斜纹夜蛾成虫生殖器官中表达差异分析Fig. 5 Differential expression of SlICPG genes in the reproductive organs of adults of Spodoptera litura
昆虫表皮主要含有几丁质- 蛋白质复合体,其组成随部位和物种而异,在不同阶段和不同时期表现出较大的差异[22],并且有研究表明在所有昆虫物种中都发现了大量的CP, 其数量和特征在不同物种之间也有较大差异[23,28]。 例如中红侧沟茧蜂Microplitis mediator 的CP 在卵和蛹2 个阶段出现表达高峰,而这两个时期正是角质层形成和发展的关键时期[29]。在本研究中,克隆得到斜纹夜蛾14 个ICPG,其在幼虫多种组织中均有表达,但在体壁和脂肪体中相对表达量较高,而在生殖器官(精巢、卵巢)中,大部分基因相对表达量较低; 这与ICPG 的组织和时期表达特异性[30]相吻合,并且其表达模式与功能多样性贯穿昆虫整个生命周期[4]。由于CP 是幼虫表皮的主要成分之一,其基因表达模式可能直接反映幼虫生长过程中表皮的变化[31]。 有研究表明,桔小实蝇Bactrocera dorsalis 的表皮蛋白基因表达谱在向白色蛹转变的过程中发生了显著的变化,表明在蛹形成过程中,表皮蛋白基因可能在分子水平上发生了显著的变化[31];黄粉虫Tenebrio molitor 在发育的每个阶段都具有独特的表皮蛋白基因表达,并且被证实这是每个发育阶段独特表皮蛋白合成和分泌程序的结果[32];松墨天牛Monochamus alternatus 表皮蛋白基因在其幼虫中广泛表达,在成虫中表达量最高[18];家蚕Bombyx mori CPT2基因在幼虫化蛹时出现表达高峰, 在化蛹后,表达骤然下降,说明其在幼虫化蛹中发挥重要作用[33];冈比亚按蚊Anopheles gambiae CPF3、CPLCG3和CPLCG4 基因在成虫中转录水平较高,并且三者的mRNA 主要集中于成虫的生殖器和附腺,推测其与成虫生殖系统的发育密切相关[34-35],正如本试验中SlICPG-5、SlICPG-9、SlICPG-10 等基因在精巢和卵巢中也出现表达量高的现象,推测其在成虫生殖系统的发育中发挥一定的作用;在半翅目如灰飞虱Laodelphax striatellus 中,表皮蛋白基因CPR1 在血淋巴中表达,并参与了植物病毒的传递[36]。 这种表达组织的特异性与本研究得出的结论相似。
由于ICP 与昆虫抗药性密切相关[33],并且杀虫剂的触杀作用是最主要、最普遍的杀虫方式[19],因此深入研究ICPG, 可解释部分昆虫抗药性产生的原因。 表皮降低杀虫剂穿透性,并能延缓药剂到达靶标部位的时间,随着解毒代谢作用的增强,使昆虫有充分的时间和较快地代谢进入体内的杀虫剂,从而提高对杀虫剂的抗性[33-34],其中起主要作用的是ICP。 相关研究表明,CPF3 家族基因的变化会影响冈比亚按蚊的抗性水平[34],CPLCG3 在抗性冈比亚按蚊和敏感蚊之间有表达差异,并随着蚊龄的增长表达逐渐增强[37-38]。 西非冈比亚按蚊通过过量表达CP 基因(CPLCG3、CPR124、CPR127、CPR129)来增厚外表皮、中表皮和内表皮的几丁质层,从而产生对拟除虫菊酯的抗性[39];另外,已有研究报道杀虫剂谷硫磷能高度诱导马铃薯甲虫Leptinotarsa decemlineata 的ICP 基因LLd-GRP1、LLd-GRP2 和LLd-GRP3 表达,产生抗药性,并且在威斯康辛州中部的吡虫啉抗性群中,LdCPH1 的转录水平上升3.96 倍[40-41];在淡色库蚊Culex pipiens pallens 中ICP 基因Unigene394 在敏感品系中的表达占10.78%, 而在抗性品系中的表达占73.95%[42]。 进一步研究发现,CPLCG5 通过形成坚硬基质参与拟除虫菊酯抗性形成过程[43],当敲除淡色库蚊中的CPLCG5,其对溴氰菊酯的敏感性提升[44]。 因此,ICPG 与昆虫抗性的产生具有紧密联系, 并可根据相关ICPG 表达谱,选择适期进行害虫防治。 本研究中14 个基因于高龄幼虫期在体壁中高表达,低龄幼虫期在脂肪体中高表达的试验结果,为后续基因功能研究[45-46]与害虫防治奠定了基础。
4 结论
本研究中克隆得到斜纹夜蛾14 个ICPG,通过序列比对发现所选目的基因编码产物具有35~36 个氨基酸保守基序, 属于几丁质结合蛋白,其中SlICPG-1、SlICPG-2、SlICPG-3、SlICPG-4、SlICPG-5、SlICPG-6、SlICPG-7、SlICPG-8、SlICPG-9、SlICPG-12、SlICPG-13 和SlICPG-14 所表达的表皮蛋白属于CPR 家族,SlICPG-10 和SlICPG-11 所表达的表皮蛋白属于CPG 家族; 进化树分析发现,目的基因更多的与棉铃虫表皮蛋白基因同源性较高;对目的基因表达谱进行分析,结果表明所验证基因具有组织龄期表达差异性。 在生殖器官(精巢、卵巢)中,大部分基因相对表达量较低, 而SlCPG-5 在卵巢中的表达量最高;SlCPG-3、SlCPG-7、SlCPG-9 和SlCPG-10 在精巢中表达量较高; 在蛹期,SlICPG-11 和SlICPG-14相对表达量最高。
在幼虫各组织中,多数基因在体壁和脂肪体组织中高表达,并且具有高龄期在体壁组织中高表达, 低龄期在脂肪体组织中高表达的现象,推测14 个表皮蛋白基因更多地参与脂肪体中相关蛋白的合成,协助脂肪体行使其代谢、贮存营养、保护等功能。 结合它们各自的mRNA 表达模式,推断它们可能参与外表皮和内皮层的形成。 上述研究结果为单个蛋白精确定位和后续功能研究[45-46]奠定基础,并且可明确相关表皮蛋白抗性基因低表达时期,从而指导科学施药防治。
