ALDH1和Ki67在乳腺癌患者中的表达特点及临床意义*
2020-07-22周飞马爽乔娜宋根张静李锐
周飞,马爽,乔娜,宋根,张静,李锐
161005 黑龙江 齐齐哈尔,齐齐哈尔市第一医院南院 乳腺二科;510515 广州,南方医科大学附属齐齐哈尔医院 乳腺二科
乳腺癌是在全球女性中是最常见的恶性肿瘤,2018年在全球癌症死亡率中位居女性首位[1]。目前,中国乳腺癌的发病率超过了全球平均乳腺癌发病率的2倍多,尤其在中国东南部及沿海城市这种表现更为突出[2]。
ALDH1是一种解毒酶,能氧化细胞内的醛,将视黄醇转化为视黄酸[3-5],在原始干细胞的分化中扮演着重要的角色[3]。在小鼠和人类的造血系统、神经系统和祖细胞中,均发现有ALDH1的表达,并且在正常干细胞和恶性肿瘤干细胞中也可见其表达[6-7]。目前已有研究分析显示ALDH1在正常组织中低表达,而在一些恶性肿瘤组织中如乳腺癌、肺癌及食管癌中高表达[8-10]。Ki67为单克隆抗体Ki67的抗原标志物,是增生细胞中表达的核抗原。Ki67表达越高,肿瘤越难消退。临床上常把Ki67作为评价预后与复发风险的一种标记物,可以对患者接受了全身治疗后的预后及恢复情况进行监测与评估[11-12]。
然而,乳腺癌组织中ALDH1和Ki67的表达与肿瘤细胞的分化情况、淋巴转移情况和TNM分期尚不明确。本次研究采用间接荧光染色的研究方法[13],来研究它们的表达特点与乳腺癌临床病理特征之间的关系。
1 材料及方法
1.1 患者和组织标本
乳腺组织标本取自于齐齐哈尔市第一医院乳腺科接诊的女性乳腺癌患者,时间跨度为2009年1月至2014年1月。所有入组患者手术前均未接受过化疗、放疗等综合治疗。50例乳腺癌标本中,按组织学分级(G)分为高分化组10例(G1),中分化组20例(G2),低分化组20例(G3)。正常乳腺组织的标本取自于距离乳腺癌组织至少5 cm以上的正常乳腺组织中。所有组织石蜡标本采用间接免疫荧光染色。全部患者同意参与入组并签署知情同意书。所有组织标本的组织学分级由两位病理学专家分别独立进行评价。
1.2 间接荧光免疫染色
按间接荧光抗体染色试剂盒(美国 Sigma 公司产品)说明书提供的方法进行操作。将组织切片用二甲苯脱蜡,梯度乙醇水化,高压煮沸法进行抗原修复;三乙醇胺缓冲盐水溶液(tris buffered saline,TBS)冲洗,加入封闭液 37 ℃封闭 30 min;加入1∶400稀释的兔抗人ALDH1单克隆抗体(美国Earthox公司产品,HZ348711)4℃反应过夜;次日,加入1∶100稀释的荧光标记的羊抗兔免疫球蛋白G二抗(美国Earthox公司产品,E032120-01),37℃反应30 min;TBS-T漂洗3次,盖上涂有防褪色封固剂的盖玻片,在荧光显微镜下(Nikon,Tokyo,Japan)检测荧光染色阳性的细胞百分比,并评估染色率。Ki67间接荧光染色法与ALDH1相似,稀释浓度为1∶50。
1.3 评价标准
对ALDH1和Ki67的免疫组织染色评价由两名病理学专家分别单独进行。随机选择3~5个视野(×200),每个视野计数 100个细胞,计算 ALDH1 荧光染色阳性的细胞百分率,以荧光染色率≥20%,视为阳性表达,低于此标准视为ALDH1阴性表达[14]。Ki67的细胞染色阳性表达率≥20%视为Ki67阳性表达,低于此标准视为阴性表达[15]。
1.4 统计学分析
ALDH1和Ki67的乳腺癌临床病理特征及其在乳腺癌中和正常组织中的表达情况使用卡方检验进行评估,以P<0.05为差异具有统计学意义。ALDH1和Ki67的表达相关性通过Spearman秩的相关性分析进行评估。所有数据使用SPSS 12.0软件进行分析(SPSS,Chicgo,IL,USA)。
2 结 果
2.1 患者情况
本次研究共纳入50例乳腺癌患者,所有患者均为女性,病理类型均为浸润性导管癌,中位年龄为50.3岁(范围在28岁至65岁之间)。其中有19例患者年龄≥60岁(38%),31例患者年龄<60岁(62%)。所有蜡块通过组织学分级分为G1(高分化),G2(中分化)及G3(低分化)。G1组为10例(20%),G2组为20例(40%),G3组为20例(40%)。20例(40%)患者为TNM分期的I/II期,30例(60%)患者为TNM分期的III/IV期。腋窝存在淋巴结转移的患者34例(68%)(表1)。

表1 患者特征(N=50)Table 1. Characteristics of Patients (N=50)
2.2 ALDH1及Ki67在正常乳腺组织中和乳腺癌组织中的表达特点
实验发现ALDH1在乳腺癌组织中的细胞质中表达。与正常乳腺组织相比,在乳腺癌组织中ALDH1的阳性表达率明显升高(χ2=4.349,P<0.05)。ALDH1在正常乳腺组织中的阳性表达率为12%。而在50例乳腺癌患者中,ALDH1阳性表达率却为66%。在50例乳腺癌组织标本中,有22例为Ki67阳性表达,而在正常乳腺组织标本中,仅有13例为Ki67阳性表达,差异有统计学意义(χ2=4.781,P<0.05)(表2)。
2.3 ALDH1和Ki67的表达与乳腺癌临床病理特征之间的关系
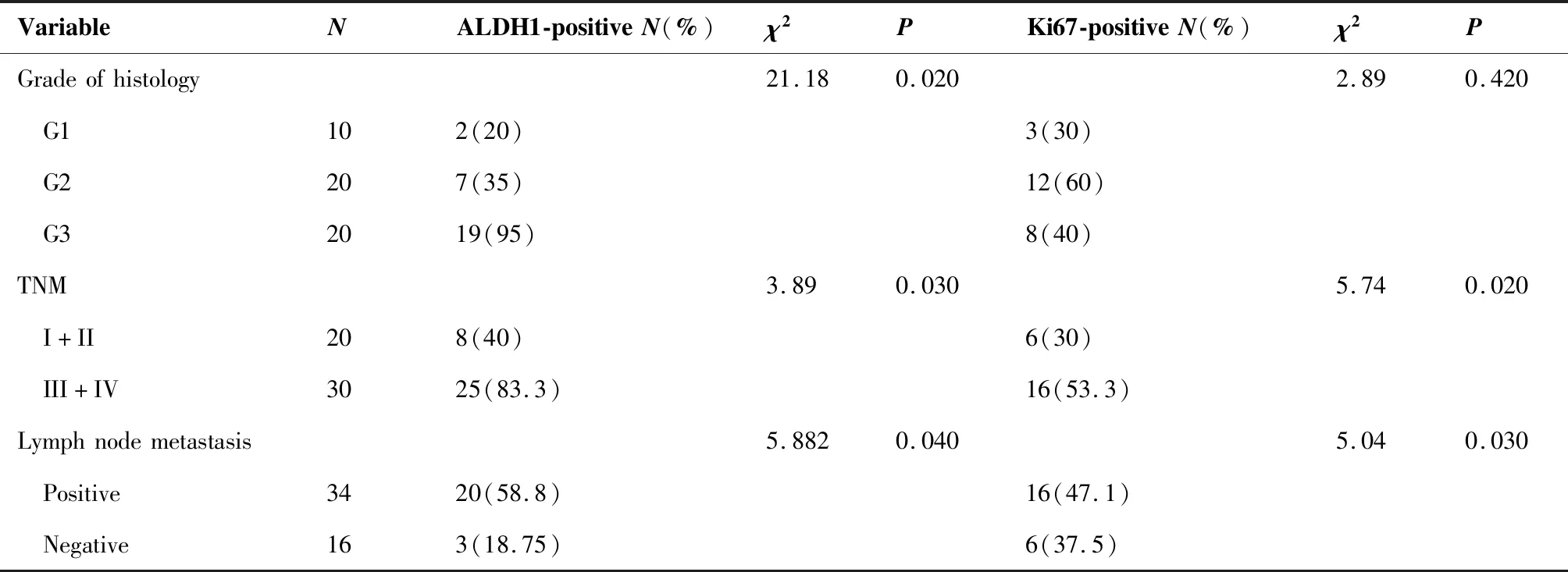
ALDH1和Ki67的表达特点与临床病理特征之间的关系见表3。ALDH1在女性不同年龄中的表达也不同(χ2=5.6,P<0.05)。在年龄<60岁的女性中,ALDH1表达的阳性率占70.9%;而在年龄≥60岁女性却占57.8%。同时,研究也发现ALDH1的表达与乳腺癌的组织学分级是相关的。随着乳腺癌的组织学分级的升高,ALDH1的表达水平也在增加。与G1和G2组织相比,ALDH1的阳性表达率在G3组织中明显增加(χ2=21.185,P<0.05)(图1)。但是,Ki67的表达水平却与组织学分级没有明显关系(图2)。乳腺癌分期为III/IV期的乳腺癌患者ALDH1的阳性表达率(83.3%)比I/II期患者明显升高(40%;χ2=3.89,P<0.05)。除此之外,ALDH1的表达与腋窝的淋巴结转移同样具有相关性。与没有淋巴结转移的组织相比(18.75%),有淋巴结转移的组织中,ALDH1的表达阳性率同样也是上升的(58.8%;χ2=5.882,P<0.05)(图3)。研究还发现了Ki67的表达虽然与年龄因素无明显差异,却与TNM分期有关。与I/II期乳腺癌相比(30%),Ki67在III/IV期乳腺癌组织中阳性表达率明显高表达(53.3%;χ2=5.741,P<0.05)。此外,Ki67在淋巴结有转移的组织中的阳性表达率也明显高于没有淋巴结转移的组织(47.06%;χ2=5.04,P<0.05)(图4)。
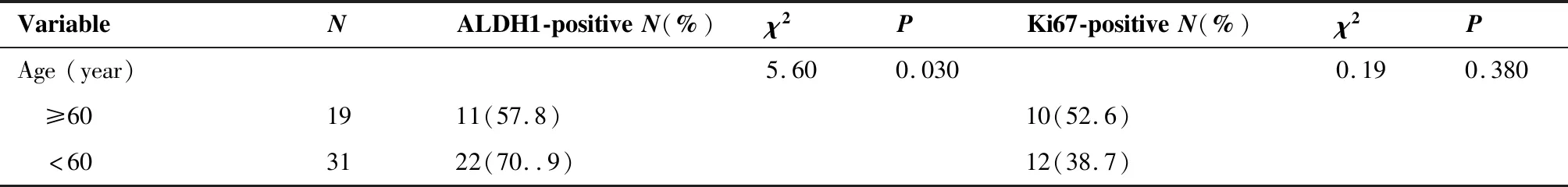
表3 乳腺癌女性ALDH1阳性和Ki67阳性表达与临床病理特征的关系Table 3. Association of Clinicopathologic Features of Breast Cancer Women with ALDH1-Positive and Ki67-Positive Expression
VariableNALDH1-positiveN(%)χ2PKi67-positiveN(%)χ2PGradeofhistology21.180.0202.890.420 G1102(20)3(30) G2207(35)12(60) G32019(95)8(40)TNM3.890.0305.740.020 I+II208(40)6(30) III+IV3025(83.3)16(53.3)Lymphnodemetastasis5.8820.0405.040.030 Positive3420(58.8)16(47.1) Negative163(18.75)6(37.5)

图1 乳腺癌肿瘤细胞中ALDH1荧光染色的表达特点(×200)Figure 1. Immunofluorescence Staining of ALDH1 Expression in Breast Tumor Cells (×200)A. Well-differentiated breast tumors (G1); B. Moderately differentiated breast tumors (G2); C. Poorly differentiated breast tumors (G3).
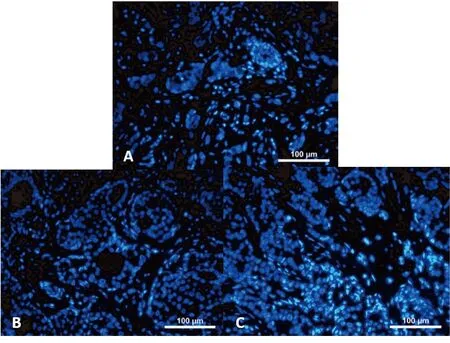
图2 乳腺癌肿瘤细胞中Ki67荧光染色的表达特点(×200)Figure 2. Immunofluorescence Staining of Ki67 Expression in Breast Tumor Cells (×200)A. Well-differentiated breast tumors (G1); B. Moderately differentiated breast tumors (G2); C. Poorly differentiated breast tumors (G3).

图3 在有或无淋巴结转移的乳腺癌患者的肿瘤细胞中ALDH1荧光染色的表达特点(×200)Figure 3. Immunofluorescence Staining for ALDH1 Expression in Cancer Cells from Breast Cancer Patients with or without Lymphatic Metastasis (×200)A. Cancer cells from breast cancer patients with lymphatic metastasis; B. Cancer cells from breast cancer patients without lymphatic metastasis.
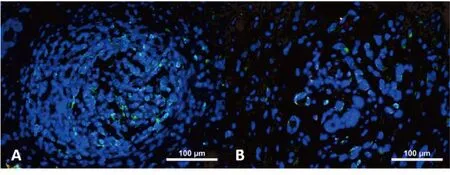
图4 在有或无淋巴结转移的乳腺癌患者的肿瘤细胞中Ki67荧光染色的表达特点(×200)Figure 4. Immunofluorescence Staining for Ki67 Expression in Cancer Cells from Breast Cancer Patients with or without Lymphatic Metastasis (×200)A. Cancer cells from breast cancer patients with lymphatic metastasis; B. Cancer cells from breast cancer patients without lymphatic metastasis.
2.4 ALDH1和Ki67在乳腺癌中表达的相关性
在50例标本中,10例中可见ALDH1和Ki67表达,而12例中未见ALDH1和Ki67表达。仅有1例显示了ALDH1表达阳性而Ki67表达阴性。通过对比研究发现,有10例出现了ALDH1阴性表达而Ki67阳性表达。Spearman秩的相关性分析证实ALDH1和Ki67在女性乳腺癌组织中的表达呈正相关(r=0.976,P<0.05;表4)。

表4 乳腺癌中ALDH1和Ki67表达之间的关系Table 4. Association between ALDH1 and Ki67 Expression in Breast Cancer
3 讨 论
乳腺癌是全球女性中最常见的恶性肿瘤,在2014年,中国女性乳腺癌新发病例约27.89万例,占女性恶性肿瘤的16.51%,位居女性恶性肿瘤发病率的首位[16],它的高发病率主要与肥胖、高脂饮食、饮酒、晚婚晚育以及遗传因素等有关[17]。
目前,乳腺癌以手术治疗、放疗以及化疗等综合治疗为主,但治疗效果有限,仍然会有部分患者出现肿瘤复发、转移等问题。在恶性肿瘤的治疗中,恶性肿瘤的早期诊断以及治疗尤为重要。肿瘤干细胞理论的提出是人们开始认识肿瘤干细胞的基础,肿瘤干细胞数量极少,但具有自我维持、自我更新能力,可分化产生异常肿瘤细胞群并导致肿瘤复发和转移,即具有致瘤性,并具有产生构成肿瘤的多种类型细胞的潜力[18]。ALDH1是一种解毒酶,能氧化细胞内的醛,是一种肿瘤干细胞表面的特异标记物[19]。本研究中通过与正常乳腺组织相比,乳腺癌组织中ALDH1的阳性率明显增加, 由此可以提示ALDH1存在于乳腺癌组织中的表达水平有实际意义。
根据表3中可发现,ALDH1的表达水平在年龄小于60岁的乳腺癌患者中表达更高,这也间接地证明了年轻乳腺癌患者的临床预后更差可能与其ALDH1高表达有关。除此之外,肿瘤的组织学分级(G1,G2和G3)与ALDH1的表达也有着重要关系,间接免疫荧光染色结果也证实ALDH1的表达水平与乳腺癌的组织学分级具有相关性。TNM分期在III/IV期的乳腺癌患者,它的ALDH1表达水平比I/II期的更高。研究还显示了在有淋巴结转移的样本中,ALDH1的阳性表达率高于没有淋巴结转移的组织标本。张琼霞等[20]研究表明,高表达ALDH1与Ki67、癌胚抗原CEA以及三阴乳腺癌均密切相关。此外,周文辉等[21]用免疫组织化学双染法分别对ALDH1阳性与ER、Ki67、Her-2状态的相关性进行检测, 发现ALDH1的阳性表达更倾向于ER-、Ki67-、Her-2+的肿瘤细胞, ALDH1阳性表达的肿瘤具有生物学侵袭行为, 与乳腺癌的不良预后密切相关。通过本次实验研究,同样也证实了ALDH1和Ki67在乳腺癌患者中的表达具有正相关性。细胞增殖标志物及癌旁抗原作为肿瘤标志物,已经被广泛应用于临床,作为判断患者预后不良的指标。对于乳腺癌患者结合病理组织中二者表达情况的特点,可以对那些可能出现预后不好的患者进行初步筛查,随访中及时发现问题及时干预和治疗,希望可以改善患者的生存质量或者延长生存期。当然这仍需在后续的研究中继续跟进和研究。
总之,ALDH1和Ki67与女性乳腺癌的临床病理特征关系密切。但是由于样本量少,本研究并不能证明ALDH1可以作为一个绝对特异的乳腺癌独立预后因素。在未来的研究中,仍需加大样本量进一步研究ALDH1的表达特点与乳腺癌肿瘤信号传导通路及肿瘤微环境等的关系,希望从肿瘤干细胞产生机制入手,寻找产生肿瘤干细胞的根源,消灭肿瘤干细胞,从而从根本上来消灭肿瘤细胞产生的来源。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
