近暗散白蚁β-葡萄糖苷酶RpBgl7的异源表达及酶学性质研究
2020-07-22毛国涛王方园苏丽娟张宏森宋安东
毛国涛,刘 茜,王方园,苏丽娟,张宏森,宋安东
(河南农业大学 生命科学学院,河南 郑州 450002)
β-葡萄糖苷酶(β-D-glucosidase,EC 3.2.1.21)可降解非还原性末端的β-葡萄糖苷键,生成出β-D-葡萄糖和相应的糖基配体,在纤维素的高效降解过程中发挥着至关重要的作用。β-葡萄糖苷酶可降解纤维二糖和纤维寡糖,缓解内切 β-1,4-葡聚糖酶和外切葡聚糖酶的产物抑制,是纤维素降解过程的限速酶[1]。β-葡萄糖苷酶大部分属于糖苷水解酶1(GH1)家族和GH3家族,少数属于GH5、9、30和116家族[2-5]。GH1家族β-葡萄糖苷酶具有8个(ɑ/β)结构围成的(ɑ/β)8-TIM桶状结构,也被称为4/7超家族,活性中心位于TIM桶状结构的内部,2个保守的谷氨酸残基作为催化基团催化β-葡萄糖苷键的水解[6-7];GH3家族β-葡萄糖苷酶大多数由(ɑ/β)8-TIM桶状结构域、(α/β)6夹层结构域和纤连蛋白Ⅲ结构域组成,其催化残基由保守的天冬氨酸和谷氨酸组成[8-9]。GH1和GH3家族成员均采用双取代“两步法”构型保持机制催化底物的水解。研究显示,GH1家族β-葡萄糖苷酶的葡萄糖耐受性远高于GH3家族,表明GH1家族成员在纤维素的彻底、高效降解中更具优势。
白蚁肠道内高效的木质纤维素降解酶系,是自然界降解木质纤维素能力最强的生物系统之一[10]。因此,白蚁逐渐成为挖掘具有活力高、葡萄糖耐受性高、热稳定性良好等优异特性纤维素酶的重要来源[11]。白蚁的纤维素酶系主要由其自身和肠道共生微生物共同产生[12-13],如黄翅大白蚁(Macrotermesbarneyi)内源性GH1家族β-葡萄糖苷酶具有较强的葡萄糖耐受性[14];高山象白蚁(Nasutitermestakasagoensis)内源性β-葡萄糖苷酶具有较好的温度稳定性[15]。在前期研究中,河南农业大学宋安东课题组从近暗散白蚁(Reticulitermesperilucifugus)中克隆了GH1家族β-葡萄糖苷酶基因RpBgl7[16]。本研究在大肠杆菌中进行过量表达RpBgl7,利用镍离子亲和层析法纯化得到高纯度的RpBgl7蛋白,研究RpBgl7的最适pH值、最适温度等酶学性质,为构建秸秆生物质高效降解酶系提供理论依据。
1 材料和方法
1.1 质粒与菌株
pCold-TF冷休克表达载体、重组RpBgl7基因的pEASY-Blunt Simple-RpBgl7载体、大肠杆菌DH5α、BL21(DE3)为河南农业大学能源微生物实验室保存。
1.2 主要试剂
酵母提取物、胰蛋白胨购于英国OXID公司,分析纯;4-硝基苯基-β-D-吡喃葡萄糖苷(pNPG)购自美国Sigma公司,分析纯;氨苄青霉素、异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-Thiogalactoside,IPTG)、磷酸二氢钠、磷酸氢二钠、咪唑均购于索莱宝(北京)科技有限公司,分析纯;30%聚丙酰胺购于北京康润诚业生物科技公司,分析纯;镍离子亲和介质购于德国Qiagen公司;琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒均购于北京庄盟生物科技有限公司;T4 DNA连接酶购于美国Thermo Fisher Scientific公司;限制性内切酶SacⅠ、XbaⅠ购于美国NEB公司。
1.3 方法
1.3.1 RpBgl7的生物信息学分析 利用Expasy软件包中ProParam预测RpBgl7的基本性质[17];使用Clustal Omega对RpBgl7与已深入研究的GH1家族β-葡萄糖苷酶进行序列比对[18];利用PHYRE2预测RpBgl7的结构模型[19]。
1.3.2 重组载体pCold-TF-RpBgl7的构建 以正向引物5’-CGAGCTCATGGGGAGTGATAATTGGGCCACAG-3’、反向引物5’-GCTCTAGACTAAGAACTCTCGACACCCAGAAATTCTAC-3’为PCR扩增引物(下划线序列分别为SacⅠ和XbaⅠ酶切位点),以pEASY-Blunt Simple-RpBgl7为PCR扩增模板,扩增RpBgl7基因。限制性内切酶SacⅠ和XbaⅠ同时酶切后的RpBgl7基因片段与pCold-TF载体片段,利用T4 DNA连接酶进行连接,构建重组表达载体pCold-TF-RpBgl7,测序验证RpBgl7基因序列。
1.3.3 RpBgl7的重组表达及纯化 重组表达载体pCold-TF-RpBgl7转入BL21(DE3)大肠杆菌感受态细胞。挑取单克隆在含有100 μg/mL氨苄青霉素的LB培养基中37 ℃振荡培养至OD600 nm为0.8时,加入0.5 mmol/L的IPTG于16 ℃振荡培养18 h。收集菌体,裂解缓冲液(20 mmol/L磷酸盐缓冲液,pH值7.4)重悬菌体,超声破碎,16 000g离心30 min后取上清流穿镍离子亲和层析柱,洗杂缓冲液(20 mmol/L磷酸盐缓冲液,80 mmol/L咪唑,pH值7.4)流穿镍离子亲和层析柱,洗脱缓冲液(20 mmol/L磷酸盐缓冲液,200 mmol/L咪唑,pH值7.4)流穿镍离子亲和层析柱洗脱RpBgl7蛋白,利用超滤管(美国Millipore公司)进行脱盐浓缩,通过十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)分析RpBgl7纯度,高纯度RpBgl7蛋白分装冻存于-80 ℃。
1.3.4 RpBgl7酶活力的测定 采用pNPG法对RpBgl7的酶活力进行测定。总体积为200 μL的反应体系中含有20 mmol/L磷酸盐缓冲液(pH值6.0)、5 mmol/L的pNPG和适当稀释的RpBgl7酶液,于37 ℃反应10 min后加入50 μL的1 mol/L Na2CO3终止反应。用酶标仪(美国Molecular Devices公司)测定其在408 nm 波长处的吸光值,以不同含量对硝基苯酚制作标准曲线,计算RpBgl7的酶活力。1 min内催化pNPG底物生成1 μmol对硝基苯酚所需的酶量定义为1个酶活力单位(U)。
1.3.5 RpBgl7最适pH值的测定 以柠檬酸-柠檬酸钠缓冲液(pH值3.0~5.0)、磷酸盐缓冲液(pH值6.0~8.0)、Tris-HCl缓冲液(pH值8.0~9.0)、碳酸氢钠-氢氧化钠缓冲液(pH值10.0~11.0)为测定酶活力时的缓冲液,按照1.3.4方法于37 ℃测定RpBgl7的酶活力。以得到的最高酶活力处pH值为RpBgl7的最适pH值。
1.3.6 RpBgl7最适温度及稳定性的测定 以RpBgl7的最适pH值缓冲液为酶活力测定缓冲液,分别在30~90 ℃条件下,测定RpBgl7的酶活力。以得到最高酶活力处的温度为RpBgl7的最适温度。稀释的酶液分别在40~80 ℃下孵育30 min,最适反应条件下测定RpBgl7的残余酶活力,以未孵育酶液测定的酶活力为100%。

1.3.8 RpBgl7动力学参数的测定 于37 ℃测定RpBgl7在0.2~2.0 mmol/L pNPG底物条件下的酶促反应速率,根据米氏方程和Lineweaver-Burk双倒数作图法计算RpBgl7的动力学参数Km和kcat。
2 结果与分析
2.1 RpBgl7的生物信息学分析
RpBgl7具有494个氨基酸残基,分子质量为56.7 ku,理论等电点pI=5,不稳定系数为38.4,表明RpBgl7较稳定,适合进行表达、纯化。RpBgl7与已解析结构的GH1家族β-葡萄糖苷酶G1NKBG(Uniprot:O61594,蛋白质数据库PDB:3ai0)、Sfβgly(Uniprot:O61594,PDB:5cg0)具有较高的序列相似性(分别为55%、46%),含有家族内保守的催化氨基酸残基Glu187和Glu394(图1)。RpBgl7的结构模型显示,RpBgl7同样由GH1家族保守的(ɑ/β)8-TIM桶状结构域组成(图2)。生物信息学分析表明,RpBgl7极可能采用GH1家族β-葡萄糖苷酶的催化机制催化纤维二糖等底物的水解。

保守残基标记为红色,催化残基标记为黄色
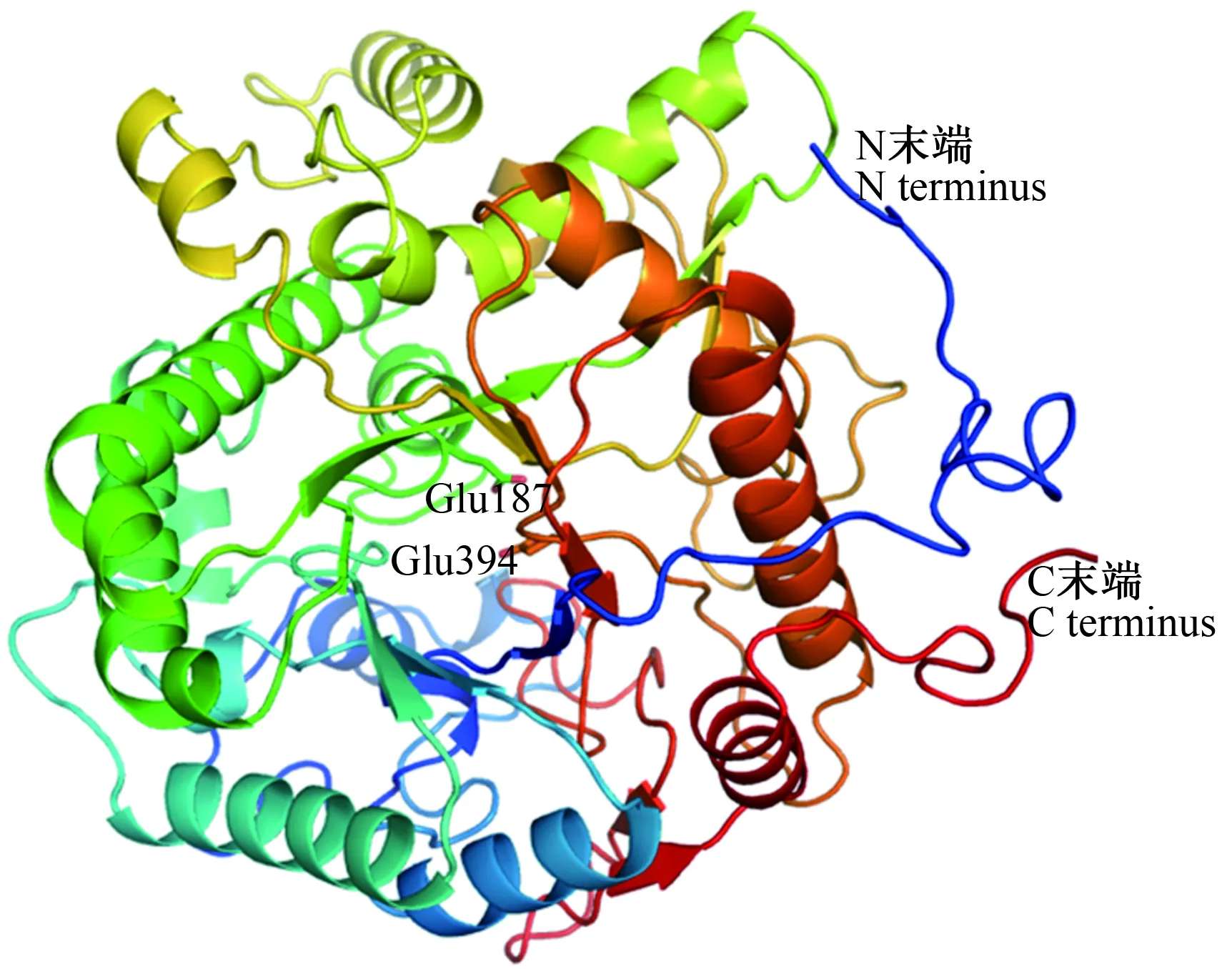
图2 RpBgl7蛋白的结构模型
2.2 重组载体pCold-TF-RpBgl7的构建
扩增得到的RpBgl7基因特异性条带大小与理论分子质量相符(图3A)。酶切后与载体片段重组为pCold-TF-RpBgl7(图4),RpBgl7基因序列经测序验证与理论序列一致。
2.3 RpBgl7的重组表达与纯化
质粒pCold-TF-RpBgl7所表达的RpBgl7重组蛋白的N端融合了触发因子(TF,分子质量为48 ku),该因子作为分子伴侣,有助于重组蛋白的折叠;RpBgl7重组蛋白的N末端带有组氨酸(6×His)标签。RpBgl7蛋白经镍离子亲和层析纯化后,SDS-PAGE显示100~150 ku之间有一条明显的蛋白条带,与重组蛋白的理论分子质量105 ku相符(图5)。结果表明,RpBgl7重组蛋白经镍离子亲和层析1步纯化后纯度即可达到90%以上,可用于后续酶活性分析。

A:RpBgl7基因的扩增;B:酶切后的pCold-TF片段和RpBgl7基因片段;M:DNA分子质量标准品;1:RpBgl7基因扩增片段;2:未酶切的pCold-TF;3—4:酶切后的pCold-TF;5—6:酶切后的RpBgl7基因

图4 pCold-TF-RpBgl7表达载体结构

M:蛋白分子质量标准品;1:细胞裂解后上清部分;2:细胞裂解后沉淀部分;3:纯化后的RpBgl7蛋白
2.4 RpBgl7的酶学性质
2.4.1 RpBgl7的最适pH值和最适温度 以pNPG为底物,测定RpBgl7的最适条件。结果表明,RpBgl7的最适pH值为6.0,在pH值4.0~7.0内具有较高的酶活力;最适温度为70 ℃(图6)。RpBgl7在最适条件下的比活力为0.05 U/mg。

图6 RpBgl7的最适pH值和最适温度

图7 不同金属离子对RpBgl7酶活力的影响
2.4.3 RpBgl7的动力学参数 以pNPG为底物,在37 ℃条件下测定RpBgl7蛋白的动力学参数,结果显示,Km=0.13 mmol/L,kcat=3.15 s-1(图8)。
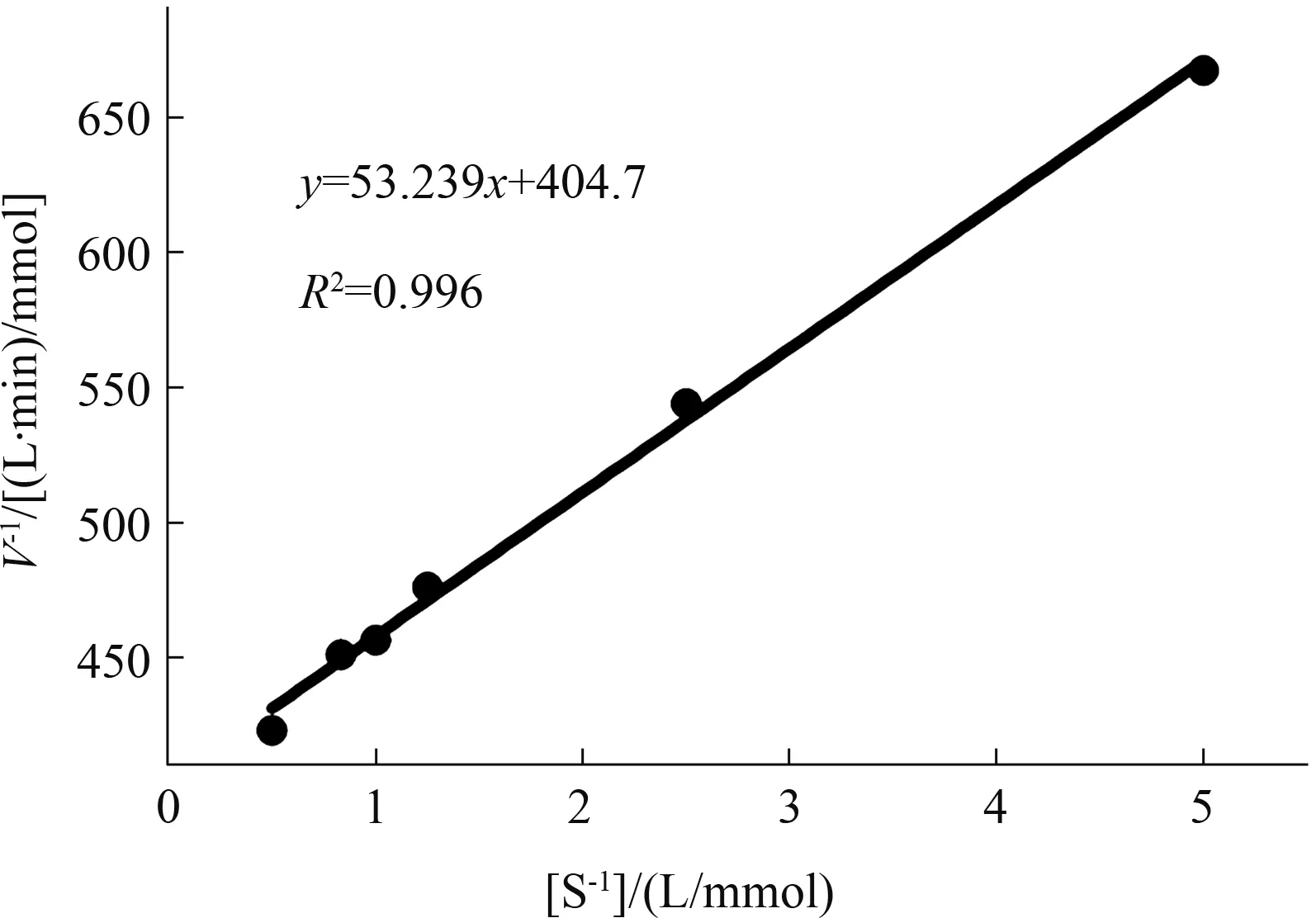
图8 Lineweaver-Burk双倒数法测定的RpBgl7动力学参数
3 结论与讨论
我国每年产生的农业废弃物约为10亿t,其中所含纤维素约为30%~40%[20],纤维素是生物界中最丰富的葡萄糖分子聚合物之一,也是秸秆生物质的主要组成部分。纤维素可用来生产燃料乙醇等替代化石燃料,以解决能源危机的可再生生物质资源,也逐渐成为合成环境友好型以及具有良好生物相容性的高附加值产品的重要原材料[21]。纤维素的高效利用依赖于其充分的降解,纤维素的降解主要由内切 β-1,4-葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶等的相互协同作用[22-23]。研究表明,作为纤维素降解过程中的限速酶,β-葡萄糖苷酶存在着活力较低、稳定性较差、葡萄糖耐受性较弱等缺点,严重制约着纤维素的高效、充分降解[24]。因此,优异特性β-葡萄糖苷酶的挖掘对于纤维素的高效利用至关重要。

