小麦ABA受体基因TaPYL9的克隆和表达分析
2020-07-22徐园园刘冬梅朱晓琴贾方方裴冬丽
徐园园,赵 鹏,刘冬梅,朱晓琴,贾方方,裴冬丽
(1.商丘师范学院 生物与食品学院/植物与微生物互作河南省高校重点实验室,河南 商丘 476000;2.商丘师范学院 人文学院,河南 商丘 476000)
脱落酸(ABA)在植物生长发育和逆境胁迫应答中具有重要的作用,可形成一个复杂的信号通路来抵御植物生长过程中遇到的干旱、高盐和低温等各种非生物胁迫[1-2]。ABA信号通路包含3个组成部分:ABA 受体PYR/PYL/RCAR(Pyrabactin resistance/Pyrabactin resistance like/Regulatory component of ABA receptor)、负调控因子2C 类蛋白磷酸酶(Protein phosphatase 2C,PP2C)和正调控因子蔗糖非酶解型蛋白激酶(Sucrose non-fermenting1-related protein kinase,SnRK2),它们在ABA信号转导中共同组成了一个双重的负调控系统,PYR/PYL/RCAR 负调控 PP2C,而 PP2C 又负调控SnRK2[3]。在正常的生长条件下,PP2C 通过去磷酸化作用使 SnRK2 失活,ABA 信号保持沉默;一旦外界环境条件或本身发育信号诱导植物产生 ABA 之后,ABA 结合PYR/PYL/RCAR并促使其与 PP2C 相互作用,抑制 PP2C 的活性,解除 PP2C 对SnRK2 的抑制,SnRK2 被激活后磷酸化下游的转录因子或膜蛋白等,开启 ABA 信号反应[4-5]。其中ABA 受体PYR/PYL/RCAR是 ABA 信号通路最上游的调控因子,承担着识别 ABA 信号和启动信号转导的作用[6]。
PARK等[7]最先发现PYL家族,他们用种子萌发抑制剂Pyrabactin处理拟南芥(Arabidopsisthaliana),筛选出了抗Pyrabactin突变株,从中分离得到PYR1基因及13个PYR1同源基因,命名为PYR1—PYL13(PYR-like),并发现PYR1蛋白可特异结合ABA。同时MA等[8]研究发现,PYR/PYL/RCAR家族成员可以结合ABA,抑制ABI1或者ABI2 的活性。随后关于PYL的结构和功能研究越来越深入,在结构上PYL家族成员都有1个高度相似的螺旋手柄结构,由2个α-螺旋和7个β-折叠组成,另外,PYL家族成员在N端都有1个α-螺旋结构[9-10]。目前,在拟南芥中PYR/PYL/RCAR家族有14个成员,根据序列差异可分为3个亚族,第Ⅰ亚族包括 PYL7、PYL8、PYL9、PYL10,第Ⅱ亚族包括 PYL4、PYL5、PYL6、PYL11、PYL12、PYL13,第Ⅲ亚族包含 PYR1、PYL1、PYL2、PYL3[11]。
PYL能够调控植物生长发育和逆境胁迫。研究发现,PYL9对ABA信号敏感[12],能调控干旱胁迫和叶片生长[13],并且能和PYL8共同调控拟南芥侧根的生长[14]。在水稻中过表达OsPYL9基因,转基因植株种子萌发对ABA敏感[15]。在番茄中,SlPYL1、SlPYL2、SlPYL4、SlPYL5、SLPYL7、SlPYL8、SlPYL9、SlPYL10、SlPYL11和SlPYL13是ABA依赖型受体基因,而SlPYL3和SlPYL12是非ABA依赖型受体基因,其中SlPYL1、SlPYL2、SlPYL8、SlPYL10基因在ABA胁迫下上调表达[16]。对于玉米PYL家族成员,ZmPYL3、ZmPYL9、ZmPYL10和ZMPYL13基因的过表达提高了转基因拟南芥对ABA的敏感性,过表达ZmPYL8、ZmPYL9和ZmPYL12基因的转基因株系抗旱性增强[17]。在小麦中关于ABA受体的研究也有一些进展,TaPYL13基因在ABA和盐胁迫下上调表达[18],TaPYL2和TaPYL6基因响应盐胁迫[19]。但是到目前为止,尚未见到关于TaPYL9基因的报道。为此,通过同源克隆方法获得小麦ABA受体基因TaPYL9,通过生物信息学方法分析其序列特征,应用实时荧光定量PCR(qRT-PCR)方法研究其在NaCl、ABA和PEG下的表达模式,以期为小麦ABA信号响应和抗旱研究奠定理论基础。
1 材料和方法
1.1 植物材料及培养
供试小麦品种为矮抗58。小麦种子置于光照培养箱中培养(22 ℃,16 h光照)。一叶一心时分别用250 mmol/L NaCl、50 mmol/L ABA、15% PEG4000溶液进行处理,分别在处理0、3、6、12、24 h时取小麦幼苗叶片,液氮速冻后-80 ℃保存。
1.2 总RNA的提取及cDNA第一链的合成
采用Trizol法提取小麦叶片总RNA。采用PrimeScriptTM1st Strand cDNA Synthesis Kit(TaKaRa公司)进行cDNA第一链的合成。
1.3 TaPYL9基因克隆
以拟南芥AtPYL9基因序列搜索小麦EST 数据库,用EST序列进行电子延伸获得目标基因的cDNA序列。根据cDNA序列信息设计扩增引物,F:5′-GAACCCACCAAACCGATTAGC-3′和R:5′-CGAGGAGAACTCTTCCACCAAT-3′,以小麦cDNA 为模板进行PCR扩增。PCR反应体系:KOD-plus-Neo 1μL,10×KOD-plus-Neo buffer 5 μL,2 mmol/L dNTPs 5 μL,25 mmol/L MgSO45 μL,10 μmol/L上、下游引物各1 μL,cDNA 2 μL,加ddH2O至总体积50 μL。PCR扩增程序:94 ℃ 2 min;98 ℃ 10 s,58 ℃ 30 s,68 ℃ 1 min,扩增35个循环。回收扩增产物,连接T克隆载体pMD19-T,转化大肠杆菌DH5α,提取质粒DNA,送生工生物工程(上海)股份有限公司进行测序。
1.4 TaPYL9基因的生物信息学分析
用Open Reading Frame Finder(https://www.ncbi.nlm.nih.gov/orffinder/)预测基因的开放阅读框和编码的氨基酸序列。使用Protparam(https://web.expasy.org/cgi-bin/protparam)对氨基酸序列的理化性质进行分析。用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma)预测蛋白质二级结构,通过SWISS-MODEL(https://swissmodel.expasy.org)预测蛋白质三级结构。通过NCBI在线分析工具Conserved domains分析氨基酸的保守结构域。利用NCBI (https://blast.ncbi.nlm.nih.gov/)数据库进行BLAST分析,找出与TaPYL9同源性最高的8个PYL蛋白,采用DANMAN进行多重序列比对。采用MEGA 7.0软件邻接法构建系统进化树。用MEME在线工具(http://meme-suite.org/tools/meme)分析TaPYL9和其他植物PYLs氨基酸序列的保守基序(Motif)差异,Motif数目设置为10,其他为默认设置。
1.5 qRT-PCR分析
根据目的基因TaPYL9序列和小麦看家基因β-actin(GenBank:AB181991.1)设计qRT-PCR所需的目的基因引物TaPYL9YG-F、TaPYL9YG-R和内参基因引物actin-F、actin-R。引物序列见表1。
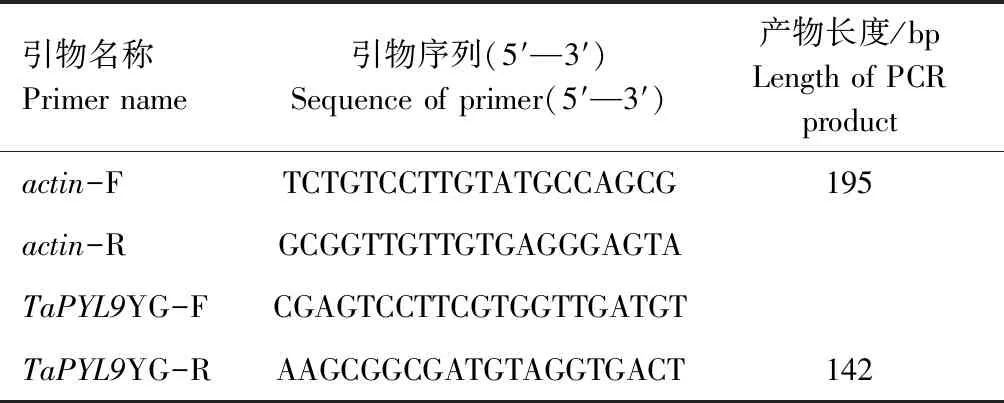
表1 qRT-PCR引物信息Tab.1 The primers information of qRT-PCR
1.6 数据处理
qRT-PCR 试验进行 3 次生物学重复,每次重复 4 个技术重复。目标基因在模板中的相对表达量用 2-ΔΔCt计算,使用IBM SPSS Statistics 21.0进行方差分析,使用Excel 2007制作图表。
2 结果与分析
2.1 TaPYL9基因的克隆
以小麦cDNA为模板,进行PCR扩增,得到了长度稍大于1 000 bp的DNA片段(图1),测序得到长度为1 173 bp的序列,其开放阅读框长618 bp,编码205个氨基酸残基。

1:Marker 2000;2:Marker 15000;3:TaPYL9基因PCR 产物
2.2 TaPYL9蛋白序列及结构分析
对TaPYL9蛋白的理化性质进行分析发现,其分子质量为22 218.06 u,等电点为5.79,负电荷氨基酸残基(Asp + Glu)数为26,正电荷氨基酸残基(Arg+Lys)数为21,不稳定指数为47.47,为不稳定蛋白。在氨基酸组成上,以Val (V)含量最高,为11.2%,其次为Gly (G,9.3%),第3位为Leu (L,8.8%),脂溶性指数为 89.32,亲水性系数为 -0.220,为亲水蛋白。对TaPYL9蛋白进行二级结构预测发现,α-螺旋占41.46%,延伸链占18.05%,β-转角占5.37%,无规则卷曲占35.12%。预测该蛋白的三级结构发现,该蛋白含有典型的PYL螺旋手柄结构,该结构有2个α-螺旋和7个β-折叠(图2)。对TaPYL9蛋白结构域进行预测发现,其含有1个PYR/PYL/RCAR like家族结构域(图3),该家族属于SRPBCC(START/RHO alpha_C/PITP/Bet_v1/CoxG/CalC)超家族,该超家族结构域中有1个深口袋状的疏水配体结合囊,能够结合ABA等多种配体。
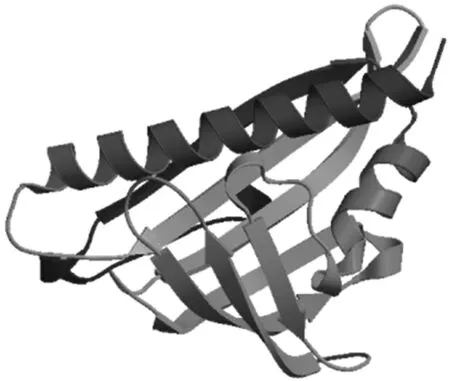
图2 TaPYL9蛋白三级结构
2.3 TaPYL9蛋白同源性及系统进化分析
经分析发现,TaPYL9蛋白与其他植物的PYL蛋白的相似性较高,其中与山羊草(Aegilopsspeltoides)AsPYL9-like(XP_020194954.1) 和二穗短柄草(Brachypodiumdistachyon)BdPYL8(XP_003568737.1)氨基酸序列的同源性最高,分别为99%和90%。选取前8个同源性较高的序列进行多重序列比对,发现这些序列在C端同源性较高,N端具有较大的可变性(图4)。系统进化树分析发现,TaPYL9和AsPYL9-like亲缘关系最近,与拟南芥(Arabidopsisthaliana)13个PYL家族成员中的AtPYL7、AtPYL8、AtPYL9、AtPYL10亲缘关系较近,其中,与AtPYL9最近,属于1个亚族,与其他拟南芥PYL家族成员亲缘关系较远(图5)。

图3 TaPYL9 蛋白结构域分析

AsPYL9-like:XP_020194954.1;BdPYL8:XP_003568737.1;FePYL5 (Festuca elata PYL5):ATP66592.1;OsPYL5(Oryza sativa PYL5):XP_015640707.1;ObPYL8-like(Oryza brachyantha PYL8-like):XP_006655099.1;Oryza sativa ABA receptor 5:AIX10793.1;SiPYL8(Setaria italica PYL8):XP_004960624.1;DoPYL8 (Dichanthelium oligosanthes PYL8):OEL21558.1
2.4 TaPYL9蛋白Motif分析
选取系统进化分析中与TaPYL9同一亚族的部分PYL,包括拟南芥ABA受体AtPYL7(Q1ECF1.1)、AtPYL8(Q9FGM1.1)、AtPYL9(Q84MC7.1)、AtPYL10(Q8H1R0.1)和AsPYL9-like(XP_020194954.1)、FePYL5(ATP66592.1)、SiPYL8(XP_004960624.1)、DoPYL8(OEL21558.1)、TaPYL9共9个PYL蛋白进行Motif分析。由图6可知,TaPYL9包含7个Motif,其中Motif1、Motif2、Motif3和Motif4是所检测的9个PYL蛋白共有的。Motif5是TaPYL9、AsPYL9-like、FePYL5、SiPYL8、DoPYL8、AtPYL9共有的,拟南芥的其他3个PYL蛋白不存在。Motif6在TaPYL9、AsPYL9-like、FePYL5、SiPYL8、DoPYL8中存在,拟南芥的4个PYL中都不存在。Motif9是TaPYL9和AsPYL9-like所特有的,其他几个PYL蛋白中均没有。TaPYL9和AsPYL9-like含有相同的Motif,说明它们的氨基酸序列结构最相似。在拟南芥的4个PYLs蛋白中,AtPYL9和TaPYL9的Motif相似性最高,这和系统进化树分析结果相同,再次证明TaPYL9和AtPYL9亲缘关系最近,可能具有相同的生物学功能。

图5 TaPYL9蛋白系统进化分析

图6 TaPYL9蛋白Motif分析
2.5 TaPYL9基因表达分析
在ABA处理下,TaPYL9表达量总体呈先上升后下降再上升的趋势,处理6 h时,表达量上升为原来的1.5倍;处理12 h时,表达量下降为原来的3/5;随后表达量上升,到24 h时,表达量增加为原来的2.3倍(图7)。TaPYL9对ABA处理敏感,属于ABA依赖型受体。
在NaCl处理下,TaPYL9表达量总体呈先下降后上升再下降再上升的趋势,在处理3 h时,表达量下降到处理前的3/5,随后表达量增加;在处理6 h时,表达量增加至原来的2.1倍;随后缓慢下降,但仍然比处理前高,在24 h时,表达量为处理前的1.7倍,表明TaPYL9可能参与调控小麦盐胁迫应答(图7)。
在PEG模拟的干旱处理下,TaPYL9表达量呈波动式上升趋势,在处理3 h时,表达量下降为原来的2/5;随后缓慢上升,在处理12 h时,又略微下降,但随后迅速上升;在处理24 h时,表达量为处理前的2.7倍(图7),表明该基因可能参与调控小麦干旱胁迫应答。
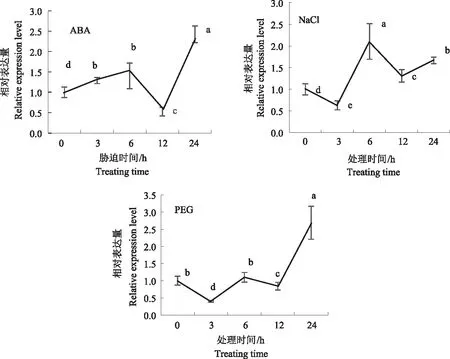
不同小写字母表示不同处理时间的差异达到显著水平(P<0.05)
3 结论与讨论
PYR/PYL/RCAR家族是ABA信号通路的关键组成部分,能够识别ABA信号并结合ABA启动ABA信号通路从而调控植物生长发育和逆境应答。本研究从普通小麦品种矮抗58中分离得到了1个PYL家族成员TaPYL9,该基因编码205个氨基酸残基,TaPYL9蛋白为不稳定的亲水蛋白,与木薯和马铃薯PYL8相似[20-21]。蛋白质二级结构分析表明,TaPYL9蛋白以α-螺旋为主;蛋白质三级结构预测表明,该蛋白包含一个由2个α-螺旋和7个β-折叠组成的螺旋手柄结构,符合PYL家族成员的典型结构特征[9-10]。功能域分析也表明,TaPYL9蛋白具有PYL家族的PYR/PYL/RCAR like功能域,TaPYL9可能是PYL家族成员。TaPYL9与其他植物PYL家族成员例如二穗短柄草BdPYL8(XP_003568737.1)、山羊草AsPYL9-like(XP_020194954.1)同源性较高,进一步证明其为PYL家族成员。系统进化分析表明,TaPYL9蛋白和AsPYL9-like亲缘关系最近,和拟南芥家族中的AtPYL7、AtPYL8、AtPYL9、AtPYL10同属于第Ⅰ亚族,其中与AtPYL9亲缘关系最近,而AtPYL4、AtPYL5、AtPYL6、AtPYL11、AtPYL12、AtPYL13属于第Ⅱ亚族,AtPYL1、AtPYL2、AtPYL3属于第Ⅲ亚族,这与前人对拟南芥PYL家族的分组情况研究结果相同[11]。Motif分析也证明在拟南芥PYL蛋白中,AtPYL9和TaPYL9蛋白Motif的相似性最高,这和系统进化树分析结果相同,再次证明TaPYL9和AtPYL9亲缘关系最近,可能具有相同的生物学功能。
AtPYL9参与ABA信号通路,对ABA信号敏感,能够调控干旱胁迫[12-13],同时水稻和番茄中的研究也证明PYL9对ABA敏感,能够调控ABA信号通路[15-16]。玉米ZmPYL9能够增强转基因拟南芥的抗旱性[17]。把棉花GhPYL9-11A基因转化拟南芥表明,GhPYL9-11A基因促进了幼苗根系生长,提高了抗旱基因的表达量[22]。因此,推测TaPYL9可能参与ABA信号通路,能够调控小麦逆境胁迫响应,基于此本研究用qRT-PCR方法分析了TaPYL9基因在ABA、PEG和NaCl处理下的表达模式,在3种处理下该基因均上调表达,表明TaPYL9可能在调控小麦ABA信号通路中具有重要的作用,可能参与小麦非生物胁迫应答的调控,关于其调控机制还需要进一步研究。
