沉默HMGA2基因表达逆转急性髓细胞白血病耐药细胞株HL-60/DNR对柔红霉素耐药性的研究
2020-07-21于宝丹郑润辉李海明
于宝丹 郑润辉 李海明
(1 广州医科大学附属第一医院检验科,广东 广州 510000;2 广州医科大学附属第一医院血液科,广东 广州 510000)
急性髓系白血病(acute myeloid leukemia,AML)是一种骨髓性造血芽细胞异常增殖的血液恶性肿瘤[1]。目前,AML的治疗方法主要有化学治疗(化疗)、放射治疗、靶向治疗、免疫治疗、干细胞移植等。临床上根据患者的不同情况选择不同的综合治疗方案,但仍然以化疗为主。AML细胞对化疗药物的耐药成为AML治疗过程中的主要障碍。研究AML细胞产生耐药的分子机制以及如何克服AML细胞的耐药表型,对提高AML化疗效果具有重要的实际意义。
高迁移率族蛋白2(high mobility group AT-hook 2,HMGA2)是高迁移率族蛋白家族成员之一。HMGA2在多种肿瘤细胞中高表达,能够促进肿瘤细胞的增殖及转移,并参与肿瘤耐药的发生[2-4]。研究发现,干扰HMGA2能增加野生型AML细胞对柔红霉素(daunorubicin,DNR)的敏感性[5]。但是对于HMGA2能否逆转AML细胞对柔红霉素的耐药性仍未阐明。本文将以HL-60柔红霉素耐药细胞株HL-60/DNR为研究对象,分析干扰HMGA2能否逆转HL-60/DNR对柔红霉素的耐药性,评估HMGA2作为克服白血病细胞耐药的分子靶点的潜能。
1 材料与方法
1.1 主要实验仪器与试剂:柔红霉素产自美国Merck;AML细胞系HL-60产自上海中科院细胞库;基础培养基和胎牛血清均产自美国Gibco公司;培养板及培养瓶产自美国Corning;Lipofectamine RNAiMAX产自美国Invitrogen;CCK8试剂盒产自日本Dojindo Molecular Technologies公司;Trizol和SYBR GREEN qPCR Super Mix来自美国Invitrogen公司;引物和siRNA由上海吉玛制药技术有限公司合成;β-半乳糖苷酶(β-GAL)活性检测试剂盒(货号:BC2580)产自北京索莱宝科技有限公司;HMGA2一抗产自美国Abcam公司;ImProm-IITM Reverse Transcription System产自美国promega;CXF96型荧光定量PCR仪产自美国Bio-Rad;MultiscanMK3型全自动酶标仪产自美国Thermo Fisher Scientific。
1.2 实验方法
1.2.1 细胞培养:按照上海中科院细胞库提供的方法培养,即在37 ℃、5% CO2的条件下用添加了20%胎牛血清的Iscove's Modified Dulbecco's Medium基础培养基中培养HL-60细胞。HL-60柔红霉素耐药细胞株HL-60/DNR为本实验室构建,采用体外低浓度梯度递增联合大剂量间断冲击方法诱导HL-60细胞对DNR产生耐药性。
1.2.2 实验分组与siRNA转染:设计合成HMGA2的siRNA(si-HMGA2,GGAAAGUGUCUUCAAACAAUU)和阴性对照siRNA(si-NC,UUCUCCGAACGUGUCACGUTT)。将HL-60/DNR细胞分为正常培养组、转染si-NC组和转染si-HMGA2组。按照Lipofectamine RNAiMAX的说明书进行转染。
1.2.3 荧光定量PCR:转染48 h后,收集各组细胞,Trizol法提取总RNA;按照ImProm-IITM Reverse Transcription System的说明进行逆转录;按照SYBR GREEN qPCR Super Mix的说明配制PCR反应体系,CXF96型荧光定量PCR仪上完成荧光定量PCR反应。采用2-△△CT法[6]计算HMGA2 mRNA的相对表达水平。内参基因β-actin和HMGA2的引物序列如下:HMGA2上游引物,ACCTAGGAAATGGCCACAACA;HMGA2下游引物,TATAAGATTGCCCGGGTGGT;β-actin上游引物,AGCGAGCATCCCCCAAAGTT;β-actin下游引物,GGGCACGAAGGCTCATCATT。
1.2.4 Western blot:转染48 h后,收集各组细胞,RIPA裂解液提取细胞总蛋白。蛋白定量后,将定量的蛋白进行SDS-PAGE电泳,并通过半干法将蛋白转至PVDF膜。漂洗后,5%脱脂奶粉溶液室温封闭1 h,HMGA2或者GAPDH一抗稀释液4 ℃孵育过夜。次日,经过TBST洗膜后,加入相应二抗稀释液37 ℃孵育1 h。漂洗后,在暗室中曝光。
1.2.5 CCK8实验:将细胞接种在96孔板,如2.2.2准备正常培养组、转染si-NC组和转染si-HMGA2组HL-60细胞。转染24 h后,使用0、0.1、1、5、7.5和10 μg/mL的DNR处理各组细胞。分别于DNR处理0和24 h后,加入CC8试剂,按照CCK8试剂盒的说明检测450 nm处的吸光值(OD450)。按照如下公式计算抑制率:抑制率=1-(ODDNR-ODBlank)/(OD0μg/mL-ODBlank)。使用GraphPad Prism 7软件计算各组细胞的DNR半抑制浓度(IC50)。
1.2.6 β-半乳糖苷酶活性检测:如2.2.2准备正常培养组、转染si-NC组和转染si-HMGA2组HL-60细胞。转染48 h后,收集各组细胞,按照β-半乳糖苷酶(β-GAL)活性检测试剂盒的说明书检测β-半乳糖苷酶活性。
1.2.7 统计分析:应用SPSS 19.0软件对数据进行统计分析。计量资料以±s表示。多因素方差分析检验细胞增殖活性的差异,单因素方差分析三组之间实验指标的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 HMGA2在HL-60/DNR细胞中高表达:如图1所示,与野生型HL-60相比,HL-60柔红霉素耐药细胞株HL-60/DNR中HMGA2 mRNA和蛋白的表达水平明显提高(P<0.05)。
2.2 成功沉默HL-60/DNR细胞中HMGA2基因表达:如图2所示,cell组和si-NC组HL-60/DNR细胞中HMGA2 mRNA和蛋白的表达水平无明显差异。与si-NC组相比,si-HMGA2组HL-60/DNR细胞中HMGA2 mRNA和蛋白的表达水显著下降(P<0.05),说明转染si-HMGA2可成功沉默HL-60/DNR细胞中HMGA2基因表达。
2.3 沉默HMGA2基因表达增强DNR对HL-60/DNR细胞的敏感性:使用不同浓度的DNR处理cell组、si-NC组和si-HMGA2组HL-60/DNR细胞,并采用CCK8方法检测各组细胞的吸光值,并计算抑制率。如图3所示,DNR对cell组和si-NC组HL-60/DNR细胞的抑制率无明显差异。与si-NC组相比,DNR对si-HMGA2组HL-60/DNR细胞的抑制率显著提高(P<0.05)。另外,DNR对cell组、si-NC组和si-HMGA2组HL-60/DNR细胞的IC50分别为4.46 µg/mL、4.67 µg/mL和0.98 µg/mL,说明。这些结果说明沉默HMGA2基因表达能增强DNR对HL-60/DNR细胞的敏感性。

图1 HL-60和HL-60/DNR细胞中HMGA2 mRNA和蛋白的表达水平。
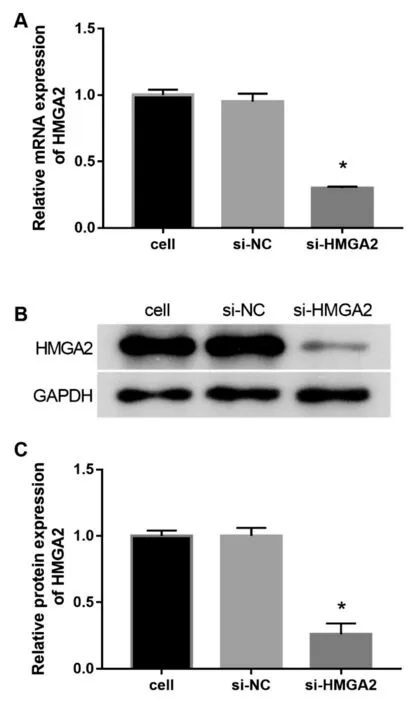
图2 cell组、si-NC组和si-HMGA2组HL-60/DNR细胞中HMGA2 mRNA和蛋白的表达水平。
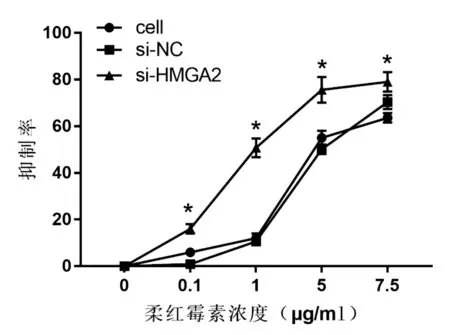
图3 DNR对cell组、si-NC组和si-HMGA2组HL-60/DNR细胞的抑制率。
2.4 沉默HMGA2基因表达增强HL-60/DNR细胞β-半乳糖苷酶活性:如图4所示,cell组和si-NC组的β-半乳糖苷酶活性无明显差异;与si-NC组相比,si-HMGA2组HL-60/DNR细胞的β-半乳糖苷酶活性显著提高(P<0.05)。

图4 cell组、si-NC组和si-HMGA2组HL-60/DNR细胞的β-半乳糖苷酶活性。
3 讨 论
研究发现,HMGA2不仅参与促进肿瘤细胞的增殖和转移,也参与肿瘤耐药的发生。目前认为HMGA2主要通过抑制DNA损伤导致的凋亡和增加肿瘤干细胞的自我更新诱导肿瘤细胞出现耐药性[7-8]。近年来有研究表明肿瘤细胞衰老障碍直接影响化疗效果,也是影响肿瘤多药耐药的一个重要因素[9]。细胞衰老是指细胞在外在微环境变化或内在特定基因表达与失活等因素作用下不可逆地脱离细胞周期并不可逆地丧失增殖能力后进入的一种相对稳定的状态[9]。有研究发现,在原发性淋巴瘤的治疗中,无论凋亡途径是否正常,采用诱导细胞衰老的方法均可以提高化疗效果[10]。Rebbaa研究小组将表达组织蛋白酶L的干扰载体导入淋巴瘤细胞系(HL-60)中,发现该干扰载体可诱导肿瘤细胞发生衰老,逆转对阿霉素的耐药性[11]。那么,在AML发生发展的过程中,HMGA2在AML细胞衰老障碍及逆转化疗耐药中是否发挥作用呐?本文将着重探讨这些问题,拓展HMGA2参与肿瘤耐药的分子机制,评估HMGA2作为逆转AML细胞多药耐药分子靶点的可能性,为提高AML的临床化疗效果提供新的研究方向和理论基础。
我们研究发现,与野生型细胞相比,HMGA2在HL-60/DNR细胞中高表达。结果提示HMGA2可能参与AML多药耐药性的产生。鉴于HMGA2的表达特征及在其他肿瘤细胞耐药性中的作用,我们推测干扰HMGA2基因的表达可能会逆转HL-60/DNR细胞的耐药性。为了验证该推论,我们设计了HMGA2的siRNA序列并转染到HL-60/DNR细胞中以干扰HMGA2基因的表达。结果表明,沉默HMGA2基因的表达可以明显降低HL-60/DNR细胞的IC50,说明沉默HMGA2基因的表达能逆转HL-60/DNR细胞的耐药性。这些结果提示,HMGA2具有作为AML治疗靶点尤其是辅助化疗靶点的潜能。有研究表明,HMGA2增强了5-氟尿嘧啶对结肠癌细胞的耐药性[12]。另外,高表达的HMGA2是预测AML不良预后的独立预测指标[13],且干扰HMGA2能增加野生型AML细胞对DNR的敏感性[5]。这些研究报道可进一步支持我们本文的结论。
另外,我们分析了干扰HMGA2表达对HL-60/DNR细胞衰老的影响。我们发现沉默HMGA2基因表达能增强HL-60/DNR细胞β-半乳糖苷酶活性。β-半乳糖苷酶活性判定细胞衰老水平的重要指标[14]。当细胞衰老时,衰老相关β-半乳糖苷酶活性水平出现上调[14]。因此,我们的实验结果表明,沉默HMGA2基因表达能加速HL-60/DNR细胞的衰老进程。鉴于细胞衰老能进程能增强肿瘤细胞的化疗敏感性,我们推测沉默HMGA2通过加速HL-60/DNR细胞的衰老进程逆转对DNR的耐药性。
总之,我们发现HMGA2在耐药细胞HL-60/DNR中高表达,沉默HMGA2可以逆转HL-60/DNR的DNR耐药性并加速细胞的衰老。
