乙型肝炎肝硬化患者伴或不伴腹水对肠道菌群的影响
2020-07-21栾雨婷蔡文君蒋轼丽赵长青顾宏图袁继丽刘成海慕永平
栾雨婷,蔡文君,蒋轼丽,赵长青,顾宏图,袁继丽,邢 枫,吕 靖,刘成海,刘 平,慕永平
上海中医药大学附属曙光医院,上海中医药大学肝病研究所,教育部肝肾疾病重点实验室,上海市中医临床重点实验室,上海 201203
在我国,60%以上的肝硬化由HBV感染引起[1-2]。近年来,“肠-肝轴”受到广泛关注,人体肠道微生物大约有4万余种,可分为拟杆菌门和厚壁菌门两大类,它们在人体健康和疾病中发挥重要作用[3-4]。目前已明确肠道菌群与酒精性肝病、自身免疫性肝病、慢性乙型肝炎和肝硬化等关系密切,肠道菌群紊乱可促进肝脏疾病的进展[5-7]。
腹水是肝硬化患者最常见的并发症,约50%的患者在诊断后10年内出现腹水。失代偿期肝硬化合并腹水的患者1年和2年生存率分别为60%和45%[8-9]。此外,在肝硬化腹水的住院患者中,自发性细菌性腹膜炎(spontaneous bacterial peritonitis, SBP)的发病率为10%~30%,病死率为30%~50%[10-11]。细菌易位是肝硬化腹水患者发生SBP的关键机制[12-16]。虽然肠道菌群与肝硬化的进展密切相关[17-18],但目前尚不清楚无SBP的乙型肝炎肝硬化(hepatitis B liver cirrhosis, HBLC)伴有腹水患者(HBLC with ascites,HBLC-WA)与乙型肝炎肝硬化无腹水患者(HBLC without ascites, HBLC-WOA)肠道菌群的差异。本研究采用16S rRNA测序技术,比较分析了HBLC-WOA与HBLC-WA(无SBP)患者的肠道菌群特征。
1 资料与方法
1.1 研究对象 收集2016年10月-12月于上海中医药大学附属曙光医院肝硬化科就诊的60例HBLC患者的粪便样本,包括30例HBLC-WOA患者和30例HBLC-WA但无SBP患者。同时还收集了30例健康人群(HC)的粪便样本。
1.2 纳入标准 (1)HBV感染史>6个月;(2)HBsAg阳性;(3)B超、CT、MRI或肝活检诊断为HBLC;(4)接受恩替卡韦治疗且HBV DNA阴性。
1.3 排除标准 (1)伴有SBP者;(2)在过去1个月内接受抗生素、激素、免疫抑制剂或化疗药物者;(3)伴HCV感染、酒精性肝炎、自身免疫性肝炎或其他原因的肝硬化患者;(4)因癌症、肾源性、心源性、结核病或其他原因的腹水患者;(5)有心血管疾病、糖尿病、肠道炎症性疾病、严重基础疾病、精神疾病或其他疾病的患者;(6)目前服用微生物制剂、酸奶或其他益生菌者。
1.4 粪便样本收集和DNA提取 于早晨空腹采集粪便样本(约3 g/人),置于无菌塑料杯中,1 h内转移至-80 ℃冰箱保存,用于细菌基因组DNA提取。
1.5 粪便微生物DNA提取、鉴定以及16S rRNA测序及数据处理 由上海美吉生物医药科技有限公司完成。粪便微生物DNA抽提采用E.Z.N.A.® Stool DNA Kit(Omega Bio-tek, Norcross, GA, USA),DNA浓度和纯度采用NanoDrop 2000UV-Vis分光光度计(Thermo Scientific,Wilmington,DE,USA)测定。DNA质量采用1%琼脂糖凝胶电泳检测。采用热循环PCR系统扩增细菌16S rRNA基因的V3-V4超变区,引物序列为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),获取的PCR产物采用2%琼脂糖凝胶电泳检测,采用AXYGEN公司提供的AxyPrep DNA凝胶回收试剂盒切胶回收,Tris_HCl洗脱,定量,Illumina PE250/PE300测序(每个粪便标本至少完成2万条测序数据),完成生物信息分析。
1.6 临床试验注册 本研究已经在中国临床试验注册网站上注册(注册号:ChiCTR-ROC-16009630)。
1.7 伦理学审查 本研究方案经上海中医大学附属曙光医院医学伦理委员会批准(批号:2016-kykt-07)。所有参与者均知晓有关研究信息,并签署了书面知情同意书。
1.8 统计学方法 统计分析采用R包(V.2.15.3)和SPSS21.0软件。非正态分布的计量资料采用M(P25~P75)表示,2组间比较采用Mann-WhitneyU检验;3组比较采用Kruskal-WallisH检验。计数资料2 组间比较采用Wilcoxon 秩和检验。组间各物种相对丰度差异的比较采用多重假设检验,采用Benjamini 和Hochberg 错误发现率(fdr)进行调整,Pfdr<0.05 为差异有统计学意义。相关分析采用Spearman秩相关检验。不同条件下组间的差异比较采用相似性分析(ANOSIM)和非参数多元方差分析(Adonis)。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料 根据粪便样本质量鉴定结果,最终HBLC-WOA组纳入30例,HBLC-WA组纳入 27例,HC组纳入28例。HBLC患者基线特征见表1。HC组男10例,女18例,平均53(44~58)岁,BMI为23.28(22.37~24.87)kg/m2。
2.2 HBLC患者粪便微生物的总体构成变化 所有85个样本,共生成3 750 652个有效序列进行下游分析,所有样本平均值为439.39 bp。物种丰富度和多样性指数见表2。采用Shannon指数和Simpson指数分析肠道微生物的α多样性,结果表明伴随着腹水的出现,与HC组比较,HBLC-WA组Shannon指数显著下降(P=0.042),提示肠道微生物的多样性下降。ACE和Chao1指数在3组间差异无统计学意义(P>0.05)。主坐标分析(PCoA)显示,HBLC-WOA组、HBLC-WA组与HC组间比较差异有统计学意义(HBLC-WOA vs HC ANOSIM:R=0.159,P=0.001, Adonis:R2=0.067,P=0.001; HBLC-WA vs HC, ANOSIM:R=0.323,P=0.001, Adonis:R2=0.107,P=0.001)(图1)。
2.3 HBLC-WOA和HBLC-WA患者粪便微生物群的特征 为考察粪便样品中微生物的特定菌群的变化,门水平上,分析了占总DNA序列> 0.1% 的菌群相对丰度。结果显示,与HBLC-WOA组和HC组比较,HBLC-WA组变形菌门丰度显著增加(Pfdr值分别<0.01、<0.001)(图 2a~b)。
在属水平上,将总DNA>1%者定义为优势菌属。结果发现,HBLC-WA组硬壁菌门的罕见小球菌属(Subdoligranulum)和假丁弧菌属(Pseudobutyrivibrio)的丰度降低,均显著低于HC组(P值分别<0.01、<0.001)。而变形菌门的肠杆菌属(Enterobacter)和大肠埃希菌属(Escherichia-Shigella),以及硬壁菌门的韦荣球菌属(Veillonella)的丰度均随着腹水的出现而升高,且在HBLC-WA组显著高于HC组(P值分别为<0.05、<0.001、<0.01)(图2c)。
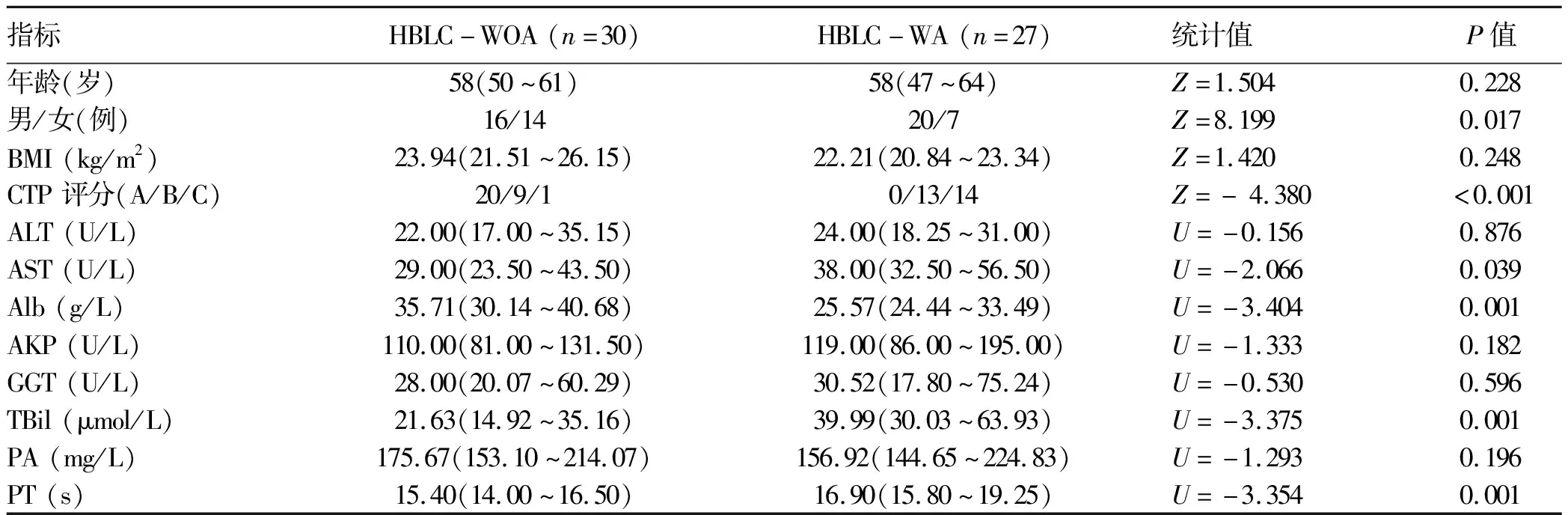
表1 HBLC患者基线特征比较

表2 16S r RNA基因文库的生物种系覆盖和多样性对比
2.4 特定菌属与临床指标之间的相关性分析 采用Spearman秩检验,考察了属水平上10个细菌分类与临床变量之间的关系,结果显示,大肠埃希菌属和韦荣球菌属均与CTP评分(P值均< 0.01)、PT(P值均<0.05)和国际标准化比值(INR)(P值均<0.05)呈正相关,与Alb水平呈负相关(P值分别为<0.001、<0.05)。假丁弧菌、norank_f_毛螺菌科、unclassified_f_毛螺菌科、布劳特氏菌属与Alb水平呈正相关(P值分别为<0.01、<0.05、<0.01、<0.05),与CTP评分(P值分别为<0.001、<0.01、<0.05、<0.05)和CRP(P值分别<0.01、<0.05、<0.05、<0.01)均呈负相关(图3)。
2.5 HBLC-WOA和HBLC-WA患者肠道微生物群功能变化 进一步探讨HBLC患者肠道微生物群的功能改变,使用PICRUSt生物信息软件包预测了粪便微生物群。KEGG(Kyoto Encyclopedia of Genes and Genomes)(level 3)分类显示,随着腹水的出现,与转录相关蛋白、α-亚油酸代谢、金黄色葡萄球菌感染和细菌侵袭上皮细胞等相关通路菌群的丰度逐渐增加(Pfdr值均<0.05),而类黄酮生物合成通路的菌群丰度逐渐降低(Pfdr<0.05)(图4)。
为进一步了解HBLC患者粪便特定菌属的功能,采用Spearman秩相关检验分析了特定菌属与KEGG通路所预测的差异表达之间的相关性。在调整年龄、性别和BMI之后,发现肠杆菌属和大肠埃希菌属与许多疾病有关,而假丁弧菌属和罕见小球菌属与黄酮类生物合成通路相关(r=0.428,r=0.455,P值均<0.001)。尤其是大肠埃希菌属与细菌侵袭上皮细胞通路相关(r=0.891,P<0.001),肠杆菌属与胆汁分泌通路相关(r=1.000,P<0.001)。由于大肠埃希氏菌属和肠杆菌同属肠杆菌科,在OTU水平上进一步研究了这两个属,发现OTU318(0.11%)、OTU434(7.51%)、OTU367(21.49%)和 OTU230(67.18%)在肠杆菌科的序列中占96.29%以上,Spearman秩相关检验表明检验表明,OTU230与细菌侵袭上皮细胞通路呈正相关(r=0.891,P<0.001);OTU434和 OTU367与胆汁分泌通路呈正相关(r=0.676,P<0.001和r=0.773,P<0.001)(图5)。提示肠杆菌科家族参与肝硬化患者细菌侵袭上皮细胞和胆汁分泌通路,可能与HBLC-WA的进展密切相关。
3 讨论
人类肠道的所有微生物统称为“肠道微生物群”。肠道微生物群的改变在HBV相关慢性肝病的发生和进展中发挥重要作用[19]。人类肠道微生物主要由拟杆菌门和变形菌门构成[20],Lu等[21]报道了HBLC患者粪便微生物群的多样性明显降低。并发现,拟杆菌门的比例明显降低,而变形菌门和梭杆菌门的比例在肝硬化患者中高度富集。在科水平上,肠杆菌科、链球菌科和韦荣球菌科的丰度大于HC人群;而乳酸菌科、双歧杆菌科和粪杆菌科则减少[17,22-24]。
本研究结果表明,HBLC患者随着腹水的出现,与HC组和HBLC-WOA组患者相比,HBLC-WA组患者的变形菌门丰度显著增加,提示变形菌门在HBLC-WA患者中可能发挥更重要的作用。
在属水平上,本研究发现与HBLC-WOA组比较,HBLC-WA组中硬壁菌门的罕见小球菌属和假丁弧菌属丰度显著降低,而变形菌门的肠杆菌属和大肠埃希菌属以及硬壁菌门的韦荣球菌属丰度显著增加,提示肠杆菌属、大肠埃希菌属和韦荣球菌属可能对预测HBLC-WA患者SBP的发生具有重要作用。
关于粪便微生物与肝功能的关系,Wei 等[25]报道HBLC患者的CTP评分与拟杆菌门丰度负相关,而与肠杆菌科和韦荣球菌属丰度正相关。本研究中,除了证实HBLC患者的大肠埃希菌属(属肠杆菌科)和韦荣球菌属的丰度与CTP评分正相关之外,还发现它们与PT和 INR正相关,而与Alb水平负相关。并且还发现假丁弧菌与CTP评分负相关,而与Alb水平正相关。提示尽管在HBLC-WA患者没有明确的SBP证据,但肠道微生物群中的潜在致病细菌却已增加,有益菌则明显减少,而HBLC患者肠道内过度生长的特定细菌种群与肝功能障碍的严重程度有关[24,26]。因此,肠道菌群失调可能对肝硬化患者的预后具有重要意义,或至少随着肝脏疾病的进展而演变[17,27]。
肝脏是一个重要的免疫器官,是第一个拦截肠道来源细菌的器官,从而形成一道防火墙以清除循环入侵的细菌[28]。肝硬化患者随着肝功能的恶化,肠壁通透性增加,导致细菌及其产物进入血液并引发全身的炎症反应,这种肠-肝轴紊乱是肝病并发症的病理生理学基础[29]。在原发性胆汁性胆管炎中,上皮细胞细菌侵入通路与肠杆菌科细菌的丰度高度相关[30],而HBLC患者粪便微生物中谷胱甘肽、糖原异生、支链氨基酸、氮和脂质代谢等通路水平上调,但芳香氨基酸、胆汁酸和细胞周期相关通路水平下降[25]。在本研究中,笔者发现HBLC-WA患者肠杆菌科的肠杆菌属和大肠埃希菌属的丰度显著增加。且大肠埃希氏菌属与细菌侵袭上皮细胞通路呈正相关,肠杆菌属与胆汁分泌通路呈正相关。因此,肠杆菌科可能参与HBLC-WA患者的肠道通透性增加和胆汁酸的重吸收,促进肝硬化的进展。
综上所述,肠道微生物群在宿主代谢和免疫调节中发挥重要作用[31],肝脏是与肠道接触最密切的器官,暴露于大量的细菌成分及其代谢物中[32]。HBLC-WA患者肠杆菌属和大肠埃希菌属的丰度显著增加,两者均与临床指标、细菌易位、胆汁代谢显著相关。因此,即使HBLC-WA患者未合并典型的SBP,预防性抗感染治疗可能是需要的。当然,肝硬化程度与肠道菌群异常之间可能相互影响,仍需要进一步的研究。
