橙皮素对仓鼠颈动脉粥样硬化和脂质代谢的作用机制*
2020-07-20覃瑛李晓杰许键炜冯戎周谊霞
覃瑛,李晓杰,许键炜,冯戎,周谊霞**
(1.贵州医科大学 护理学院,贵州 贵阳 550004; 2.贵州医科大学 基础医学院,贵州 贵阳 550004; 3.贵州省人民医院 健康管理体检中心,贵州 贵阳 550004)
心血管疾病(cardiovascular disease,CVD)是造成我国和全球居民疾病死亡的主要原因,预计到2030年,全球CVD死亡人数将达2 500万[1-2]。动脉粥样硬化(atherosclerosis,As)是各类CVD共同的病理基础。生活方式管理是预防和治疗动脉粥样硬化性疾病(atherosclerotic diseases,ASCVD)的基础策略,能够获得最大化的效益成本比,主要包括健康均衡饮食、规律有氧运动、维持正常体质量等[3],饮食摄入是ASCVD管理中的一个关键的可调节因素。多项研究结果显示,植物性饮食可改善ASCVD可控的高血脂、高血压、高血糖等危险因素,具有非常好的心血管保护效应[4-6]。因此,发掘具有调节机体脂质代谢作用的天然植物和明确其发挥作用的天然活性成分、并研究其具体的调控机制已成为近年来的研究重点和热点。橙皮素(hesperetin,HES)是一种天然黄酮类物质,广泛存在于芸香科柑橘属植物果中,研究表明HES具有抗炎、抗氧化、抗病毒及抗肿瘤等多种生物活性[7]。目前,关于HES调节血脂、对As形成的作用等相关研究仅有一些散见报道。Kim等[8-9]先后发现HES能降低高脂血症大鼠和仓鼠模型中的血脂水平;朱小琴等[10]观察到HES对ApoE-/-小鼠颈动脉As模型也具有降脂作用,且能改善As病变;但这些研究均未从分子水平对HES的降血脂机制进行探讨,并且小鼠和大鼠脂代谢机制与人类也有一定的差别[11]。因此,HES对As的作用还有待在拟人化的As动物模型上进一步研究。本研究通过“颈动脉部分结扎加高脂饮食喂养”的方式建立拟人化仓鼠颈动脉As模型,检测HES对仓鼠颈动脉As模型肝脏中低密度脂蛋白受体(low density lipoprotein receptor,LDLR)、3-羟基-3-甲基-戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGCR)及胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)的基因表达水平的影响,探究HES在调控脂质代谢和As形成中的作用,并从分子水平对其调控机制进行分析和阐释,为拓宽对HES健康效益的认识和合理利用提供实验依据。
1 材料与方法
1.1 材料
1.1.1主要试剂和仪器 HES为黄色粉末、纯度为97%(上海麦克林生化科技有限公司,批号C10358475),羧甲基纤维素钠(sodium carboxymethyl cellulose,CMCNa)(北京索莱宝生物科技有限公司,批号C8620),总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒(中生北控生物科技股份有限公司,批号分别为182041、197971、191321、191271),大鼠肿瘤坏死因子α(tumor necrosis factor α,TNF-α)ELISA 试剂盒、大鼠白介素-6(interleukin-6,IL-6)ELISA 试剂盒、大鼠单核细胞趋化蛋-1(monocyte chemotactic protein 1,MCP-1)ELISA 试剂盒(北京四正柏生物科技有限公司,批号均为20200110),总RNA提取试剂、反转录试剂盒、荧光定量聚合酶链式反应(RT-qPCR)试剂盒(北京康润诚业生物科技有限公司,批号分别为P118-05、A224-05、A305-05);小动物手术器械(上海医疗器械有限公司),冷冻离心机(美国Thermo Fisher公司,型号Heraeus Fresco 21),多功能酶标仪(美国Bio-Tek公司,型号ELX800uv),RT-qPCR仪(美国Bio-Rad公司,型号CFX96),石蜡切片机(上海徕卡仪器有限公司,型号RM2016),正置光学显微镜(日本Nikon公司,型号Nikon Eclipse E100),组织研磨器(上海净信实业发展有限公司,型号MY-20)。
1.1.2实验动物与分组 SPF级仓鼠由河北医科大学脂代谢研究室馈赠,许可证编号[SCXK(京)2012-0001],饲养并繁殖于贵州医科大学动物实验中心。实验动物给予清洁自来水和标准饲料喂养,自由进食和饮水,室内环境温度为22~24 ℃、湿度为50%~60%,12 h明暗交替循环(7 ∶00-19 ∶00)。选取30只8周龄雄性仓鼠为研究对象,体质量102.62~128.20 g。研究方案经贵州医科大学动物伦理委员会审核并批准,伦理审查编号1800812。按照简单随机化法,将30只仓鼠随机分为正常对照组(NC组)、颈动脉As模型组(Model组)、HES低剂量组(L-HES组)、HES中剂量组(M-HES组)及HES高剂量组(H-HES组),每组6只。
1.2 方法
1.2.1动物造模及给药 参照文献[12],采用结扎左侧颈总动脉部分分支加高脂饮食喂养方法建立颈动脉As模型。手术操作由固定的2人完成。所有手术器械高压灭菌,铺无菌台巾;仓鼠麻醉后以仰卧位固定头和四肢,颈部皮肤备皮与消毒。做颈部正中切口约2 cm,逐层切开,用显微镊钝性分离左侧颈总动脉、颈内动脉、枕动脉、颈外动脉及其分支甲状腺上动脉;用5~0缝线结扎颈内动脉、枕动脉、颈外动脉,保留甲状腺上动脉。小心将颈部组织复位,逐层缝合皮下组织与皮肤,用碘伏消毒皮肤手术切口;待仓鼠清醒后将其送回动物房饲养。术后1周内每日用碘伏消毒手术切口预防感染;恢复1周后,NC组继续喂饲基础饲料,Model组及HES各剂量组喂饲高脂饲料以建立颈动脉As模型。同时,L-HES组、M-HES组、H-HES组仓鼠分别按50、100、150 mg/kg剂量灌胃给药[10],1次/d、连续干预6周。NC组及Model组给予相同体积的0.5%羧甲基纤维素钠。
1.2.2动物处理及标本收集 实验期间密切观察动物的精神状态、活动、饮水饮食变化及毛发体态变化等行为学情况,每天记录摄食量,每周定时称取体质量。实验第7周结束时,仓鼠过夜禁食不禁水12 h,行内眦静脉丛采血,4 ℃温度下4 000 r/min离心10 min,离心2次,分离血清。麻醉仓鼠后处死,行心脏灌流,取出肝脏,将肝脏剪成约100 mg的小块投入液氮速冻后-80 ℃保存。分离左侧颈总动脉,向下分离至主动脉弓处,向上至颈内颈外动脉分叉处,取出左颈总动脉,置于4% PFA中固定保存,用于病理形态学检测。
1.2.3血脂及血清炎性因子的测定 血清TC、TG、LDL-C、HDL-C和TNF-α、IL-6及MCP-1的测定按相应的试剂盒说明书进行操作。
1.2.4颈动脉病理学观察 将新鲜颈动脉组织迅速放入4%多聚甲醛中固定过夜,经梯度酒精脱水、二甲苯透明、浸蜡、石蜡包埋后,制作厚度为5 μm的石蜡切片。行HE染色后显微镜下观察拍照、分析。
1.2.5肝脏中LDLR、HMGCR和CYP7A1 mRNA表达水平检测 采用RT-qPCR法,称取约100 mg肝脏组织,用TRIGene试剂提取总RNA;根据逆转录试剂盒说明书合成cDNA,使用SYBR green染料法进行RT-qPCR法检测肝脏中LDLR、HMGCR和CYP7A1 mRNA表达水平,反应总体系为20 μL。以GAPDH为内参基因。5′-3′引物序列LDLR-F为TCGCTCTGGTCATCCTCCTTGTC、LDLR-R为GAGTTCGTCTTCCGTGGTCTTCTG,HMGCR-F为AATTGGAGTTGGCACCATGTCAGG、HMGCR-R为ACGAAGTAGTTGGCAAGCACAGAC,CYP7A1-F为CACTTGTTCAAGGCGGCACATAAG、CYP7A1-R为GCGTAGACGTATCAGTTCCGAGAC,GAPDH-F为AAGGCACAGTCAAGGCTGAGAATG、GAPDH-R为CTCCACAACATACTCGGCACCAG。反应条件为:UNG酶处理50 ℃ 5 min,95 ℃预变性2 min,95 ℃变性15 s、60 ℃退火30 s,72 ℃延伸30 s,40个循环。目的基因的mRNA相对表达量用2-ΔΔCt法分析。ΔCt值=Ct目的基因-CtGAPDH; ΔΔCt=ΔCt实验组-ΔCt对照组。
1.3 统计学分析

2 结果
2.1 一般情况、摄食量及体质量变化
除NC组仓鼠外,其余仓鼠均成功实施手术,于术后1~2 h内逐渐苏醒。实验期间,NC组仓鼠精神良好、活动敏捷、毛发柔顺有光泽,Model组仓鼠精神萎靡、不喜活动、毛发凌乱,与Model组相比,各HES剂量组仓鼠上述情况有一定的好转;Model组仓鼠每天摄食量[(6.70±0.02)g]较NC组[(8.51±0.16)g]少(P<0.05),各HES剂量组仓鼠的摄食量与Model组相近(P>0.05)。各组仓鼠基线体质量在同一水平(P>0.05),实验期间各组仓鼠体质量缓慢上升,但各组仓鼠最后体质量比较,差异无统计学意义(P>0.05)。见表1。

表1 各组仓鼠实验期间体质量变化Tab.1 Body weight changes of experimental
2.2 血脂水平
结果显示,HES干预6周后,与NC组比较,Model组仓鼠血清TC、TG、LDL-C及HDL-C水平明显升高(P<0.05);各HES剂量组与Model组相比,血清TC、TG及LDL-C水平明显降低(P<0.05),HDL-C水平比较,差异无统计学意义(P>0.05)。见图1。

注:(1)与NC组相比,P<0.05;(2)与Model组相比,P<0.05。图1 HES对实验仓鼠血脂水平的影响Fig.1 The effect of HES on serum lipid levels of experimental hamsters
2.3 血清炎性因子水平
结果显示,HES干预6周后,与NC组比较,Model组仓鼠血清TNF-α、IL-6及MCP-1含量均明显升高(P<0.05);与Model组比较,L-HES及M-HES组仓鼠血清TNF-α、MCP-1水平明显降低(P<0.05),L-HES组仓鼠血清IL-6水平明显降低(P<0.05)。见图2。
2.4 颈总动脉HE染色
实验结束时劲总动脉组织学结果显示,NC组血管各层结构清晰,内膜无增厚,中膜平滑肌细胞以及弹性纤维走形规则、一致,未见明显异常;Model组血管内膜中膜明显增厚,管腔狭窄,内膜中膜分界欠清晰,中膜血管平滑肌细胞以及弹性纤维排列紊乱,内膜及中膜多见针空状胆固醇结晶形成,局部可见小灶性坏死钙化;L-HES及M-HES组血管各层结构清晰,内膜轻度增厚,管腔狭窄程度较Model组减轻,中膜血管平滑肌细胞肿胀,胞质略疏松,无明显其他异常;H-HES组血管内膜增厚程度高于L-HES及M-HES组,但较Model组明显减轻,管腔狭窄程度明显轻于Model组,内膜中膜可见散在针空状胆固醇结晶形成。见图3。
2.5 肝脏中LDLR、HMGCR和CYP7A1 mRNA表达水平
结果显示,与NC组比较,Model组仓鼠肝脏中LDLR和CYP7A1 mRNA表达水平降低(P<0.05),HMGCRmRNA表达水平升高(P<0.05);与Model组比较,L-HES组及M-HES组LDLRmRNA水平升高,差异有统计学意义(P<0.05),各HES剂量组HMGCRmRNA降低,差异有统计学意义(P<0.05),CYP7A1 mRNA水平升高、且L-HES组表达高于M-HES及H-HES组,差异有统计学意义(P<0.05)。见图4。
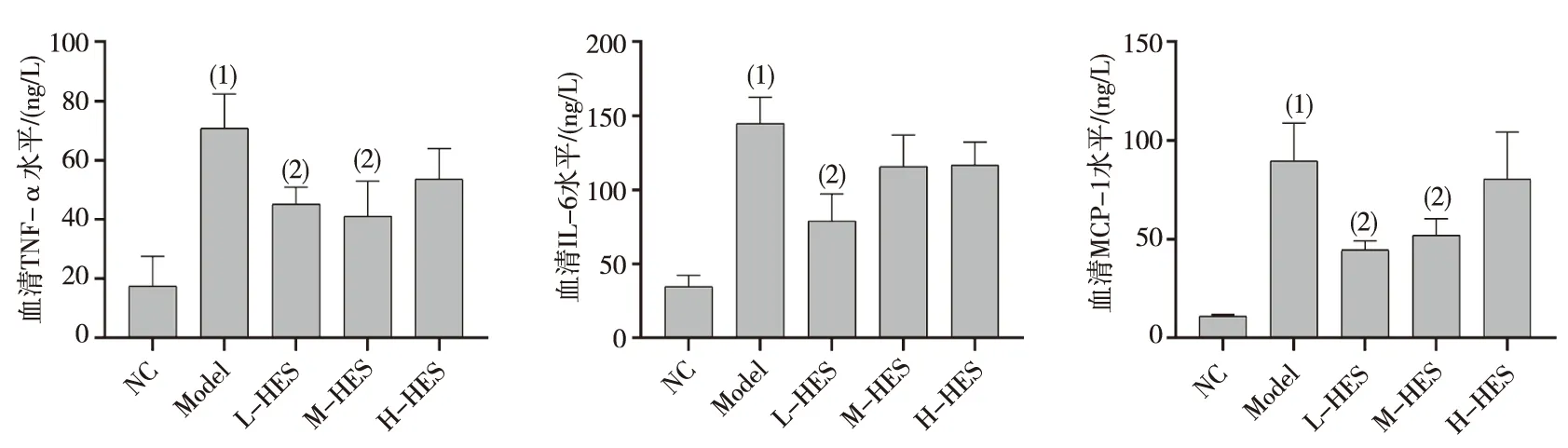
注:(1)与NC组相比,P<0.05;(2)与Model组相比,P<0.05。图2 HES对实验仓鼠血清炎性因子水平的影响Fig.2 The effect of HES on serum inflammatory cytokine levels of experimental hamsters
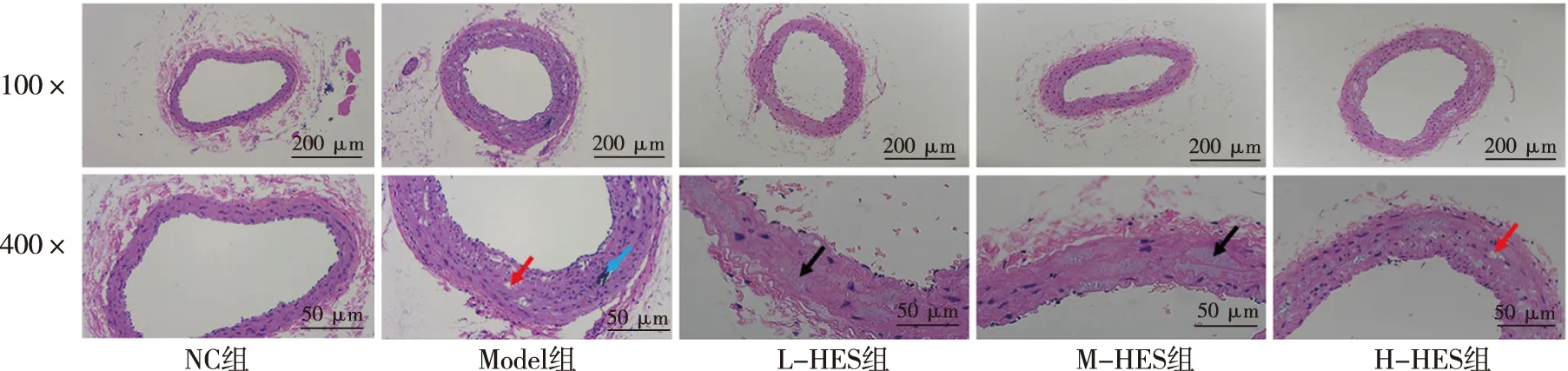
注:蓝色箭头示坏死钙化灶,红色箭头示针空状胆固醇结晶形成,黑色箭头示平滑肌细胞肿胀、胞质疏松。图3 各组仓鼠颈总动脉组织学表现(HE染色)Fig.3 The effect of HES on carotid arteries of experimental hamsters in each group(HE stain)
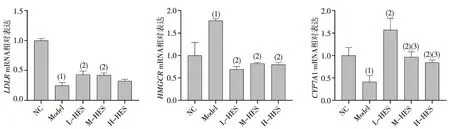
注:(1)与NC组相比,P<0.05;(2)与Model组相比,P<0.05;(3)与L-HES组相比,P<0.05图4 HES对实验仓鼠肝脏中LDLR、HMGCR和CYP7A1 mRNA表达水平的影响Fig.4 The effect of HES on expression levels of hepatic LDLR, HMGCR and CYP7A1 mRNA of experimental hamsters
3 讨论
HES广泛存在于柑橘属植物果实中,来源广泛、获取便利,其药用活性已吸引诸多研究者的关注。本研究通过“颈动脉部分结扎+高脂饮食喂养”的方式建立仓鼠颈动脉As模型,探讨HES对As和脂质代谢的作用,结果表明HES能够有效降低As仓鼠血清TC、TG及LDL-C水平,对HDL-C水平无明显影响;研究还发现HES可上调高脂饮食仓鼠肝脏中脂代谢相关因子LDLR和CYP7A1的基因表达,下调HMGCR的基因表达,从基因转录水平阐释了HES呈现良好降脂效应的机制;同时发现HES可通过调脂及抗炎途径减轻As病变。
As的防治一直是医疗卫生工作中的重点,截至目前,As的发病机制尚未完全阐明。As动物模型是研究As斑块形成及进展的分子机制的重要手段,也是评价新型抗As药物的有力工具。仓鼠的脂代谢机制与人类非常接近,包括高表达胆固醇酯转运蛋白、在小肠而非肝脏编辑肠载脂蛋白B、以低密度脂蛋白为主的血浆脂蛋白谱、低密度脂蛋白受体基因与人类的同源性高、As斑块形成机制及病理特征与人类相似等[13],此外仓鼠还具有繁殖速度快、抵抗力强、方便操作的特点,在脂代谢紊乱的相关疾病研究上极具优势。本研究结果显示仓鼠经高脂饮食喂饲6周后,其TC、TG、LDL-C和HDL-C水平明显上升,与研究报道的人类摄入高脂饮食后血脂的变化情况一致[14],充分说明仓鼠对高脂饮食高度易感且与人类相似。因此,本研究选择仓鼠作为As模式动物有充分的理论依据支撑,为保证研究结论的可靠性奠定了基础。近年来越来越多的研究运用复合因素造模法建立颈动脉As模型[15-16]。本研究尝试以颈动脉部分结扎加高脂饮食喂养的方式建立拟人化的仓鼠颈动脉As模型,HE染色结果显示:Model组仓鼠颈动脉血管内膜中膜明显增厚,管腔明显狭窄,内膜中膜分界欠清晰,中膜血管平滑肌细胞以及弹性纤维排列紊乱,多见针空状胆固醇结晶形成,局部可见小灶性坏死钙化,表明成功制备了颈动脉As模型。与传统的球囊拉伤造成的直接机械性内膜剥脱相比,颈动脉部分结扎通过引起局部血流动力学的改变,间接引起内皮细胞损伤,内膜相对完整,少见血栓发生,引起As的病理改变与人类接近[12];同时,该方法操作简单、可重复性高、实验成本低、成功率高,值得推广应用。
本研究结果表明HES能有效降低血清中TC、LDL-C及TG水平,与相关的研究结果一致[9-10],但以往的研究未对HES调控脂质代谢的分子机制做深入探究。为了充分认识HES的降血脂效应,有必要从分子水平对其调节机制进行分析阐释。肝脏是调节脂质代谢的中枢器官,因此,本研究进一步采用RT-qPCR技术对仓鼠肝脏中调节脂代谢关键的分子的基因表达进行了检测。结果发现,HES干预可上调肝脏中LDLR、CYP7A1的基因表达水平,同时下调HMGCR的基因表达水平。LDLR是一种膜蛋白,可以与血浆中的LDL特异性结合,经过细胞的内吞作用将LDL转运至肝脏内进行降解,是清除血浆中LDL的主要途径[17]。Bawazeer,Morin等[18-19]多个研究者均报道了在人肝癌细胞系HepG2中,HES可增加LDLRmRNA的表达。综合体内体外研究结果可知:HES能通过上调LDLR基因表达发挥降低血浆中LDL-C的作用。HMGCR是胆固醇合成中的限速酶。Kim等[9]发现HES可抑制高胆固醇血症仓鼠肝脏中的HMGCR酶活性,这与本研究的结果相契合,说明HES可通过抑制HMGCR基因表达,减少肝脏中胆固醇的合成,从而降低血脂水平。机体不能将胆固醇彻底分解,胆固醇在肝脏转变为胆汁酸,随胆汁入肠道,这是胆固醇代谢的主要去路,能够排出体内约50%的胆固醇,CYP7A1为胆固醇转化为胆汁酸过程中的限速酶。Ling等[20]发现柑橘皮中的总黄酮类物质可增加高脂血症仓鼠肝脏中CYP7A1的含量,这与本研究的结果是相符的,说明HES能促进胆固醇的转化和排泄,减少胆固醇在体内的蓄积。综上,本课题组认为HES可参与肝脏胆固醇代谢的多条途径,通过影响胆固醇代谢过程中的关键分子的基因表达,呈现良好的降血脂效应。
As是CVD的病理基础,不稳定的As斑块破裂、血小板聚集和血栓形成会导致血管狭窄或阻塞,从而导致急性CVD的发生。脂质浸润和炎症反应是As形成的2个重要环节。大量LDL在血管壁的蓄积在是引发As病变形成的始动环节,炎症贯穿于As斑块形成、发展、斑块破裂、发生血栓性并发症的全过程。TNF-α、IL-6和MCP-1是被广泛认可的反应血管炎症的标志物,因此,许多研究将其作为评价药物发挥抗炎作用的观测指标。本研究结果显示,HES干预能降低仓鼠血清中炎性因子TNF-α、IL-6和MCP-1的含量,表明HES具有较好的抗炎症作用,这与研究报道的HES能抑制心肌梗死小鼠模型和糖尿病大鼠模型中的炎症反应的研究结论相符合[21-22]。体内外研究指出:HES的抗炎作用与抑制NF-κB信号通路有关[23-24],这也是大多数黄酮类化合物发挥抗炎效应的主要机制[25]。迄今为止,理论上As的2大治疗手段分别为干预脂质代谢和炎症反应。如前所述,本研究观察到HES具有良好的降血脂作用和抗炎效应,提示HES具有抗As的潜力。为了明确HES对As形成的作用,本课题组采用HE染色对各组实验仓鼠颈动脉组织的病理学形态进行了观察,结果发现各HES剂量组仓鼠颈动脉中病理改变均得到改善,且L-HES及M-HES的改善效果更为明显,仅有内膜轻度增厚,血管平滑肌肿胀,胞质略疏松,而无明显其他异常,这表明HES具有较好的抗As形成的作用,验证了之前的科学假说。综合现有的研究报道,认为HES具有较好的心血管保护效应。
综上所述,HES具有抗As的潜力,具有较好的抗As形成的作用,也具有较好的心血管保护效应。HES能通过调控肝脏中脂质代谢相关的关键因子的基因表达而发挥降血脂的作用,通过降血脂和抗炎症效应减轻As病变,具有广阔的应用前景。
