凝血因子Ⅱ G20210A、Ⅴ G1691A及Ⅶ R353Q基因多态性与上海汉族人群急性脑梗死的相关性*
2020-07-22岳孟孟于芳苹赵迎春
岳孟孟,于芳苹,赵迎春**
(1.南京医科大学上海松江临床医学院 神经内科,上海 201600; 2.南京医科大学上海松江临床医学院 老年科,上海 201600)
急性脑梗死(acute cerebral infraction,ACI)是由脑组织缺血引起的一系列病理改变及神经功能障碍性疾病[1],目前认为ACI是一种受环境与遗传等多因素共同作用的疾病,凝血与抗凝系统失衡是其发生的重要原因。正常机体凝血与抗凝系统处于动态平衡状态,一旦失衡则可能引起血栓或出血[2]。研究表明,凝血因子Ⅱ(coagulation factor Ⅱ,FⅡ)G20210A多态性可导致血浆凝血酶原水平升高,促进纤维蛋白聚合,加速血栓形成[3];凝血因子Ⅴ(coagulation factor Ⅴ,FⅤ)G1691A突变可导致活化蛋白C抵抗(activated protein C resistance,APCR),APCR患者对活化的凝血因子Ⅴ(activated coagulation factor Ⅴ,FⅤa)的灭活作用减弱,从而导致机体的高凝状态[4];凝血因子Ⅶ(coagulation factor Ⅶ,FⅦ)R353Q在启动外源性凝血途径中起关键作用,FⅦ不仅参与凝血的启动,还参与血管新生、伤口愈合、炎症反应及动脉粥样硬化等过程,FⅦR353Q突变的机体FⅦ水平明显升高,这也是机体高凝状态的原因之一[5-6]。由此看出FⅡG20210A、FⅤG1691A及FⅦR353Q多态性在血栓相关性疾病中起到重要的作用。但由于FⅡG20210A、FⅤG1691A的低突变率与ACI之间的关系仍不明确,FⅦR353Q的Q等位基因突变是保护性因素还是危险性因素也存在争议。因此,本研究采用聚合酶链式反应-限制性片段长度多态性(polymerase chain reaction-ligase detection reaction, PCR-LDR)及多重连接酶检测分型(multiple ligase detection reaction, Multiple LDR)技术分析上海汉族人群ACI人群FⅡG20210A、FⅤG1691A及FⅦR353Q多态性的分布情况,现将结果汇报如下。
1 对象和方法
1.1 对象、主要试剂与仪器
1.1.1研究对象 选取2018年1月—2019年6月神经内科住院的ACI确诊的汉族患者作为ACI组,均行头颅CT和(或)MRI检查、且符合2018年中国急性缺血性脑卒中诊疗指南ACI诊断标准;选取同期健康汉族人群作为对照组,2组研究对象均排除近期有颅脑损伤、肿瘤、手术、自身免疫性疾病及严重心、肝、肾功能不全者。ACI组共纳入患者180例,男性99例、女性81例,平均年龄(71.74±9.63)岁,ACI病因分型(trial of org in acute stroke treatment ,TOAST)分别为大动脉粥样硬化型脑梗死(large-artery atherosclerosis, LAA)、小动脉硬化性脑梗死或腔隙性脑梗死(small-artery occlusion,SAO)及心源性脑梗死(cardioembolism,CE)各有65例、84例及31例;对照组正常人150例,男73例、女77例,平均年龄(70.06±9.17)岁。2组被检者的年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。
1.1.2主要试剂和仪器 脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒(美国Omega),聚合酶链反应(polymerase chain reaction,PCR)引物(上海生工),PCR扩增体系(50 μL)、Marker及Loading buffer(日本宝日),焦碳酸二乙酯(diethy pyrocarbonate,DEPC)水(上海碧云天),琼脂糖(美国AMERSCO),限制性核酸内切酶HindⅢ(restriction endonucleaseHindⅢ,HindⅢ)、限制性核酸内切酶MspⅠ(restriction endonucleaseMspⅠ,MspⅠ)、限制性核酸内切酶MnlⅠ(restriction endonucleaseMnlⅠ,MnlⅠ)及Buffer Tango(美国ThermoFisher Scientific),APCR试剂盒(美国Instrumentation );凝胶成像系统(美国Bio-Rad)。
1.2 方法
1.2.1一般资料收集 收集ACI组和对照组研究对象的临床资料,包括年龄、性别、血糖、收缩压、舒张压、甘油三酯、总胆固醇、高密度脂蛋白、低密度脂蛋白、载脂蛋白A、载脂蛋白B、脂蛋白a、吸烟史、饮酒史、高血压及糖尿病病史。
1.2.2DNA提取 分别抽取ACI组和对照组被检者入院或体检时的清晨空腹外周血2 mL,柠檬酸钠抗凝,离心后下层血细胞用于DNA提取,上层血浆置于-80 ℃冰箱保存备用;使用DNA提取试剂盒提取DNA,具体操作步骤按照说明说严格进行;采用分管光度计法测量DNA提取物的浓度及纯度,并将提取的DNA置于-80 ℃冰箱中保存备用。
1.2.3PCR扩增 引物设计使用Primer5软件,由上海生工生物公司合成(表1)。PCR扩增体系(50 μL):Prime STAR Max Premix(2×) 25 μL ,样本基因组DNA 2 μL(100 ng),上、下游引物各1 μL(10-12moL/L),DEPC水定容至50 μL。PCR反应条件为98 ℃预变性3 min,98 ℃变性10 s,退火10 s,72 ℃延伸1 min,共35个循环,72 ℃末次延伸10 min。取PCR产物10 μL和6×loading buffer 2 μL混合后,进行2%琼脂糖凝胶电泳,应用凝胶成像系统拍照。余PCR产物置于-20 ℃保存。

表1 基因位点引物Tab.1 Gene primer sequences
1.2.4酶切及电泳 取PCR产物10 μL、10×Buffer Tango2 μL、核酸内切酶(FⅡ反应体系加入HindⅢ,FⅤ反应体系加人MnlⅠ,FⅦ反应体系加入MspⅠ) 2 μL,定容至20 μL,置于37 ℃温箱12 h;取酶切产物10 μL和6×loading buffer 2μL混合后,进行2%琼脂糖凝胶电泳,应用凝胶成像系统拍照。
1.2.5多重连接酶检测基因型 PCR产物使用Multiple LDR进行单核苷酸多态性(single neucleotide polymorphisms,SNP)分型,由上海翼和应用生物技术有限公司完成。
1.2.6APCR测定 将保存于-80 ℃冰箱的血浆取出,进行APCR测定,使用APCR试剂盒,结果以活化蛋白C比率(activated protein ratio,APC ratio)表示,通过计算加APC的血浆活化部分促凝血酶原激活(activated partial thromboplastin time,APTT)值与不加APC的血浆APTT值的比值得到,正常范围为2.61~3.32,超出上限为APCR阳性[7]。
1.3 统计学分析

2 结果
2.1 Hardy-Weinberg平衡检验
ACI组与对照组被检者间FⅡG20210A、FⅤG1691A及FⅦR353Q多态性符合Hardy-Weinberg平衡(P>0.05),说明本研究被检者为一遗传平衡群体,具有群体代表性。
2.2 基线资料
ACI组患者的收缩压、血糖水平、高血压病、糖尿病及吸烟比例均高于对照组(P<0.05),但高密度脂蛋白水平低于对照组(P<0.05)。见表2。
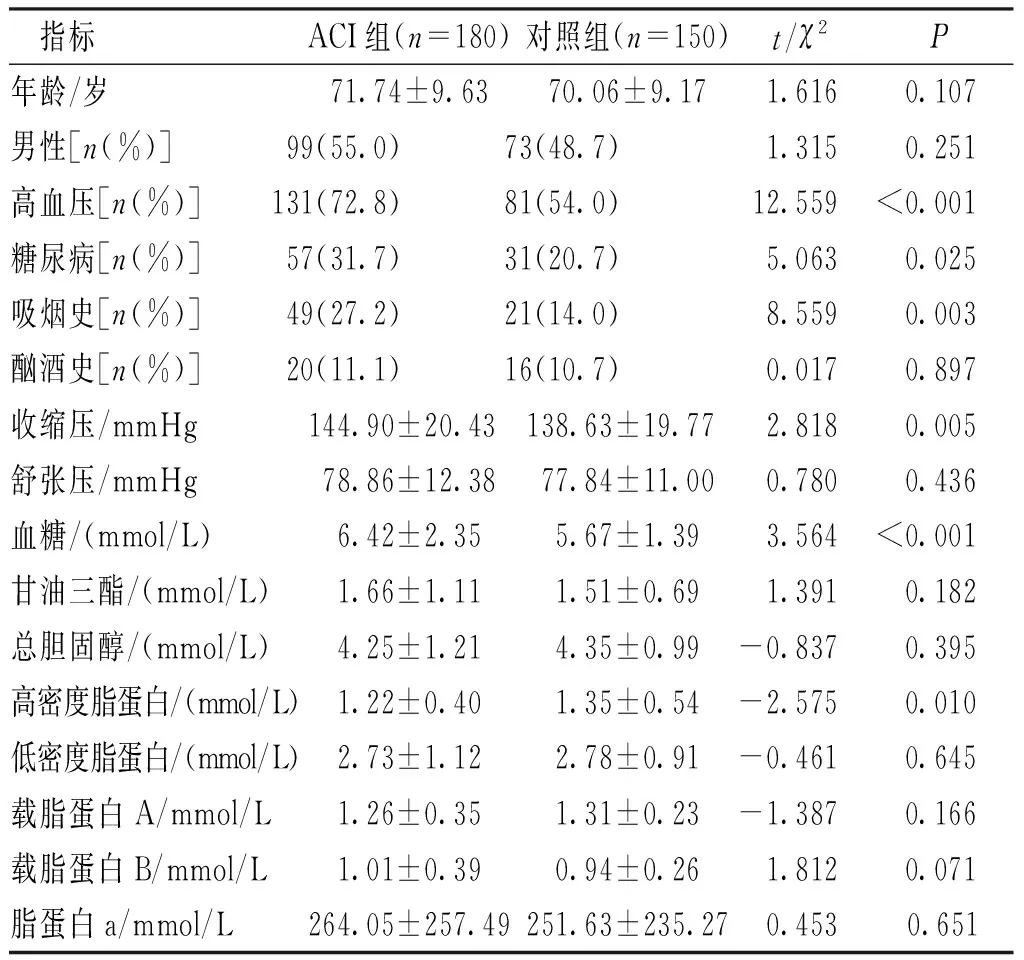
表2 ACI组与对照组研究对象基线资料的对比Tab.2 The comparison of basic data between the ACI group and the control group
2.3 PCR-RFLP及Multi-LDR分型
FⅡ 基因G20210A的PCR产物经过HindⅢ酶切之后,琼脂糖凝胶电泳仅显示一条320 bp的单一条带,提示ACI组和对照组无基因突变(图1A);Multi-LDR结果与PCR-RFLP结果一致,仅检测出单峰GG基因型,G等位基因的LDR产物长度为97 bp(图1B)。FⅤG1691A的PCR产物经过MnlⅠ酶切之后显示2种条带:第1泳道为GA杂合型(353 bp、205 bp和148 bp),第2、3泳道为GG纯合突变型(353 bp),ACI组及对照组研究对象均未检测出AA纯合突变基因型(图2A);Multi-LDR结果与PCR-RFLP结果一致,仅检测出GG与GA基因型,未检测出AA基因型,GG基因型纯合子为单峰,GA基因型杂合子为双峰,等位基因G的LDR产物长度为76 bp,等位基因A的LDR产物长度为74 bp(图2B、2C)。FⅦR353Q的PCR产物经过MspⅠ酶切之后显示3种基因型:第1、2泳道为GA杂合突变型(291 bp、223 bp和68 bp),第3泳道为AA野生型(291 bp),第4泳道为GG纯合突变型(223 bp和68 bp)(图3A);Multi-LDR结果与PCR-RFLP结果一致,RR及QQ基因型纯合子为单峰,RQ基因型杂合子为双峰,等位基因R的LDR产物长度为79 bp,等位基因Q的LDR产物长度为81 bp(图3B、3C及3D)。
2.4 基因频率及等位基因频率
ACI组及对照组研究对象外周血FⅡG20210A未检测到A等位基因的变异,FⅤG1691A仅检测到GA杂合变异型1例;ACI组与对照组相比FⅦR353Q基因型及等位基因频率比较,差异有统计学意义(P<0.05);TOAST分型中SAO组与对照组,比较差异有统计学意义(P<0.05)。见表3。

注:A图为HindⅢ酶切电泳结果,1、2、3及4为GG基因型电泳的泳道;B图为GG基因型LDR结果(sz97.54、ht13143)。图1 FⅡ 基因G20210A的HindⅢ酶切电泳和LDR结果Fig.1 FⅡ G20210A PCR products digested by HindⅢ in agarose gel electrophoresis and LDR
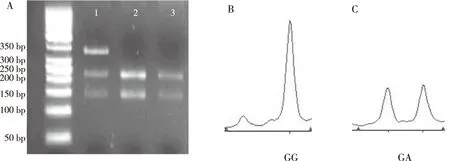
注:A为MnlⅠ酶切电泳结果,1为GA基因型电泳的泳道,2、3为GG基因型电泳的泳道;B图为GG基因型LDR结果(sz76.27、ht13154);C图为GA基因型的LDR结果(sz74.38、ht5973,sz76.32、ht6470)。图2 FⅤ G1691A的MnlⅠ酶切电泳结果LDR结果Fig.2 FⅤ G1691A PCR products digested by MnlⅠ in agarose gel electrophoresis and LDR
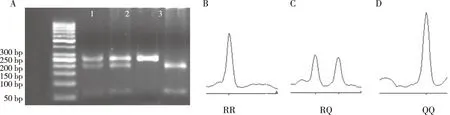
注:A图为MspⅠ酶切电泳结果,1、2为RQ杂合突变型电泳的泳道,3为RR纯合子电泳的泳道,4为QQ纯合突变型电泳的泳道;B图分别为RR基因型的LDR结果(sz79.55、ht10350);C图为RQ基因型的LDR结果(sz79.57、ht6361,sz81.36、ht5907);D图为QQ基因型的LDR结果(sz81.21、ht14916)。图3 FⅦ R353Q的MspⅠ酶切电泳结果Fig.3 FⅦ R353Q PCR products digested by Msp Ⅰ in agarose gel electrophoresis

表3 FⅦ G1691A基因型及等位基因频率比较Tab.3 FⅦ G1691A genotypes and allele frequencies between the ACI group and the control group
2.5 APCR
ACI组患者APCR阳性率高于对照组(P<0.05)。见表4。
2.6 ACI危险因素分析
将ACI组及对照组的多项基本临床资料及实验室检查结果合并,进行二分类赋值,将赋值结果纳入二分类Logistic回归分析中,进行危险因素分析。结果显示,吸烟、高血压、低水平高密度脂蛋白、FⅦR353Q基因型及APCR是ACI的独立危险因素(P<0.05)。见表5。

表4 ACI组及对照组被检者APCR比较Tab.4 The comparison of APCR between the ACI group and the control group

表5 ACI的二分类Logistic回归分析Tab.5 Binary Logistic regression analysis of ACI
3 讨论
FⅡ基因位于11号染色体,G20210A突变是指FⅡ基因3′-非编码区20210位点核苷酸鸟嘌呤(G)突变为腺嘌呤(A),该位点突变可上调血浆中FⅡ增加,从而抑制纤溶过程,促进血栓形成。一项关于缺血性脑卒中各亚型的蛋白标志物的研究发现,纤溶、凝血与凋亡通路与所有亚型的脑梗死显著相关,且FⅡ与纤溶酶原是LAA、SAO及CE等各型脑梗死的关键蛋白,FⅡ与纤溶酶原参与凝血级联反应,血管内皮受损及动脉粥样硬化斑块形成导致血管内凝血级联反应失调,血供减少或者中断,与各种亚型脑梗死的发生密切相关[8]。FⅤG1691A因其可以导致APCR而使机体产生高凝状态,因此FⅤG1691A基因多态性及APCR可能是静脉血栓性疾病的危险因素。研究表明FⅤG1691A也与动脉型缺血性疾病有关,Kita等[9]对野生型、突变杂合子及突变纯合子雄性小鼠进行脑梗死造模,发现与野生型相比,突变的杂合子与纯合子小鼠表现出较大的脑梗死体积与较低的生存率,这可能是由于FⅤG1691A突变导致机体的高凝状态,加重了脑梗死小鼠病灶的缺血再灌注损伤,由此推测,FⅤG1691A可能影响动物脑梗死的进程及其预后。
有研究发现FⅡ G20210A及FⅤ G1691A基因多态性存在地区和种族的差异,白人中的突变率较高,南欧较北欧高,而在亚洲及非洲较低[10]。本研究对ACI组及对照组研究对象基因分型结果显示,2组均未发现FⅡG20210A的突变个体;ACI组患者中发现1例FⅤG1691A的杂合突变个体,也就是说FⅡG20210A及FⅤG1691A在上海汉族人群中的突变率极低。这与以往研究结果相似,Ahmed等[11]对苏丹180名子痫前期患者及180名健康对照者进行检测,结果未检测到FⅡG20210A突变;同样胡雪梅等[12]对中国维吾尔族178位深静脉血栓患者及217位健康对照者进行检测,也未检测到FⅡG20210A的突变,FⅤG1691A突变率为2.18%;郑红等[13]对676例正常中国人及500例正常高加索人进行FⅡG20210A及FⅤG1691A变异检测,发现FⅡG20210A及FⅤG1691A在中国变异率极低(均为为0.07%),高加索人FⅡG20210A突变率为0.60%,FⅤG1691A为2.4%。
Isordia等[14]对墨西哥青年脑梗死患者及对照者进行分析,并未检测出FⅤG1691A突变;Hashemi等[15]研究表明病例组FⅤG1691A杂合突变率为15.1%,对照组杂合突变率为8.3%,均未检出纯合突变型。由于FⅡG20210A及FⅤG1691A的分布差异及其在中国地区的低突变率,仍不能确定它们与脑梗死的关系,但是国外较多研究表明两者与ACI之间存在联系,Coen等[16]研究表明FⅡG20210A与FⅤG1691A基因多态性与ACI风险增加相关;Theythey等[17]也发现FⅡG20210A与LAA相关;Gawish等[18]对沙特阿拉伯72名脑动脉血栓新生儿和70名无血栓栓塞家族史的健康新生儿进行研究,发现FⅡG20210A和FⅤG1691A基因突变可能是沙特新生儿及儿童中风的重要危险因素。
蛋白C系统是人体的抗凝系统之一,它包括蛋白C、蛋白S、内皮细胞蛋白C受体、凝血酶调节蛋白(TM)和FⅤ组成[19]。蛋白C可灭活FⅤa而达到抗凝的作用,APCR是指在某些作用下蛋白C对FⅤa的灭活作用减弱,使机体处于高凝状态,可能与脑梗死相关[7]。本研究对照组健康者APCR阳性率(4.67%)明显低于ACI组(17.22%,P<0.05),与国内其他相关研究相似。研究发现,健康人群的APCR阳性率为3%~7%,但在血栓相关性疾病中高达19%~60%[20-21]。研究发现[22],年轻脑梗死患者(<45岁)约47%存在凝血问题,其中包括APCR、高心磷脂抗体等。本研究中脑梗死组APCR阳性率明显高于对照组,且Logistics回归分析也显示APCR是ACI的独立危险因素(OR=1.250,P=0.013)。
FⅦ基因含有8个内含子和9个外显子,FⅦR353Q突变是指第8位外显子的1个碱基突变,使第353位氨基酸密码子由G变为A,导致氨基酸由精氨酸变成谷氨酰胺[6]。血浆FⅦ水平受遗传与环境的双重影响[23]。研究表明,FⅦ基因型对活化FⅦ(activated coagulation factor,FⅦa)水平总变异的贡献(30%)高于对FⅦ活性(25%)的贡献,也就是说FⅦ基因多态性主要影响FⅦa的水平[6];1994年已有研究表明具有高FⅦ活性的老年人更易患血管疾病[24];动物实验发现FⅦ水平升高的小鼠脑梗死面积更大,这也间接说明了FⅦ的升高会导致更大面积的脑梗死[25];Olson等[26]研究也表明FⅦ是ACI的危险因素,但是也有结果相反的研究,Liu等[27]研究发现FⅦR353Q突变的个体FⅦ水平升高不明显,且FⅦR353Q与血栓性疾病无关。
本研究发现脑梗死组及对照组FⅦR353Q基因型及等位基因频率差异有统计学意义(P<0.05),特别是TOAST分型中的SAO型。早期血管内皮反复受损,组织因子(tissue factor,TF)暴露于血浆,FⅦ常与TF共同作用,TF与血浆中含量极低的FⅦa结合形成复合物TF/FⅦa,而FⅦa又可正反馈活化FⅦ,在Ca2+和磷脂的参与下,激活FⅨ和FⅩ,即启动外源性凝血途径,最终导致纤维蛋白的产生,导致血栓性疾病的发生[28-29]。一项Mate分析研究评估了SAO与非脑梗死及其他TOAST亚型的脑梗死患者的凝血、纤溶、内皮功能障碍及炎症标记物,发现腔隙性脑卒中患者凝血/纤溶指标明显高于非脑卒中患者,纤维蛋白原和D-二聚体在急性和慢性SAO中均显著低于其他类型脑梗死,SAO与非脑卒中的内皮功能障碍标志物较高,与其他ACI亚型相比,SAO患者的血管性血友病因子(von Willebrand Factor,vWF)及IL-6水平明显降低[30]。因此,除了凝血因子多态性,纤溶系统亢进、内皮功能障碍及凝血因子在SAO中也起了重要的作用。
Logistic回归分析显示吸烟、高血压、高密度脂蛋白、APCR及FⅦR353Q基因型是脑梗死的独立危险因素,其Q等位基因可能是ACI的保护性因素,FⅡG20210A及FⅤG1691A基因型因突变例数极少未纳入回归模型。
总之,本研究验证了FⅡG20210A及FⅤG1691A基因多态性在中国汉族地区的低分布,尚不能明确FⅡG20210A与FⅤG1691A基因多态性与ACI之间关系;FⅦR353Q与ACI相关,特别是SAO型,A等位基因可能是ACI的保护性因素,FⅦR353Q与APCR可能是脑梗死的独立危险因素。但由于ACI是多因素疾病,且各因素之间相互作用仍未完全阐明,因此仍需更深入的基础及临床研究探索其发病机制。
