循环肿瘤细胞联合癌胚抗原检测在非小细胞肺癌中的临床价值*
2020-07-20肖牍清吴兆红谭博王戈菲
肖牍清,吴兆红,谭博,王戈菲
(广州医科大学附属第三医院 心胸外科,广东 广州 510000)
肺癌是所有恶性肿瘤中死亡率最高的肿瘤,非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌的80%~85%,由于缺乏特异性标志物,70%NSCLC诊断时处于晚期,5年生存率不足15%[1-3]。在NSCLC中,癌胚抗原(carcinoembryonic antigen,CEA)和细胞角蛋白19片段(cytokeratin-19 fragments,CYFRA21-1 )是最敏感的肿瘤标志物[4-5]。循环肿瘤细胞(circulating tumor cells,CTC)来源于原发肿瘤,可评估肿瘤的发生发展状态,是目前最具潜力的肿瘤标志物之一[6-8]。CTC与CEA均在NSCLC的诊断、分期、治疗及预后方面有一定的作用,但由于其敏感性及特异性的问题,二者在临床中的应用都有一定的局限性[9-10]。研究表明,CYFRA21-1、鳞状上皮细胞抗原(squamous cell carcinoma antigen, SCC-Ag)及CEA等传统肿瘤标志物和“液体活检”[如CTC、循环肿瘤DNA(circulating tumor DNA,ctDNA)等]是NSCLC诊断及监测的重要指标[11-12]。目前,传统肿瘤标志物的联合检测在临床中已有较广泛的应用[13],然而它们与CTC、ctDNA等联合检测的临床应用尚无进一步的研究论证,因此本研究旨在探讨NSCLC患者外周血传统肿瘤标志物CEA和液体活检CTC联合检测的水平变化及临床意义,现将结果报告如下。
1 对象与方法
1.1 对象、主要试剂与仪器
1.1.1研究对象 选取2015年1月—2018年12月病理确诊NSCLC患者54例作为研究组,男43例、女11例,平均(63.4±1.58)岁,肿瘤分期依据国际抗癌协会(union for international cancer control,UICC)提出的临床分期标准[14]Ⅰ~Ⅱ期19例、Ⅲ期14例及Ⅳ期21例,肺腺癌37例、肺鳞癌17例;选取肺部良性疾病患者21例作为对照组,男13例、女8例,平均(62.7±2.16)岁,肺炎18例和肺结核3例。本研究纳入标准:(1)研究组患者经病理首次确诊且未行放化疗,(2)对照组患者经影像学检查或病理排除恶性病变,(3)所有患者及家属同意并自愿参加本研究。排除标准:(1)患者诊断尚不明确,(2)患者既往有放化疗病史,(3)患者有其他系统肿瘤或肝肾功能不全,(4)患者无法配合采集标本和资料。2组患者年龄、性别比较,差异无统计学意义(P>0.05)。本研究通过医院伦理委员会的审批(2017069)。
1.1.2主要试剂与仪器 人体外周血白细胞去除试剂盒[含磷酸缓冲盐溶液(phosphate buffer saline,PBS)缓冲液、鼠抗人上皮细胞黏附分子(epithelial cell adhesion molecule,EPCAM)抗体,批号HCDUB51001]和免疫荧光光原位杂交样品处理试剂盒(含CD45抗体及染色体探针,批号IHIUB51001)购自江苏莱尔生物医药;全自动电化学免疫发光仪与配套CEA检测试剂盒(批号20190917)购自郑州安图生物医药。
1.2 方法
1.2.1免疫磁珠法检测CTC 采用免疫磁珠法[15]分离富集CTC。采集2组患者清晨空腹肘正中静脉血5 mL,静置48 h内离心5 min,弃上清,加裂解液,混匀细胞,离心,弃上清,再次加入裂解液,重复混匀、离心后去上清;PBS洗涤免疫磁珠微粒,按每人份鼠抗人EPCAM抗体200 μL及10 μL加入前期处理好的样本中,充分混匀、孵化30 min,再次冲洗、离心5 min,弃上清,加PBS至500 μL与抗体标记的磁珠20 μL反应20 min。免疫荧光原位杂交(immune fluorescence in situ hybridization,imFISH)检测分析富集后细胞,CD45抗体进行细胞免疫荧光检测,用8号着丝粒探针进行荧光原位杂交;在荧光显微镜下通过双免疫标记对富集细胞做形态学分析。将8号染色体异常扩增信号点>2个、CD45阴性的细胞定义为肿瘤细胞;CTC数量≥2个的研究对象定义为CTC阳性[16]。
1.2.2酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测CEA 采集2组患者清晨空腹血液标本3 mL,ELISA法检测血清CEA水平[17],采用全自动电化学免疫发光仪及原装配套使用试剂盒,严格按照说明书检测患者血清中CEA浓度,血清CEA水平≥5 μg/L定义为CEA阳性[18]。
1.2.3联合检测 CTC与CEA联合检测为并联检测,即有一项检测指标阳性为联合检测阳性[19-20]。
1.3 统计学分析

2 结果
2.1 CTC和CEA单独检测
研究组患者外周血CTC和CEA的阳性率高于对照组,差异均有统计学意义(P<0.05)。见表1。
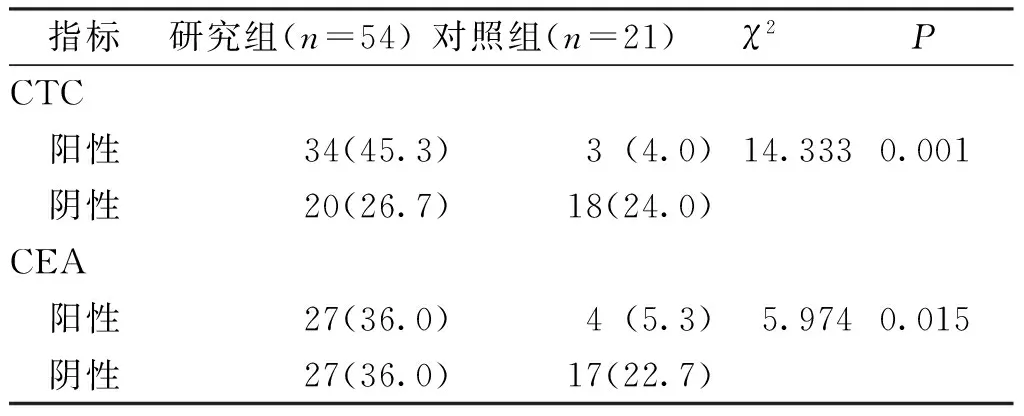
表1 2组患者CTC和CEA的阳性率比较[n(%)]Tab.1 Comparison of the positive rates of CTC and CEA between two groups[n(%)]
2.2 ROC曲线结果
研究组患者ROC曲线结果显示,CTCAUC为0.828,95%可信区间(confidence interval,CI)为0.723~0.905;CEAAUC为0.738,95%CI为0.622~0.831,CTC与CEA联合检测AUC为0.737,95%CI为0.622~0.832。见图1。
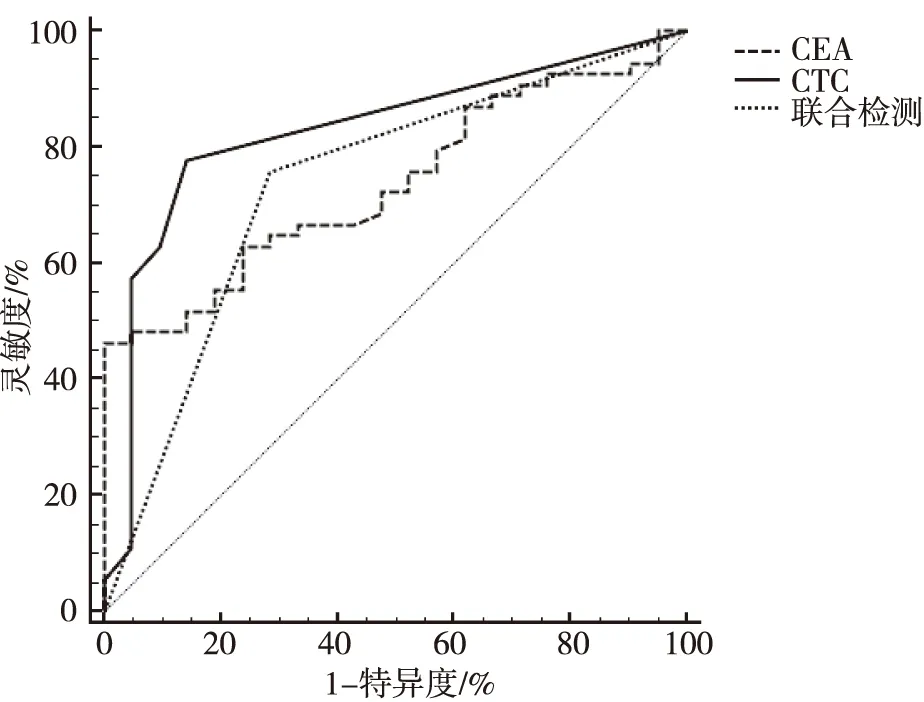
图1 研究组CTC、CEA及联合检测的ROC曲线结果Fig.1 ROC curves of CTC, CEA and combined detection in the research group
2.3 CTC联合CEA检测
研究组患者外周血CTC联合CEA检测的阳性率高于对照组,差异有统计学意义(χ2=6.83,P<0.05);研究组Ⅲ~Ⅳ期患者外周血CTC联合CEA检测的阳性率高于研究组Ⅰ~Ⅱ期,差异有统计学意义(χ2=5.214,P<0.05);研究组Ⅲ~Ⅳ期患者外周血CTC联合CEA检测的阳性率高于对照组,差异有统计学意义(χ2=21.460,P<0.05)。见表2。

表2 CTC与CEA联合检测[n(%)]Tab.2 Combined detection of CTC and CEA [n(%)]
2.4 CTC联合CEA检测和单一检测的比较
研究组Ⅰ~Ⅱ期患者外周血CTC+CEA联合检测阳性率高于对照组,差异有统计学意义(P<0.05)。研究组Ⅰ~Ⅱ期患者外周血CTC、CEA单独检测阳性率与对照组的差异无统计学意义(P>0.05)。见表3。
3 讨论
CTC由Ashworth于1869年首次提出,CTC与NSCLC的诊断、远处转移及预后具有相关性[21-22]。
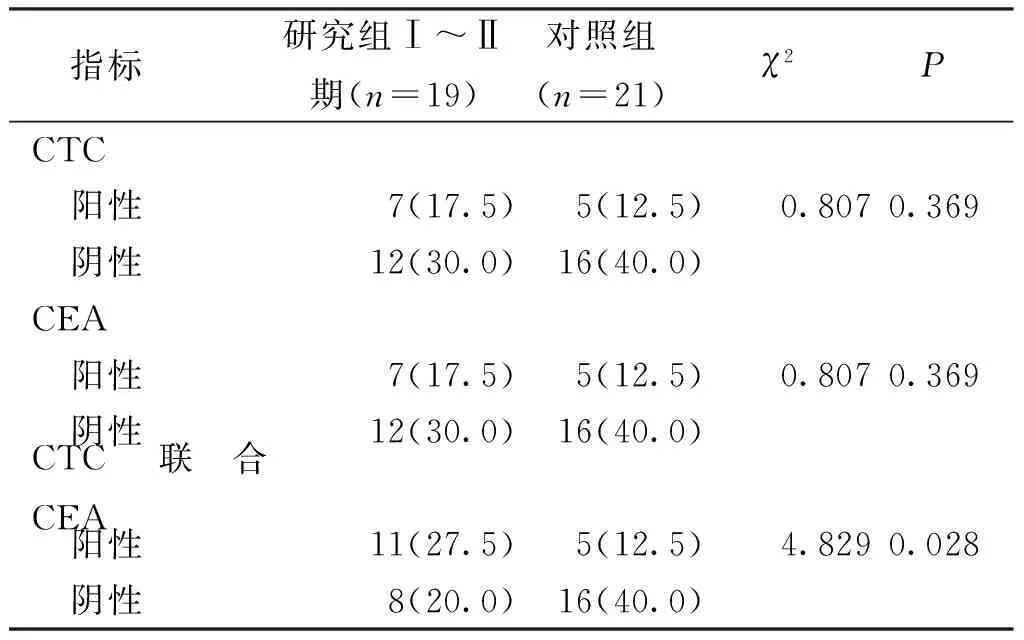
表3 CTC与CEA联合检测和单一检测的比较[n(%)]Tab.3 Comparison of CTC and CEA combined detection and single detection[n(%)]
CEA为目前为NSCLC中应用最为广泛的肿瘤标志物之一,连续监测CEA有助于NSCLC的诊断,评估预后和疗效[23]。本研究结果显示,研究组患者外周血CTC和CEA单独检测阳性率高于对照组(P<0.05),CEA和CTC单独检测可以辅助诊断NSCLC。有研究表明,二者单独检测在临床中的应用有一定的局限性,CTC检测不仅花费昂贵,而且敏感性较低,CTC在NSCLC中的应用有局限,但在肿瘤生物标志物中,CTC与CEA具有相关性[24]。
沈茜等[25]的研究结果显示,将CTC≥2个/mL外周血或血清癌胚抗原(CEA)水平≥5 μg/L作为NSCLC诊断指标时,敏感度为87.5%(119/136),特异度为85.9%(128/149),提示CTC和CEA在NSCLC的诊断中具有重要价值。Zhou等[26]研究也认为CTC与CEA联合检测是在NSCLC中较好的一个预测模型。但目前研究仅分析CTC或CEA单独检测的价值,以及CTC与CEA的相关性,尚未见临床研究探讨联合检测在NSCLC的临床价值。本研究ROC曲线结果显示,研究组患者CTC与CEA联合检测AUC为0.737(95%CI为0.622~0.832),且CTC联合CEA检测的阳性率高于对照组(P<0.05),因此CEA和CTC联合检测也可辅助诊断NSCLC。此外,研究组Ⅲ~Ⅳ期患者联合检测的阳性率分别高于对照组和研究组Ⅰ~Ⅱ期(P<0.05),因此提示CTC与CEA联合检测与NSCLC分期密切相关,晚期NSCLC(Ⅲ~Ⅳ期)患者联合检测的阳性率高于早期NSCLC(Ⅰ~Ⅱ期)患者,临床中可通过联合检测CTC与CEA初步判断患者分期,评估患者预后,指导治疗,提高患者生存质量。另外,研究组Ⅰ~Ⅱ期患者外周血CTC+CEA联合检测阳性率高于对照组(P<0.05),而研究组Ⅰ~Ⅱ期患者外周血CTC、CEA单独检测阳性率与对照组的差异无统计学意义(P>0.05)。因此,早期NSCLC(Ⅰ~Ⅱ期)患者与对照组患者外周血CTC、CEA单独检测的阳性率无差异,CTC、CEA单独检测不能辅助检测早期NSCLC(Ⅰ~Ⅱ期),而早期NSCLC(Ⅰ~Ⅱ期)患者外周血CTC与CEA联合检测阳性率高于对照组,CTC与CEA联合检测较单一检测在临床应用中更具有优势,可以辅助诊断早期NSCLC(Ⅰ~Ⅱ期),为NSCLC患者早期治疗提供依据,改善NSCLC患者的远期预后。
在临床中,因受客观因素的限制,部分病人无法利用金标准来诊断,若仅依靠临床表现及单项指标来诊断,则诊断的准确性较低,而通过几种指标联合检测可提高诊断的准确性[27-28]。CTC、CEA单独检测在NSCLC中的临床研究较为常见[29-30],而CTC与CEA联合检测在NSCLC中的临床价值研究较少。Ding等[31]通过回归分析证实CTC、CEA均为肺腺癌的独立危险因素,检测CTC和CEA水平可作为提高肺腺癌诊断率的一种方法。本研究论证了CTC与CEA联合检测在NSCLC早期诊断中的临床意义,二者联合检测不仅提高了CTC在NSCLC中的应用价值,也为NSCLC高危患者的筛查提供了一种无创、简捷的方法。本研究结果显示,研究组Ⅰ~Ⅱ期患者外周血CTC、CEA单独检测阳性率与对照组无差异(P>0.05),研究组Ⅰ~Ⅱ期患者外周血联合检测的阳性率高于对照组(P<0.05),提示CTC和CEA联合检测在早期NSCLC的诊断中更具有优势。在临床中,依靠肿瘤标记物单一检测诊断早期(Ⅰ~Ⅱ期)NSCLC较困难,通过CTC和CEA联合检测可以辅助诊断早期(Ⅰ~Ⅱ期)NSCLC,必要时可联合影像学结果共同判断,可早期发现NSCLC,早期进行干预,对提高NSCLC患者远期生存质量有重要意义。
本研究存在以下不足,本研究为单中心研究,数据的选择存在一定的偏差;作为回顾性分析,部分患者缺失随访资料,未能进一步做预后生存分析;仅初步探讨CTC与CEA联合检测在NSCLC患者中的临床价值,CTC与CEA、CYFRA21-1及NSE等多种传统肿瘤标志物联合检测在肺癌早期诊断和推测预后的意义则有待进一步论证。
总之,CTC、CEA单独检测及CTC联合CEA检测均可辅助诊断NSCLC,CTC联合CEA检测与NSCLC的分期有关,晚期(Ⅲ~Ⅳ期)NSCLC患者CTC+CEA联合检测较高,CTC联合CEA检测较单一检测更有助于辅助诊断早期(Ⅰ~Ⅱ期)NSCLC。对于NSCLC高危患者,应联合CTC与CEA水平进行评估,早期诊断,明确分期,及早干预,更有利改善患者预后,延长生存期。
