双阳梅花鹿鹿鲜胎多肽的制备及抗氧化活性研究
2020-07-20高晓晨
赵 宇,王 铮,高晓晨,孙 尧,高 冷,*
(1.长春工业大学化学与生命科学学院,吉林长春 130012; 2.长春中医药大学,吉林省人参科学研究院,吉林长春 130117)
双阳梅花鹿是世界首例鹿科动物定型品种,是世界上第一个通过人工培育定型的优良梅花鹿品种[1-2]。鹿鲜胎是指从怀孕母鹿腹中取出的整个子宫,其内包括成型小鹿、胎衣及羊水[3]。据报道,初生仔鹿乳胎的理化性质与胎儿无差异,可通用[4]。鹿胎当前大多应用于我国和东南亚地区[5]。
研究表明,鹿胎中含有丰富的蛋白质、多肽、氨基酸、核酸、维生素等[6-8],其中的多肽类生物活性物质具有增强机体免疫功能、调节机体内分泌、维持机体正常功能、延缓衰老和抗癌等功效,因此鹿胎是一种较为理想的免疫调节剂和营养美容保健品[9-10]。但目前国内外对双阳梅花鹿鹿鲜胎没有深入研究,对其的研究主要集中在作为基础性初级鹿源性药材使用。
本文以双阳梅花鹿鹿鲜胎为原料,采用单因素实验和响应面法优化鹿鲜胎多肽最佳酶解工艺,并通过SDS-PAGE电泳测定鹿鲜胎蛋白分子量分布[11-14],采用超滤法[15-17]和凝胶过滤层析法对酶解产物进行分离纯化,进而对其抗氧化活性进行研究[18-21],为双阳梅花鹿鹿鲜胎今后的产品开发和应用提供理论依据。
1 材料与方法
1.1 材料与仪器
双阳梅花鹿 长春金鹿鹿产品经销公司;SephadexG-50 上海研卉生物科技有限公司;中性蛋白酶(6×104U/g)、碱性蛋白酶(2×105U/g)、胰蛋白酶(250 U/mg)、木瓜蛋白酶(400 U/mg)等其他常规试剂 由北京奥星生物技术有限责任公司提供。
LGJ-30冷冻干燥机 北京松源华兴科技发展有限公司;TGL16M高速冷冻离心机 长沙湘智离心机仪器有限公司;UV-3000PC紫外可见分光光度计 杭州俊升科学器材有限公司;HA221-50-06型超临界萃取装置 江苏华安科研仪器有限公司。
1.2 实验方法
1.2.1 原材料预处理 将鹿鲜胎用生理盐水洗净后去除筋膜、血管,使用生理盐水浸泡去淤血,沥干水分后切成小块、剪碎,与羊水一同采用CO2超临界萃取法进行脱脂,最后将处理过的样品冷冻干燥后打碎。
1.2.2 超声助提法提取鹿鲜胎蛋白 称取50 g预处理后的鹿鲜胎粉置于烧杯中,加入1000 mL去离子水,搅拌均匀后在20 ℃下超声40 min。超声结束后先用滤布进行粗滤,然后在4 ℃下以5000 r/min离心20 min,取上清液浓缩后进行冷冻干燥得到鹿鲜胎蛋白。
1.2.3 鹿鲜胎多肽最佳酶解工艺研究
1.2.3.1 鹿鲜胎多肽蛋白酶的选择 称取10 g鹿鲜胎蛋白样品5份分别置于烧杯中,加入100 mL去离子水,取木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶、复合蛋白酶各4000 U/g,将pH分别调至7、7、10、7.5和7,分别在55、50、50、37和50 ℃下对样品酶解5 h,然后对样品的水解度进行测定。其中复合蛋白酶由水解程度最好的三种单酶按加酶量1∶1∶1复合而成。
1.2.3.2 鹿鲜胎多肽单因素实验 称取10 g鹿鲜胎蛋白样品置于烧杯中,加入200 mL去离子水搅拌均匀,调节pH到7.0加入5000 U/g的复合蛋白酶,分别在40、45、50、55、60 ℃下酶解5 h后,将温度提升至100 ℃加热煮沸10 min,待蛋白酶完全灭活后,静置使其冷却后再放入离心机中3800 r/min离心20 min,取上清液,采用凯氏定氮法和甲醛滴定法测定水解度。
称取10 g鹿鲜胎蛋白样品置于烧杯中,加入200 mL去离子水搅拌均匀,调节pH到7.0加入5000 U/g的复合蛋白酶,在55 ℃下分别酶解1、2、3、4、5 h后,将温度提升至100 ℃加热煮沸10 min,待蛋白酶完全灭活后,静置使其冷却后再放入离心机中3800 r/min离心20 min,取上清液,采用凯氏定氮法和甲醛滴定法测定水解度。
称取10 g鹿鲜胎蛋白样品置于烧杯中,加入200 mL去离子水搅拌均匀,分别调节pH到6、6.5、7.0、7.5、8后加入5000 U/g的复合蛋白酶,在55 ℃下酶解5 h后,将温度提升至100 ℃加热煮沸10 min,待蛋白酶完全灭活后,静置使其冷却后再放入离心机中3800 r/min离心20 min,取上清液,采用凯氏定氮法和甲醛滴定法测定水解度。
称取10 g鹿鲜胎蛋白样品置于烧杯中,加入200 mL去离子水搅拌均匀,调节pH到7.0后,分别加入2000、3000、4000、5000、6000 U/g的复合蛋白酶,在55 ℃下酶解5 h后,将温度提升至100 ℃加热煮沸10 min,待蛋白酶完全灭活后,静置使其冷却后再放入离心机中3800 r/min离心20 min,取上清液,采用凯氏定氮法和甲醛滴定法测定水解度。
1.2.3.3 鹿鲜胎多肽响应面优化 通过单因素实验可以了解到,当酶解时间超过3 h后鹿鲜胎多肽水解度几乎不变,因此利用Design-Expert 8.0.6软件进行响应面优化实验,探究两两因素交互作用时暂不考虑该因素,为确保酶解相对完全,因此默认酶解时间为5 h。通过Design-Expert 8.0.6软件进行响应面优化实验的设计,得到最优的鹿鲜胎多肽酶解工艺。因素与水平编码表如表1所示。

表1 响应面实验因素与水平表Table 1 Factors and levelsTable of response surface experiment
1.2.3.4 水解度测定 甲醛滴定法测定氨基氮含量[22-23],凯氏定氮法[24-25]测定样品中总氮含量,按下列公式计算:

1.2.4 鹿鲜胎蛋白酶解前后分子量测定 称取10 g鹿鲜胎蛋白样品5份分别置于烧杯中,加入100 mL去离子水,分别取木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶、复合蛋白酶适量,在各自最佳酶解条件下对样品酶解5 h,其中复合蛋白酶按本研究所得最佳酶解工艺进行制备,灭酶冷却后再放入离心机中3800 r/min离心20 min,取上清液得到各蛋白酶酶解产物。通过SDS-PAGE电泳对鹿鲜胎蛋白及其酶解产物的分子量分布进行测定。将各样品均配制成1 mg/mL 的溶液,加入上样Buffer后,在100 ℃下煮沸5 min,12000 r/min离心1 min后,再与标准蛋白 Marker溶液分别上样10 μL,分离胶和浓缩胶质量浓度分别为12%和8%。电泳结束后,用考马斯亮蓝 R-250 对凝胶片进行染色,脱色后的凝胶片用电泳自动成像仪拍照。
1.2.5 鹿鲜胎多肽的分离纯化
1.2.5.1 超滤法分离鹿鲜胎多肽 将10 kDa的超滤离心管放入0.2 mol/L NaOH中浸泡1h后用蒸馏水清洗干净,在放入0.2 mol/L HCl中浸泡1 h,用蒸馏水冲洗干净,自然晾干后放入复合蛋白酶酶解产物,放入离心机中,以4000 r/min离心30 min,收集超滤管外溶液,冷冻干燥后备用[26]。
1.2.5.2 凝胶过滤层析法纯化鹿鲜胎多肽 将预处理后的SepHadex G-50葡聚糖凝胶进行装柱,把超滤所得的样品配制成10 g/L的多肽水溶液进行上样,洗脱液为去离子水,洗脱速度为0.5 mL/min[27],紫外检测波长为280 nm,每隔5 min收集各峰组分。
1.2.5.3 分离纯化产物分子量测定 通过SDS-PAGE电泳对分离纯化产物的分子量分布进行测定。将各样品均配制成1 mg/mL的溶液,加入上样Buffer后,在100 ℃下煮沸5 min,12000 r/min离心1 min后,再与标准蛋白Marker溶液分别上样5 μL,分离胶、夹层胶和浓缩胶的制胶体积比为:4∶1.5∶1。电泳结束后,用考马斯亮蓝R-250 对凝胶片进行染色,脱色后的凝胶片用电泳自动成像仪拍照。
1.2.6 鹿鲜胎多肽各组分的体外抗氧化活性研究
1.2.6.1 待测液的制备 按照1.2.4的试验方法制备各蛋白酶酶解液。

1.3 数据处理
每组试验重复3次,试验结果用平均值表示;通过Design-Expert 8.0.6软件进行响应面设计及优化分析;采用Excle绘图;采用SPSS 20.0软件进行数据分析处理。
2 结果与分析
2.1 鹿鲜胎多肽最佳酶解工艺研究
2.1.1 鹿鲜胎多肽蛋白酶的选择 由图1可知,四种单酶对鹿鲜胎蛋白的水解能力依次是:木瓜蛋白酶>中性蛋白酶>胰蛋白酶>碱性蛋白酶,选取前三种单酶按加酶量1∶1∶1的比例进行复合,同时对鹿鲜胎蛋白进行水解,结果表明复合蛋白酶的水解度最高,因此选择复合蛋白酶作为工具酶。

图1 不同蛋白酶对鹿鲜胎蛋白的水解度Fig.1 Degree of hydrolysis of the deer fetus protein by different proteases
2.1.2 酶解工艺单因素实验结果 复合蛋白酶酶解鹿鲜胎蛋白的单因素实验结果如图2所示。由图2A可知,鹿鲜胎蛋白水解度随温度的升高先上升后下降,在55 ℃时水解度达到最高,这可能因为过高的温度会使蛋白酶稳定的分子构象被破坏,导致蛋白酶失活;由图2B可知,水解度随时间的增加先上升后趋于平稳,这可能由于底物浓度一定,反应时间增长,底物浓度减小,反应逐渐终止;由图2C可知,水解度随pH的增大呈现先升后降的趋势,在pH为7时水解度达到最大;由图2D可知,水解度随加酶量的增加先明显上升后呈现略微下降的趋势,这可能由于超过5000 U/g后,酶分子趋于饱和,蛋白酶水解作用相对减弱。

图2 各因素对鹿鲜胎多肽水解度的影响Fig.2 Effects of various factors on polypeptide hydrolysis degree of fresh deer foetus
2.2 酶解工艺响应面优化结果
2.2.1 响应面试验设计结果与方差分析 响应面试验设计及结果如表2所示。根据各项的回归系数建立回归模型,二次多项回归方程为:

表2 鹿鲜胎多肽响应面试验设计及结果Table 2 Experimental design and results of polypeptide response surface for fresh fetus of deer
Y=32.65-0.61A+0.56B+0.35C+0.41AB+0.03AC+0.21BC-2A2-2.5B2-2.15C2
回归模型的方差分析如表3所示,其中回归方程的模型P<0.0001,F=85.59,说明模型差异性极显著;模型失拟性P=0.4417>0.05,说明失拟不显著,这代表未知因素对试验干扰较小;模型决定系数R2=0.9910,调整决定系数RAdj=0.9794,说明该模型能解释97.94%的响应值变化,即变化来源于所取的三个因素,因此回归模型理想,优化条件可靠,可使用该模型对鹿鲜胎蛋白水解度进行预测和分析。由回归方程各项方差分析可知:一次项三个因素A、B、C,二次项A2、B2、C2均对鹿鲜胎蛋白水解度有极显著影响,交互项AB有显著影响(P<0.05),这表明各因素对响应值的影响不只是线性关系,而是复杂的二次关系。

表3 鹿鲜胎多肽响应面方差分析结果Table 3 Results of anova for polypeptide response surface of fresh deer foetus
为进一步分析各因素对响应值的影响,绘制了响应面图如图3所示。响应曲面越陡表示单因素变化时响应值敏感,反之则不敏感;等高线为椭圆形则表示交互作用显著,为圆形则不显著。由图3可知,加酶量与酶解温度之间的交互对响应值影响显著,与方差分析结果一致,方差分析结果虽然显示加酶量与pH和酶解温度与加酶量的交互作用不显著,但由图可知它们的交互作用对响应值也存在一定影响。
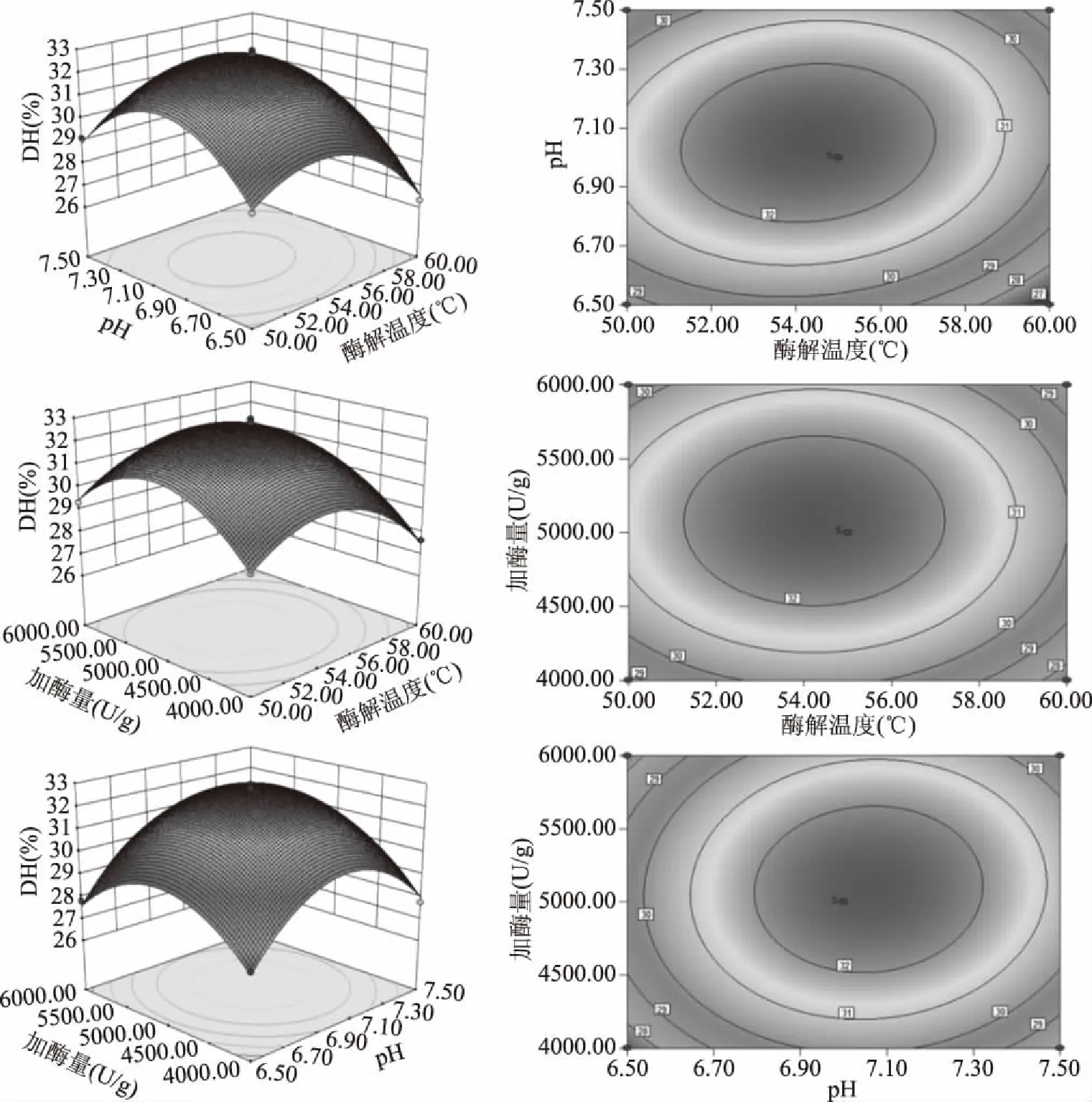
图3 各因素交互作用对水解度的影响Fig.3 Effect of interaction of various factors on hydrolysis degree
2.2.2 鹿鲜胎多肽最佳酶解条件确定及验证 通过Design-Expert 8.0.6软件进行回归分析,得到鹿鲜胎蛋白酶解最优条件为:酶解时间5 h,酶解温度为54.3 ℃,pH为7.05,加酶量为5085.05 U/g,该条件下水解度预测值为34.51%。为方便实际操作将酶解温度设为54.5 ℃,pH设为7.0,加酶量设为5100 U/g,酶解时间为5 h,在此条件下进行3次验证试验,得到水解度平均值为34.97%,理论值与实际值误差不超过0.46%,表明该模型可以用于鹿鲜胎多肽制备的实际生产中。研究水解度较高,可能是由于3种酶进行复合的蛋白酶能够催化分解的基团更多,水解能更强。
2.3 鹿鲜胎多肽分子量分布测定结果
鹿鲜胎多肽分子量分布测定结果如图4所示,泳道2显示未酶解鹿鲜胎蛋白分子量主要集中在72、55和17 kDa,泳道3~7与泳道2相比条带数减少,说明大分子蛋白被降解。其中泳道4条带数最少且条带集中于10~17 kDa,说明复合蛋白酶的效果最佳。

图4 鹿鲜胎多肽SDS-PAGE图谱Fig.4 SDS-PAGE map of fresh deer foetus
2.4 鹿鲜胎多肽分离纯化结果
将鹿鲜胎多肽样品通过SepHadex G-50凝胶过滤层析柱分离后,收集1~200 min的洗脱液,在280波长下测每管的吸光值,结果如图5所示。所收集的洗脱液在280 nm处有三个峰值,将其依次命名为DFP1、DFP2、DFP3,收集各组分冻干待用。分离纯化产物分子量测定如图6所示,三个组分的分子量主要集中在7.8 kDa左右,均在10 kDa以下。

图6 分离纯化产物SDS-PAGE图谱Fig.6 SDS-PAGE map of isolated and purified product注:泳道1:蛋白Maker(3.3~20.1 kDa); 泳道2:DFP3;泳道3:DFP2;泳道4:DFP1。
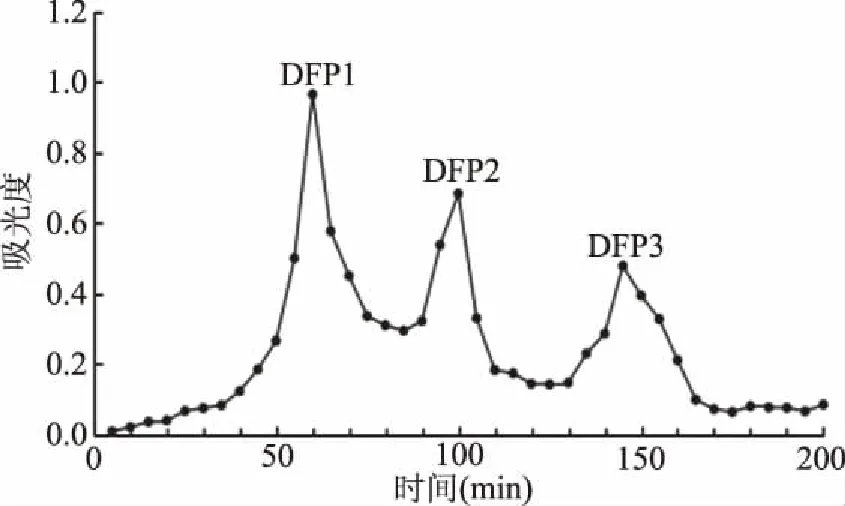
图5 鹿鲜胎多肽的SepHadex G-50柱层析洗脱图谱Fig.5 Eluting map of fresh deer fetal polypeptide by SepHadex G-50 column chromatography
2.5 鹿鲜胎多肽抗氧化活性研究结果

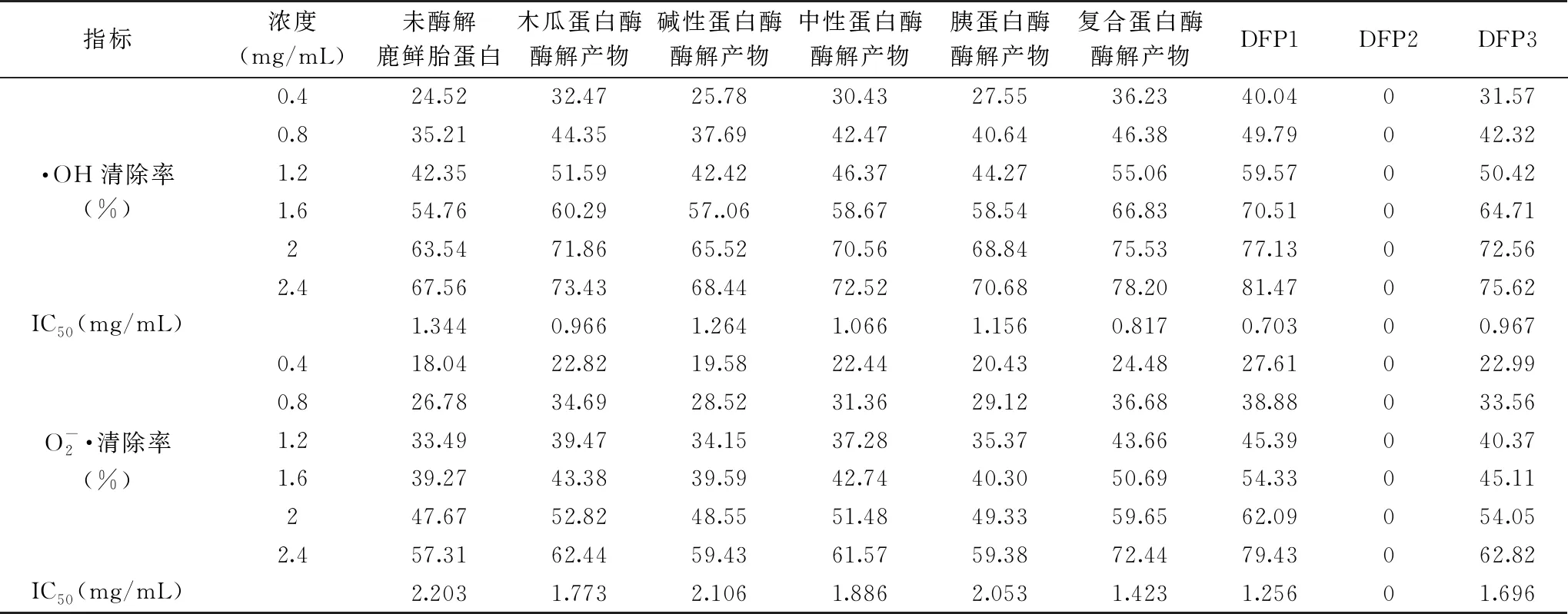
表4 鹿鲜胎多肽各组分的体外抗氧化活性研究Table 4 Study on antioxidant activity of peptides from fresh deer fetal
各组分的自由基清除率均随多肽浓度的增加而升高,根据自由基清除率和IC50值可知,未经分离纯化的6个组分当中,在相同浓度下未酶解鹿鲜胎蛋白抗氧化能力低于其它5组,复合蛋白酶酶解产物抗氧化能力最强,这可能是由于鹿鲜胎蛋白在酶解后产生了其它抗氧化多肽,而复合蛋白酶水解能力最佳,其酶解产物中含有更多的抗氧化多肽;从复合蛋白酶酶解产物中分离纯化所得的3个组分中,DFP2没有抗氧化性,DFP1抗氧化能力>复合蛋白酶酶解产物>DFP3>其它组分,由此可知,双阳梅花鹿鹿鲜胎多肽具有较强的抗氧化性,并且鹿鲜胎多肽的抗氧化能力是由多种多肽共同作用的结果,而不是某个单一多肽的作用,同时得到了分子量更小的具有更强抗氧化能力的多肽组分DFP1,为以后双阳梅花鹿鹿鲜胎抗氧化的应用与开发提供了理论依据。
3 结论

