北虫草多糖提取工艺优化及其细胞氧化损伤保护作用
2020-07-20王迦琦许梦然高婧文葛俊宏
王迦琦,许梦然,高婧文,葛俊宏,孙 新,*
(1.北华大学药学院,吉林吉林 132013; 2.吉林省分子老年重点实验室,北华大学医学院,吉林吉林 132013)
北虫草(Cordycepsmilitaris)又名北冬虫夏草、蛹虫草,属于子囊菌门,麦角菌科,虫草属,是我国传统药用真菌之一,在医药和功能性食品方面均有较高的实用价值[1]。北虫草最初因具备显著增强机体免疫的作用而被人们所熟知,其所含的活性成分已然成为真菌学研究的热点[2]。北虫草多糖(Cordycepsmilitarispolysaccharides,CMP)作为北冬虫夏草主要活性成分之一,主要是由葡萄糖、鼠李糖、半乳糖、甘露糖、木糖等单糖组成[3-4],并具备抗氧化、抗肿瘤、抗炎、降血脂等多种药理活性,其中以抗氧化作用尤为显著[5-8]。
活性氧自由基(ROS)是细胞在正常呼吸和新陈代谢中源源不断产生的一类内源性自由基,是一类非常活跃的电子基团,主要包括H2O2、羟基自由基和超氧阴离子等[9]。ROS在较低浓度时对免疫应答和信号转导等细胞功能调节非常重要,然而当机体受到外界有害因素刺激时,细胞内ROS水平升高,导致抗氧化物的清除能力下降,进而加速氧化DNA、脂质以及蛋白质等生物大分子,从而引发一系列疾病的产生[10-14]。近年来,由氧化应激所导致的冠状动脉粥样硬化、缺血性脑损伤,肺栓塞等血管疾病的发病率逐年增加[15-16]。血管平滑肌细胞在调节血管结构、维持血管张力中起到重要作用[17-18],当其生理功能发生改变时会引起冠状动脉钙化、高血压以及支架内再狭窄等多种细胞病理学病变[19-20],因此从植物中提取天然的“ROS清除剂”,保护血管平滑肌细胞过氧化,对由氧化应激诱导的心血管疾病的发生起到防治作用。过氧化氢(Hydrogen peroxide H2O2)在细胞内会分解成极具破坏性的羟基自由基,使细胞内活性氧水平升高,进而加速细胞氧化损伤进程[21-22]。
现有文献中,对北虫草多糖的提取大多为超声提取法,此法易引起多糖活性成分降低[23],因此本文在水提醇沉法基础上采用四因素三水平正交实验优化北虫草多糖的提取工艺,并通过 H2O2构建大鼠主动脉平滑肌细胞(Rat aortic smooth muscle cells,A10)氧化损伤模型,探讨北虫草多糖的体外抗氧化活性,为北虫草多糖进一步开发利用提供理论依据。
1.材料和方法
1.1 材料与仪器
北虫草 长白山特色植物种植基地;A10细胞 北京中原合聚经贸有限公司;FRAP总抗氧能力检测试剂盒、ROS细胞染色试剂盒 上海碧云天生物科技有限公司;胎牛血清、DMEM细胞培养液 美国Gibco公司;MTT 美国Amresco公司;化学试剂 均为分析纯。
Infinite M200 PRO酶标仪 美国Beckman公司;TH4-200倒置荧光显微镜 日本Olympus公司;TDL-5-R低速离心机 上海安亭科学仪器厂;EZ585型冻干机 美国SIM公司;MCO-18AICUVL-PC二氧化碳培养箱 日本Panasonic公司。
1.2 实验方法
1.2.1 北虫草多糖的提取工艺 将干燥的北虫草粉粹后过40目筛,称重后乙醇脱脂回流处理。选择一定的提取温度,提取次数、提取时间以及料液比,通过水提醇沉法提取北虫草多糖。将水提液浓缩至一定体积后,3000 r/min离心处理滤去多糖残渣,在缓慢滴加4倍体积的无水乙醇至乙醇终浓度为80%,4 ℃静置过夜,4000 r/min离心,弃上清取沉淀依次用无水乙醇、乙醚梯度洗脱后即为北虫草粗多糖。将此粗多糖用蒸馏水配制成5%多糖溶液,放于-80 ℃过夜处理,4000 r/min离心弃沉淀取上清,反复冻融直至无沉淀析出,此法初步去除糖溶液中的蛋白质成分。将此糖溶液按体积比4∶1加入sevage试剂(氯仿∶正丁醇=4∶1)进行混合,剧烈振荡1 h,4000 r/min离心后取上清,中间层为蛋白质,下层为有机试剂层,重复此法直至离心后糖溶液中无变性蛋白质析出为止。并通过3500 Da透析去除糖溶液中无机盐、葡萄糖等小分子杂质,冷冻干燥处理后即为北虫草多糖。根据下式计算北虫草多糖得率。

式中,m多糖为上述提取出的北虫草多糖的质量,g;m北虫草为最初北虫草原材料的质量,g。
1.2.2 单因素提取实验 按照1.2.1所述多糖提取工艺,对提取温度、提取时间、提取次数、料液比4个因素对北虫草多糖得率的影响进行研究。
1.2.2.1 提取温度对北虫草多糖得率的影响 在料液比1∶30 g/mL、提取时间3 h、提取次数3次的条件下,分别设定提取温度60、70、80、90、100 ℃,检测不同提取温度对北虫草多糖得率的影响。
1.2.2.2 提取时间对北虫草多糖得率的影响 在料液比1∶30 g/mL、提取次数3次、提取温度80 ℃的条件下,分别设定提取时间2.0、2.5、3.0、3.5、4.0 h,检测不同提取时间对北虫草多糖得率的影响。
1.2.2.3 提取次数对北虫草多糖得率的影响 在料液比1∶30 g/mL、提取时间3 h、提取温度80 ℃的条件下,分别设定提取次数1、2、3、4、5次,检测不同提取时间对北虫草多糖得率的影响。
1.2.2.4 料液比对北虫草多糖得率的影响 在提取温度80 ℃、提取时间为3 h,提取次数3次条件下,分别设定料液比1∶20、1∶25、1∶30、1∶35、1∶40 g/mL,检测不同料液比对北虫草多糖得率的影响。
1.2.3 L9(34)正交实验优化北虫草多糖提取工艺 考虑水提醇沉过程中料液比、提取温度、提取时间、提取次数各因素的交合作用,对北虫草多糖的工艺参数进一步优化,以单因素实验结果为基础,进行四因素三水平L9(34)正交实验,实验因素设置见表1。
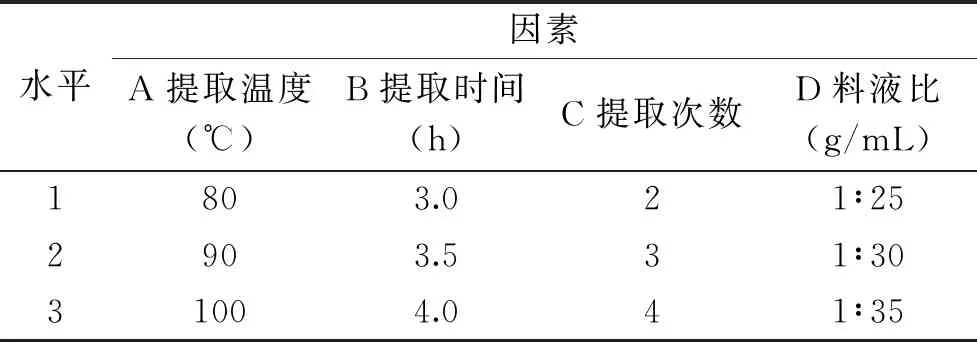
表1 实验因素水平及编码Table 1 Level and coding of experimental factor
1.2.4 羟自由基清除率测定 取0.05、0.1、0.2、0.4、0.8、1.6 mg/mL不同浓度的北虫草多糖(CMP)以及相同浓度下的阳性对照维生素E(VE)对羟基自由基清除率进行测定。步骤如下:实验组于96孔板中依次加入预先配制6 mmol/L的FeSO4、上述浓度下的CMP或VE、6 mmol/L水杨酸以及6 mmol/L 30% H2O2各100 μL;实验对照组依次加入6 mmol/L的FeSO4、蒸馏水、6 mmol/L水杨酸以及6 mmol/L 30% H2O2各100 μL;空白对照组依次加入6 mmol/L的FeSO4、蒸馏水、不同浓度下的CMP或VE以及6 mmol/L 30% H2O2各100 μL。摇床混匀,室温静置30 min后,510 nm处测其吸光度值,根据下式计算CMP和VE的清除率:

式中:A0为水代替CMP或VE测得的吸光度,A1为不同浓度的CMP或VE测得的吸光度,A2为水代替水杨酸时不同CMP或VE所测得的吸光度值。
1.2.5 DPPH自由基清除率测定 取0.05、0.1、0.2、0.4、0.8、1.6 mg/mL不同浓度CMP以及相同浓度下的阳性对照VE对DPPH自由基清除率进行测定。步骤如下:实验组取上述不同浓度的CMP或VE200 μL加入96孔板中,再加入无水乙醇配制2×10-4mol·L-1的DPPH溶液200 μL;实验对照组每孔加入200 μL蒸馏水和不同浓度CMP或VE;空白对照组每孔加入200 μL蒸馏水和200 μL DPPH溶液。摇床混匀10 min后,室温避光处理30 min,517 nm处测其吸光度,根据下式计算CMP和VE的清除率:

式中:A1为不同浓度的CMP或VE加DPPH测得的吸光度,A2为不同浓度的CMP或VE加水测得的吸光度,A0为只加水和DPPH所测得的吸光度值。
1.2.6 FRAP法测定总抗氧化能力 取0.05、0.1、0.2、0.4、0.8、1.6 mg/mL不同浓度CMP以及相同浓度下的阳性对照VE对亚铁离子的还原能力进行检测,测定CMP总抗氧化能力。步骤如下:将100 mmol/L FeSO4·7H2O依次稀释至0.15、0.3、0.6、0.9、1.2、1.5 mmol/L作为标准曲线。实验组于96孔板中每孔加入180 μL FRAP工作液和10 μL上述不同浓度的CMP或VE;实验对照空每孔加180 μL蒸馏水和10 μL CMP或VE;空白对照孔加180 μL FRAP工作液和10 μL蒸馏水;标准曲线孔内加入10 μL 0.15~1.5 mmol/L不同浓度的FeSO4标准溶液。37 ℃避光孵育5 min,于593 nm处测其吸光度值。根据FeSO4标准曲线测定CMP和VE对FRAP铁离子还原能力。
1.2.7 MTT细胞活力测定
1.2.7.1 检测CMP对A10细胞增殖作用的影响 用含有10% FBS的DMEM培养基正常培养A10细胞后,将处于对数生长期的A10细胞接种于96孔板中(3500 cells/孔),依次设置control组(对照组),25、50、100、200、400 μg/mL CMP组(实验组)和空白组,每组5个平行复孔,并将其置于含有5% CO2的恒温培养箱孵育过夜。CMP组分别用上述多糖浓度处理24 h后,每孔加入20 μL MTT(5 mg/mL),置于培养箱孵育4 h后,小心吸取上清,每孔加入150 μL DMSO,摇床混匀后,于490 nm处测定吸光度值。根据下式对细胞存活率进行计算,确定北虫草多糖实验剂量。

式中,A实验组为CMP处理组测得的吸光度值,A对照组为不加CMP所测得的吸光度,A空白组为不加细胞只含DMEM培养基的吸光度。
1.2.7.2 检测 H2O2对A10细胞增殖作用的影响 用含有10% FBS的DMEM培养基正常培养A10细胞后,将处于对数生长期的A10细胞接种于96孔板中(3500 cells/孔),依次设置control组(对照组),100、200、300、400 μmol/L H2O2组(实验组)和空白组,每组5个平行复孔,并将其置于含有5% CO2的恒温培养箱孵育过夜。H2O2组分别用上述浓度处理24 h后,每孔加入20 μL MTT(5 mg/mL),置于培养箱孵育4 h后,小心吸取上清,每孔加入150 μL DMSO,摇床混匀后,于490 nm处测定吸光度值。根据下式对细胞存活率进行计算,确定H2O2实验剂量。

式中,A实验组为H2O2模型组测得的吸光度值,A对照组为不加H2O2所测得的吸光度,A空白组为不加细胞只含DMEM培养基的吸光度。
1.2.7.3 检测 CMP对H2O2处理A10细胞增殖作用的影响 用含有10% FBS的DMDM培养基正常培养A10细胞后,将处于对数生长期的A10细胞接种于96孔板中(3500 cells/孔),依次设置control组(对照组)、H2O2模型组(实验组),CMP给药组(实验组)和空白组,每组5个平行复孔,并将其置于含有5% CO2的恒温培养箱孵育过夜。首先用25、50、100、200 μg/mL CMP预处理A10细胞24 h后,给药组和模型组同时加入4 μL 10 mol/L H2O2(至终浓度为200 μmol/L)处理细胞24 h后,每孔加入20 μL MTT(5 mg/mL),置于培养箱孵育4 h后,小心吸取上清,每孔加入150 μL DMSO,摇床混匀后,于490 nm处测定吸光度值,并根据下式对细胞存活率进行计算。

式中,A实验组为CMP给药组或H2O2模型组测得的吸光度值,A对照组为不加CMP或H2O2所测得的吸光度,A空白组为不加细胞只含DMEM培养基的吸光度。
1.2.8 细胞内活性氧(ROS)染色分析 为了检测CMP是否对H2O2诱导的A10细胞氧化损伤具有保护作用,采用ROS细胞染色法,以DCFH-DA为装载探针,进入细胞后先被酯酶水解成无荧光的DCFH,后进一步被ROS氧化成带绿色荧光的DCF,以此分析细胞内ROS水平,间接反应细胞氧化程度。用含有10% FBS的DMEM培养基正常培养A10细胞后,将处于对数生长期的A10细胞接种于6孔板中(50000 cells/孔),依次设置control组、H2O2模型组和CMP给药组,将其置于含有5% CO2的恒温培养箱孵育过夜。首先用100、200 μg/mL CMP预处理细胞24 h,接着用200 μmol/L H2O2诱导24 h,使用Beytime ROS染色试剂盒评估细胞内活性氧水平,倒置荧光显微镜对染色细胞进行拍摄。
1.3 数据处理
实验结果均为三次平行实验,数据表示为Mean±SD。GraphPad Prism 6软件用于统计计算,ANOVA单因素方差分析用于实验组内比较,P<0.05差异表示有统计学意义。
2 结果与分析
2.1 单因素实验
2.1.1 CMP得率随温度的变化 不同的温度对多糖得率有明显影响。如图1,随温度升高,多糖得率表现为先上升后下降趋势,在提取温度为90 ℃时,多糖得率达到峰值为7.88%。在一定范围内,随温度升高多糖溶质分子溶出速度加快,提取率升高[24]。因此提取温度选取80、90和100 ℃进行正交实验。

图1 提取温度对多糖得率的影响Fig.1 Effect of extract temperature on polysaccharides yield
2.1.2 CMP得率随时间的变化 不同的提取时间对多糖得率有明显影响。如图2所示,提取时间从2.0 h增加到3.0 h时,多糖提取率呈现逐渐上升趋势,由2.45%增加到最大提取率6.32%。随提取时间进一步延长,多糖提取率趋于平缓,因此提取时间选取3.0、3.5和4.0 h进行正交实验。

图2 提取时间对多糖得率的影响Fig.2 Effect of extraction time on polysaccharides yield
2.1.3 CMP得率随次数的变化 不同的提取次数对多糖得率有明显影响。如图3,提取次数由1次增加到3次时,多糖提取率呈现线性上升趋势,多糖得率从2.23%增加到达到最大值6.58%。之后随次数的增加,多糖得率略有下降,这是因为超过一定提取次数后,多糖无法进一步溶解,因此提取次数选取2、3和4次进行正交实验。
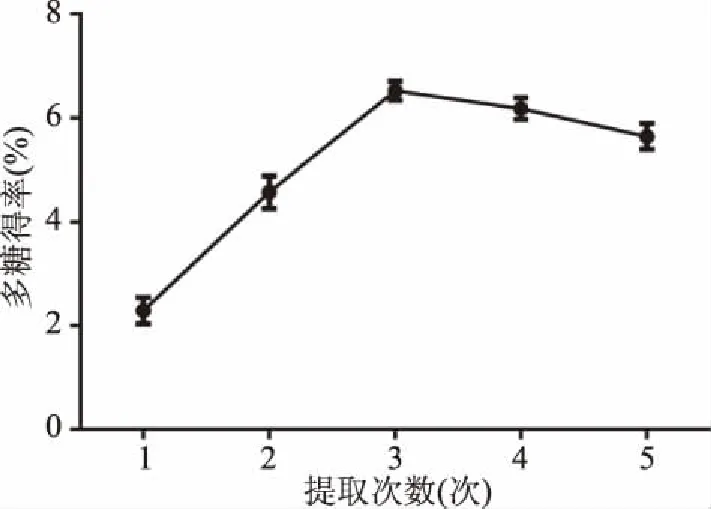
图3 提取次数对多糖得率的影响Fig.3 Effect of extraction times on polysaccharides yield
2.1.4 CMP得率随料液比的变化 不同的料液比对多糖得率有明显影响。如图4,在料液比1∶20~1∶30 g/mL范围内,多糖得率由4.92%增加到6.89%,呈现明显上升趋势,随着料液比进一步增加,多糖得率逐渐呈现下降趋势,可能原因是液体比例的增加影响提取体系的传热功能,不利于多糖成分溶解[25],因此提取时选取1∶25、1∶30和1∶35 g/mL料液比进行正交实验。

图4 料液比对多糖得率的影响Fig.4 Effect of ratio of raw materia to water on polysaccharides yield
2.2 L9(34)正交实验法优化CMP提取工艺
CMP正交实验设计及结果如表2所示,影响CMP得率的主次因素依次是A>D>C>B,即提取温度影响最大,其次是料液比、提取次数和提取时间。多糖得率最优组合为A2B1C2D2,即北虫草多糖得率最佳提取工艺为提取温度90 ℃、料液比1∶30 g/mL、提取次数3次、提取时间3.0 h,在此条件下获得最高多糖得率为7.94%±0.16%。

表2 北虫草多糖正交实验结果Table 2 Orthogonal experiment results of Cordyceps militaris polysaccharide
2.3 CMP抗氧化活性检测
2.3.1 CMP清除羟自由基的能力 如图5所示,CMP和VE在0.05~1.6 mg/mL浓度范围内对羟自由基的清除能力随剂量依赖性增加。在较低浓度0.05 mg/mL时,CMP对羟自由基的清除率为60.61%±1.09%,且呈逐渐上升趋势,相同浓度下VE对羟自由基的清除率仅为37.77%±2.18%;在浓度为1.6 mg/mL时,VE对羟自由基的清除能力上升到60.56%±2.24%,仍显著低于相同浓度下CMP对羟基自由基的清除率75.57%±1.39%(P<0.05)。CMP及VE清除羟自由基的IC50值分别为0.019和0.21 mg/mL,实验结果表明CMP较VE更具显著清除羟基自由基的能力(P<0.05)。
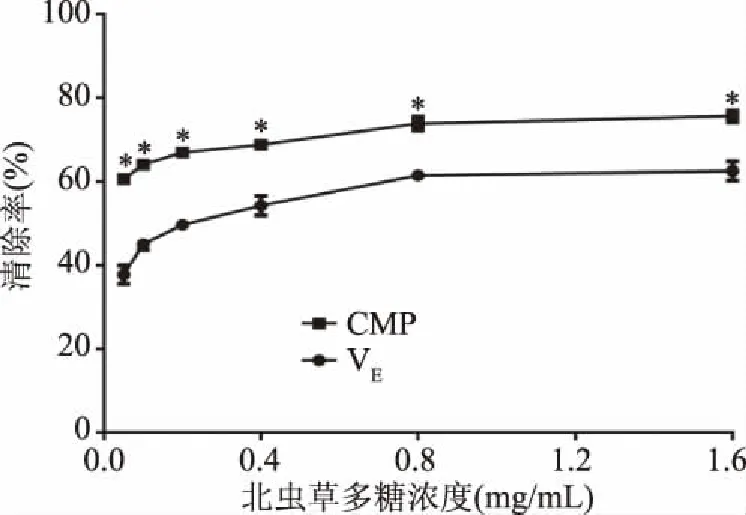
图5 北虫草多糖对羟基自由基清除率的影响Fig.5 Effect of polysaccharides from Cordyceps militaris on the clearance rate of hydroxyl radicals注:与VE组比较,*表示差异显著(P<0.05),图6~图7同。
2.3.2 CMP清除DPPH自由基的能力 如图6所示,在0.05~1.6 mg/mL范围内,CMP和VE对DPPH自由基的清除能力随剂量依赖性增加。在浓度为0.05 mg/mL时,CMP对DPPH自由基的清除率为22.79%±0.59%,VE对DPPH自由基的清除率为20.26%±0.41%,在此浓度时CMP体现出VE相似的自由基清除活性,但随剂量不断增加,在浓度为1.6 mg/mL时CMP对DPPH自由基率为80.23%±2.75%,显著高于相同浓度下VE对DPPH自由基的清除率51.32%±2.48%(P<0.05)。CMP及VE清除DPPH自由基的IC50值分别为0.24和1.13 mg/mL,结果表明CMP较VE更具显著清除DPPH自由基的能力(P<0.05)。
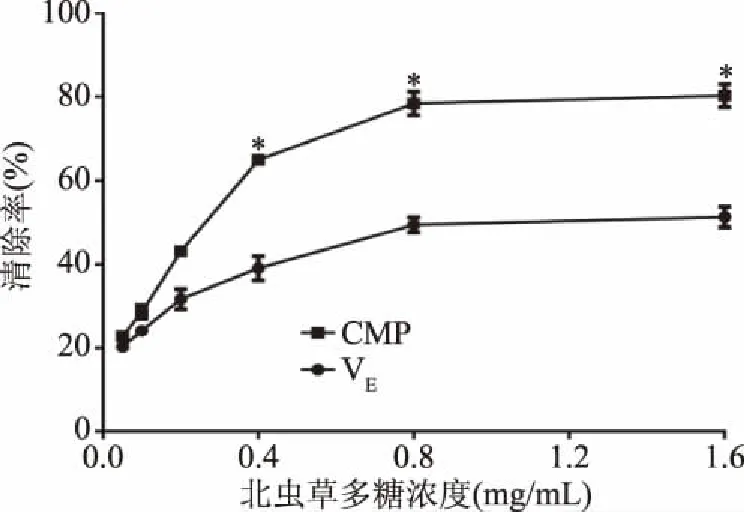
图6 北虫草多糖对DPPH自由基清除率的影响Fig.6 Effect of Cordyceps militaris polysaccharide on DPPH free radical scavenging rate
2.3.3 CMP总抗氧化能力测定 如图7所示,在实验浓度范围内,CMP和VE对FRAP铁离子的还原能力与剂量成正相关。在1.6 mg/mL时,CMP和VE对FRAP铁离子的还原能力分别为(0.22±0.01)和(0.16±0.03) mmol/mg,表明CMP总抗氧化能力显著强于相同浓度下的VE(P<0.05)。

图7 北虫草多糖对FRAP铁离子还原能力的影响Fig.7 Effect of Cordyceps militaris polysaccharide on FRAP iron ion reduction capacity
2.4 CMP对A10细胞氧化损伤的保护作用
2.4.1 CMP对A10细胞增殖的影响 如图8所示,与Control组比较,用25~400 μg/mL不同浓度的CMP处理A10细胞24 h后,均增强细胞活力,促进细胞增殖,且在200 μg/mL时,CMP对A10细胞促增殖作用最强(P<0.001)。

图8 北虫草多糖对A10细胞存活率的影响Fig.8 Effect of CMP on survival rate of A10 cells注:与Control组比较,***差异高度显著(P<0.001);**差异极显著(P<0.01); *差异显著(P<0.05);图9同。
2.4.2 H2O2对A10细胞损伤的作用 如图9所示,加入100~400 μmol/L H2O2处理A10细胞后,H2O2剂量依赖性诱导A10细胞存活率下降,且在浓度为200 μmol/L时,细胞存活率至Control组的61%,这是体外最适的细胞损伤量。因此,本研究选用25~200 μg/mL作为CMP下步实验剂量,200 μmol/L作为H2O2诱导细胞损伤剂量。
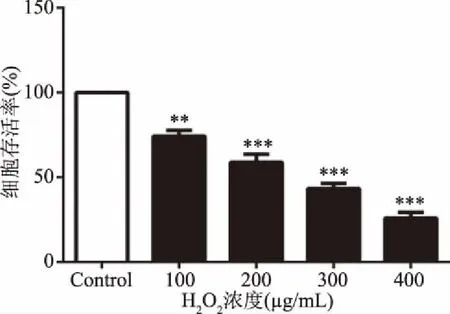
图9 H2O2对A10细胞存活率的影响Fig.9 Effect of H2O2 on survival rate of A10 cells
2.4.3 CMP对H2O2诱导的A10损伤细胞的影响 如图10所示,与Control组相比,H2O2组诱导A10细胞存活率下降;与H2O2组比较,在加入25~200 μg/mL不同浓度CMP多糖预处理后,均促进细胞增殖,增强细胞活力,且在浓度为100~200 μg/mL时,CMP对H2O2诱导的A10细胞损伤保护作用高度显著(P<0.001),因此本研究选择100~200 μg/mL作为CMP后续细胞染色剂量。

图10 CMP对H2O2诱导A10细胞氧化损伤的影响Fig.10 Effect of CMP on A10 cell damage induced by H2O2注:与Control组比较,###差异高度显著(P<0.001); 与H2O2组比较,***差异高度显著(P<0.001),**差异极显著(P<0.01),*差异显著(P<0.05);图11同。
2.4.4 CMP抑制H2O2诱导A10细胞内ROS生成 机体氧化进程加快,与细胞内ROS生成密切相关[26]。如图11所示,A为Control组,细胞内表现为较少的绿色荧光;B为H2O2模型组,细胞内呈现亮绿色荧光,表达高度的ROS水平,与Control组比较具有高度显著性差异(P<0.001,图11E所示);C、D分别为100 μg/mL 和200 μg/mL CMP预处理组,与H2O2组比较,细胞内绿色荧光显著减少,表达低的ROS水平,且以200 μg/mL CMP对H2O2诱导的A10内ROS产生的抑制作用最强。

图11 CMP对H2O2诱导A10细胞中ROS含量的影响(n=3)Fig.11 Effect of CMP on ROS content in A10 cells induced by H2O2(n=3)注:A:Control组细胞内活性氧水平;B:H2O2处理组细胞内活性氧水平;C:100 μg/mL CMP预处理组细胞内活性氧水平; D:200 μg/mL CMP预处理组细胞内活性氧水平;E:三次视野范围下的计算出的阳性染色细胞百分数。
3 结论与讨论
本文通过单因素实验和L9(34)正交实验法优化CMP提取工艺,分析得出料液比、提取温度、提取时间和次数四个因素及其相互作用对CMP得率的影响,并获得多糖最佳提取参数为:提取温度90 ℃,料液比1∶30 g/mL,提取次数3次,提取时间3.0 h,在此条件下多糖最高得率为7.94%±0.16%。
本研究发现CMP具有明显增强A10细胞活力,促进细胞增殖的作用,并成功构建H2O2诱导A10细胞损伤模型,进一步阐述CMP可以保护由H2O2所引起的细胞活力降低、存活率下降等细胞损伤表征,具有天然维持细胞正常功能及活性的作用。细胞内ROS产生过多,会加速心血管疾病的发生,因此本研究继续通过ROS细胞染色实验评估CMP对H2O2诱导A10细胞中ROS含量的影响,结果表明在用200 μmol/L H2O2处理细胞24 h后细胞内ROS水平约为正常对照组的26.67倍,证实H2O2诱导A10细胞存活率降低是由于H2O2引起的氧化应激所导致的A10细胞损伤,活力下降,而在加入CMP预处理后ROS含量显著降低。因此,CMP可以保护A10细胞免受H2O2所引起的氧化应激,对于维持血管正常功能,减轻血管疾病的发生发展具有重大意义。
H2O2在细胞内主要通过损伤DNA和改变蛋白质结构加速细胞氧化进程[27-29]。文献表明p53基因具有修复DNA损伤、抑制血管生成作用[30-32]。因此,后续研究将接着从p53-p21信号通路入手,深入研究CMP对血管平滑肌细胞氧化损伤的保护作用机制,为天然中药材北虫草的开发和利用提供新的研究方向。
