鸿雁雁血多肽的制备及免疫调节作用的初步研究
2020-07-20高晓晨崔本海
王 铮,赵 宇,高晓晨,孙 尧,崔本海,高 冷,*
(1.长春工业大学化学与生命科学学院,吉林长春 130012; 2.长春中医药大学吉林省人参科学研究院,吉林长春 130012; 3.通榆县向海崔成大雁养殖有限公司,吉林白城 137200)
鸿雁(Ansercygnoides)属鸟纲鸭科[1]。雁血可作药用,据《本草纲目》、《日华本草》、《千金食治》、《随息居饮食谱》等十多部药典、食谱记载,雁血能大补五脏,养阴益气,暖胃开津,强身健体,并且对增强机体免疫力、防癌、防“三高”等具有特殊医疗功效。
我国鸿雁人工养殖场日益增加,雁血资源丰富。血液作为肉制品行业中最大的副产品,在保存与加工方面仍存在一定困难[2],目前的应用仅限于简单制成血制品食用,或用作饲料,大部分的血液作为废料被丢弃[3],利用率极低,这样既会对环境造成污染,又会浪费了宝贵的雁血资源[4]。免疫系统是疾病防御的第一道防线,如今人们的不健康生活方式导致自身免疫力下降从而引发各类疾病[5],人们可以通过食用免疫活性肽来提高自身免疫力,且无毒副作用[6]。现阶段我国对雁血的研究甚少,因此对鸿雁血的特医性食品研究及开发具有重要意义。
本研究以向海鸿雁的新鲜血液为原料,采用生物酶解技术提取新鲜雁血中的有效成分,确定最佳酶解条件,并对有效成分进行分离纯化。采用SDS-PAGE电泳技术测得酶解后有效成分的分子量分布情况。本研究拟通过研究雁血多肽对小鼠脾淋巴细胞体外增殖及对IL-2、INF-γ与PGE2分泌量的影响,初步探究雁血多肽的免疫调节作用,为今后雁产品的开发及应用提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜鸿雁血 吉林省白城市通榆县向海崔成大雁养殖有限公司提供;清洁级小鼠(60只,雌雄各半),体质量18~22 g 吉林大学实验动物中心提供(许可号:SYXK(吉)2016-0001);SephadexG-50 上海研卉生物科技有限公司;RPMI-1640培养基、胎牛血清 上海联硕生物科技有限公司;白细胞介素2(interleukin-2,IL-2)ELISA检测试剂盒、干扰素γ(interferon-gamma,IFN-γ)ELISA检测试剂盒、前列腺素E2(prostaglandin E2,PGE2)ELISA检测试剂盒 上海晶抗生物工程有限公司;木瓜蛋白酶(400 U/mg)、中性蛋白酶(60000 U/g)、碱性蛋白酶(200000 U/g)、复合蛋白酶(400 U/mg) 苏柯汉(涨潍坊)生物工程有限公司;实验所有试剂 均为分析纯。
LQZ-211型落地式全温振荡器 上海精宏实验设备有限公司;LGJ-30冷冻干燥机 北京松源华兴科技发展有限公司;UV-3000PC紫外可见分光光度计 杭州俊升科学器材有限公司;TGL16M高速冷冻离心机 长沙湘智离心机仪器有限公司;PH-050A型恒温培养箱 上海一恒科学仪器有限公司;ReadMax1900型光吸收全波长酶标仪 上海闪谱生物科技有限公司。
1.2 实验方法
1.2.1 雁血多肽的酶解工艺研究
1.2.1.1 原料预处理 取新鲜鸿雁血2 L,加0.1%的柠檬酸三钠抗凝,5000 r/min离心30 min,超声2 h破膜,5000 r/min离心15 min,冷冻干燥得到雁血蛋白。
1.2.1.2 酶解工艺流程 雁血蛋白→蛋白酶酶解→灭酶→离心→冷冻干燥→雁血多肽
将20 g雁血蛋白溶于200 mL去离子水中,称取一定的蛋白酶,在一定的温度和pH下酶解一定的时间。酶解结束后,灭酶10 min,静置冷却,5000 r/min离心15 min,取上清液,冷冻干燥,以备后续实验使用。
1.2.1.3 雁血多肽的蛋白酶选择 首先选用中性蛋白酶(60000 U/g)、碱性蛋白酶(200000 U/g)、木瓜蛋白酶(400 U/mg)和复合蛋白酶(以上三种蛋白酶按1∶1∶1的酶活比例组成),在每一种蛋白酶的最佳酶解条件下,利用凯氏定氮法和甲醛滴定法测定水解度[7]。
1.2.1.4 雁血多肽单因素实验 称取20 g雁血蛋白5份分别置于烧杯中,加入200 mL去离子水,调节pH到7后加入4000 U/g的复合蛋白酶,分别在30、40、50、60、70 ℃下酶解5 h后,将温度升至100 ℃灭酶10 min,完全冷却后以5000 r/min离心15 min,取上清液,采用凯氏定氮法和甲醛滴定法测定水解度。
称取20 g雁血蛋白5份分别置于烧杯中,加入200 mL去离子水,分别调节pH到6、7、8、9、10后加入4000 U/g的复合蛋白酶,在50 ℃下酶解5 h后,将温度升至100 ℃灭酶10 min,完全冷却后以5000 r/min离心15 min,取上清液,采用凯氏定氮法和甲醛滴定法测定水解度。
称取20 g雁血蛋白5份分别置于烧杯中,加入200 mL去离子水,调节pH到7后,分别加入2000、3000、4000、5000、6000 U/g的复合蛋白酶,在50 ℃下酶解5 h后,将温度升至100 ℃灭酶10 min,完全冷却后以5000 r/min离心15 min,取上清液,采用凯氏定氮法和甲醛滴定法测定水解度。
称取20 g雁血蛋白5份分别置于烧杯中,加入200 mL去离子水,调节pH到7后加入4000 U/g的复合蛋白酶,在50 ℃下分别酶解3、4、5、6、7 h后,将温度升至100 ℃灭酶10 min,完全冷却后以5000 r/min离心15 min,取上清液,采用凯氏定氮法和甲醛滴定法测定水解度[8]。
1.2.1.5 雁血多肽响应面优化 选取影响水解度的三个因素分别为酶解温度、pH、加酶量[9]。采用3因素3水平响应面试验,因素与水平编码见表1。
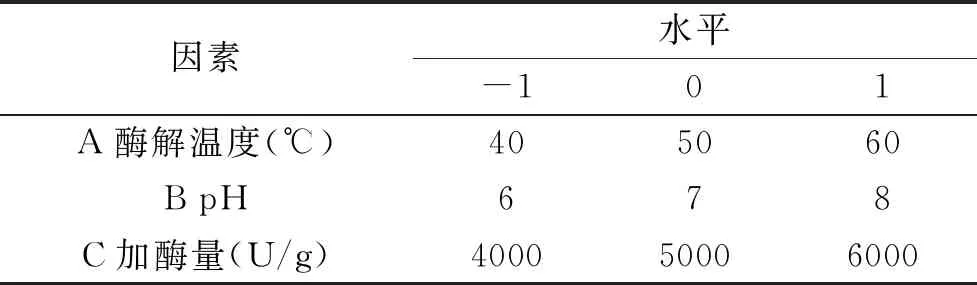
表1 响应面试验因素水平Table 1 Factors and levels of response surface experiment
1.2.1.6 水解度测定 甲醛滴定法测定氨基氮含量[10],凯氏定氮法测定样品中总氮含量[11],按下列公式计算:

1.2.2 雁血蛋白酶解前后的分子量分布测定 配制12%分离胶和5%浓缩胶。取1 mg样品置于1 mL蒸馏水中,取20 μL样品溶液置于离心管中,同时加入20 μL上样Buffer,100 ℃煮沸10 min,12000 r/min离心1 min,取10 μL上清液上样。电泳仪电压80 V,样品通过浓缩胶后将电压调至120 V。电泳结束后剥出凝胶,浸泡在考马斯亮蓝R-250染色液中,染色结束后将凝胶置于脱色液中,脱色后将凝胶进行扫描获取图像[12-13]。
1.2.3 雁血蛋白酶解前后免疫活性的比较
1.2.3.1 小鼠脾淋巴细胞悬液的制备 对小白鼠进行颈椎脱臼致死,置于75%的乙醇中浸泡5 min。在超净工作台中进行无菌分离脾脏,放入盛有PBS的培养皿中。取200目的细胞筛,将脾脏放于细胞筛上,切成小块,加入适量的全血及组织稀释液,用注射器活塞轻轻研磨脾脏,将细胞悬液立即转移到15 mL无菌离心管中,1500 r/min离心20 min。用吸管吸出中间乳白色的淋巴细胞层置于15 mL无菌离心管中,加入10 mL的PBS洗涤,1000 r/min离心10 min弃上清液,再加入5 mL的PRMI-1640完全培养基重悬细胞,将细胞转移至培养瓶中置于恒温细胞培养箱备用[14]。
1.2.3.2 小鼠脾淋巴细胞增殖实验 按1.2.3.1方法制备小鼠脾淋巴细胞悬液,加入96孔细胞培养板,每孔100 μL。试验分为空白组(每孔加40 μL的RPMI-1640);协同 ConA刺激组(各组每孔分别加入未酶解雁血与雁血酶解产物20 μL,终浓度分别为25、50、100、200、400 μg/mL,加ConA 20 μL,ConA的终浓度为5 μg/mL),每组6个复孔。置于37 ℃、含5% CO2培养箱中培养45 h,每孔加 5 mg/mL的MTT溶液20 μL,培养箱继续孵育4 h后,1000 r/min 离心5 min,弃去上清,在每孔加入150 μL二甲基亚砜,低速振荡10 min,在570 nm波长处测定吸光度OD值[15]。
1.2.4 雁血多肽的分离纯化
1.2.4.1 超滤法分离雁血多肽 通过复合蛋白酶酶解得到雁血多肽溶液,将雁血多肽溶液倒入分子量为10 kDa的超滤管中,配平后使用4 ℃离心机中,5000 r/min离心30 min,取滤膜下的液体到另一离心管中,重复3次得到分子量小于10 kDa的雁血多肽溶液[16]。
1.2.4.2 凝胶过滤层析纯化雁血多肽 经超滤得到的雁血多肽溶液采用Sephadex G-50凝胶层析柱(1.6 cm×50 cm)进行分离。用去离子水对凝胶柱进行平衡,平衡120 min后上样,上样量为2 mL,洗脱液为去离子水,洗脱速度为0.5 mL/min,紫外检测波长为280 nm,每隔5 min收集各峰组分。重复上述分离操作以得到足够的雁血多肽样品进行冷冻干燥备用[17-18]。
1.2.5 雁血多肽的免疫功能研究 按1.2.3.1的方法制备的小鼠脾淋巴细胞悬液,加入24孔培养板,每孔100 μL,空白组细胞用完全培养基常规培养,其余各组分别加入不同质量浓度的雁血多肽分离组分,使各组分的终浓度分别为 25、50、100、200 μg/L,再加入ConA使其终浓度为 5 μg/L,另设ConA单独刺激组,每个孔加20 μL的ConA,使其终浓度为5 μg/mL,每组设6个复孔。于37 ℃、含5% CO2的培养箱中培养48 h,1500 r/min离心5 min,收集培养上清,-20 ℃保存,参照IL-2、IFN-γ、PEG2的ELISA检测试剂盒说明书的方法绘制标准曲线,检测培养上清中各细胞因子的含量[19-20]。
1.3 数据处理

2 结果与分析
2.1 酶解条件的优化
2.1.1 蛋白酶的选择结果 由表2可知,不同蛋白酶在其最佳条件下水解度最高为复合蛋白酶(28.05%),明显高于其他蛋白酶,所以选用复合蛋白酶进行酶解实验。

表2 不同蛋白酶在最佳条件下的水解度Table 2 Degree of hydrolysis of different proteases under optimal conditions
2.1.2 雁血多肽的单因素实验结果 由图1a可知,随酶解温度提升,水解度呈上升趋势,当酶解温度达到50 ℃时,水解度最高。当温度高于50 ℃时,水解度呈下降趋势。蛋白酶本质上是具有生理活性的蛋白质,温度过高时蛋白质会发生变性,减少有效酶量,从而引起酶反应速率下降,使得水解度下降。因此,酶解温度选择为50 ℃。由图1b可知,当pH达到7时,水解度最高。pH会直接影响酶和蛋白质分子某些解离基团的解离状态,只有在特定的pH条件下,酶和底物蛋白质的解离基团才能处于最易于结合并转化成产物的解离状态。因此,pH选择为7。由图1c可知,当加酶量达到4000 U/g时,水解度最高。加酶量达到一定程度后,酶促反应速度达到最大,水解度不再增加。由于加酶量为300 U/g时,水解度较低,因此,加酶量选择为4000、5000、6000 U/g。由图1d可知,当酶解时间达到5 h时,水解度最高。随着反应时间的增加,可参与反应的底物量减少,蛋白酶活性下降,反应速率放缓直至蛋白酶完全失活,反应几乎停顿,水解度几乎不再增加。由于反应时间的影响相对较小,因此选择为5 h,后续不再优化。

图1 雁血多肽单因素实验结果Fig.1 Single factor tests results of Anser cygnoides blood peptide
2.1.3 雁血多肽响应面优化结果 如表3所示雁血多肽的响应面试验设计及结果,根据各项的回归系数建立回归模型,二次多项回归方程为:

表3 雁血多肽的响应面试验设计及结果Table 3 Response surface test design and results of Anser cygnoides blood peptide
Y=29.45-0.45A-0.46B-0.48C+0.28AB+0.21AC+0.27BC-1.04A2-0.82B2-0.94C2。


表4 雁血多肽响应面方差分析结果Table 4 Response surface variance analysis result of Anser cygnoides blood peptide

图2 各因素交互作用三维响应面图Fig.2 Three-dimensional response surface diagram of interaction of various factors
通过Design-Expert 8.0.6软件进行分析,确定最佳酶解工艺为酶解温度46.96 ℃,pH6.61,加酶量4658.29 U/g,此时水解度为29.6839%。考虑到实验设施的可操作性,对酶解工艺进行修正:酶解温度47 ℃,pH7,加酶量4500 U/g,酶解时间5 h。进行3次重复实验,水解度的平均值为29.29%,与预测值接近,说明该响应面模型是科学有效的。
2.2 雁血蛋白酶解前后的SDS-PAGE电泳
由图3可以清晰的看出雁血蛋白酶解前后的分子量分布,泳道3~6与泳道2相比条带数明显减少,说明均有降解效果。其中泳道3条带数最少,说明复合蛋白酶的效果最佳,分子量在10 kDa以下。

图3 SDS-PAGE图谱Fig.3 SDS-PAGE map注:泳道1蛋白Maker(10~250 kDa); 泳道2未酶解空白组;泳道3复合蛋白酶酶解产物; 泳道4中性蛋白酶酶解产物;泳道5木瓜蛋白酶 酶解产物;泳道6碱性蛋白酶酶解产物。
2.3 雁血蛋白酶解前后对小鼠脾淋巴细胞增殖的影响
脾脏是机体重要的免疫器官之一,是机体进行体液免疫和细胞免疫的重要场所[21],脾淋巴细胞的增殖,可直接反应细胞免疫情况[22]。通过小鼠脾淋巴细胞增殖实验,观测25、50、100、200、400 μg/mL浓度水平下,雁血蛋白酶解前后对小鼠脾淋巴细胞增殖情况的影响。结果如表5所示,协同ConA作用于小鼠脾淋巴细胞时,OD值均高于空白组,且呈一定量效关系。与空白组比较,在不同浓度下,雁血蛋白酶解前后均能协同ConA促进小鼠脾淋巴细胞增殖,且在200 μg/mL浓度水平下复合蛋白酶酶解产物效果最佳(P<0.01)。

表5 雁血蛋白酶解前后对小鼠脾淋巴细胞增殖的影响Table 5 Effects of pre-and post-hydrolysis of Anser cygnoides blood protein on proliferation of mouse spleen
2.4 雁血多肽分离纯化结果与分析
图4所示,雁血多肽经Sephadex G-50凝胶层析柱分离,250 min后得到3个明显主峰,分别将其命名为ACP1、ACP2、ACP3。

图4 雁血多肽的凝胶层析Sephadex G-50洗脱曲线Fig.4 Eluting curve of Anser cygnoides blood polypeptide by gel chromatography Sephadex G-50
2.5 ACP1、ACP2、ACP3对脾脏淋巴细胞分泌IL-2、INF-γ与PGE2的影响
IL-2是T细胞生长因子,能刺激其他T淋巴细胞衍生的细胞因子的合成[23]。IFN-γ可调节癌基因的表达,抑制肿瘤细胞的分裂增殖[24-25]。PGE2(前列腺素E2)是花生四烯酸经过环加氧酶催化的代谢产物,是重要的炎症因子,与多种疾病的发生发展有关[26-27]。由表6可见,ConA组 IL-2、IFN-γ分泌水平均高于空白组,PGE2均低于空白组。ACP1、ACP2、ACP3能协同ConA促进小鼠脾淋巴细胞分泌IL-2、IFN-γ,其分泌量均高于空白组并呈一定的量效关系,差异具有统计学意义(P<0.05,P<0.01)。而与空白组比较,ConA协同ACP1、ACP2、ACP3中的PGE2含量均有降低,差异具有统计学意义(P<0.01),其中3种组分多肽在100和200 μg/mL浓度下效果较好,且ACP2在100 μg/mL浓度下效果最佳。
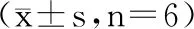
表6 ACP1、ACP2、ACP3对小鼠脾淋巴细胞分泌IL-2、IFN-γ、PGE2含量的影响Table 6 Effects of ACP1,ACP2 and ACP3 on the secretion of IL-2,IFN-γ and PGE2 by mouse spleen
3 结论
在制备雁血多肽时,确定最佳酶解工艺为酶解温度47 ℃,pH7,加酶量4500 U/g,此时多肽水解度为29.29%,且使用复合蛋白酶酶解效果最佳;雁血蛋白酶解前后均能够明显促进小鼠脾淋巴细胞增殖,且在200 μg/mL浓度水平下复合蛋白酶酶解产物效果最佳;对雁血多肽进行分级洗脱,得到ACP1、ACP2、ACP3;ACP1、ACP2、ACP3能够明显提升IL-2、INF-γ和降低PGE2的分泌量,且ACP2在100 μg/mL浓度下效果最佳。综上所述,雁血多肽能够促进机体细胞免疫功能,具有一定的免疫调节性,且ACP2效果最明显,为雁血多肽在免疫调节方面的合理应用及产品开发提供了有效的实验数据。
