冬虫夏草多糖单糖组成及免疫活性研究
2020-07-20赵彪希张海德张媚健李文佳甄达明钱正明陈海明
赵彪希,张海德,张媚健,李文佳,甄达明,钱正明,陈海明,*
(1.海南大学食品科学与工程学院,海南海口 570208; 2.广东东阳光药业有限公司,广东东莞 523871)
冬虫夏草主要产于我国的青海、西藏、四川、云南、甘肃五省的高寒地带和雪山草原,是麦角菌科真菌冬虫夏草菌Cordycepssinensis(BerK.)Sacc。寄生在蝙蝠蛾科昆虫幼虫上的子座和幼虫尸体的复合体,是我国传统的名贵中药,具有补肾益肺、止血化痰的功效[1]。研究表明冬虫夏草含有多种药理活性物质,如多糖、核苷、氨基酸、糖醇、甾醇等[2],其中多糖是冬虫夏草中重要的药理活性物质之一,多糖主要通过促进巨噬细胞增殖,增强巨噬细胞吞噬能力,促进活性氧和一氧化氮生成,提高细胞因子分泌等多个途径调节巨噬细胞活性,从而增强宿主防御能力[3]。鲜冬虫夏草为冬虫夏草的新鲜品,其活性成分没有受到干燥工艺和应急代谢等影响[4],具有有效成分含量高、药理活性强等优点[5-6]。目前已从虫草中分离出多个多糖组分,不同来源的多糖其单糖组成存在差异,天然冬虫夏草多糖主要由葡萄糖、甘露糖、半乳糖组成,而发酵菌丝体多糖除含有以上三种单糖,还含有糖醛酸,而对鲜冬虫夏草多糖的研究鲜有报道[7-8]。
本研究以鲜冬虫夏草为原料,采用水提醇沉法、Sevag脱蛋白法及透析等方法获得鲜冬虫夏草粗多糖(FCSP),然后通过比色法、HPGPC-MALLS、FT-IR及HPAEC-PAD等方法对FCSP的纯度、分子量分布、单糖组成进行了研究,并评估了FCSP对巨噬细胞活性的影响,以期为冬虫夏草多糖在增强免疫方面的应用提供了理论依据。
1 材料与方法
1.1 材料与仪器
鲜冬虫夏草 广东东阳光药业有限公司,经钱正明博士和陈海明教授鉴定为冬虫夏草Cordycepssinensis(BerK.)Sacc;无水乙醇、氯仿、正丁醇、苯酚、浓硫酸、无水甲醇 分析级,西陇科学股份有限公司;透析袋 3.5 kDa,上海源叶生物科技有限公司;无水葡萄糖(Glc)、半乳糖(Gal)、甘露糖(Man)、葡萄糖醛酸(GlcA)、半乳糖醛酸(GalA) 对照品,上海诗丹德生物技术有限公司;考马斯亮蓝试剂盒 南京建成科技有限公司;系列葡聚糖标准品(12、25、50、80、150、410、670 kDa) 美国Sigma-Aldrich;三氟乙酸(TFA)、溴化钾(KBr) 色谱级,美国aladdin公司;MTT试剂盒、Human TNF-αELISA 试剂盒 上海碧云天生物技术有限公司。
CO2恒温培养箱、Dionex ICS-5000离子色谱系统 美国Themofisher公司;1260 Ⅱ型高效液相色谱(配备蒸发光散射检测器) 美国Agilent公司;多功能酶标仪 美国BioTek公司;真空冷冻干燥机 上海Tofflon公司;傅立叶红外变换光谱(FT-IR) 德国Bruker公司。
1.2 实验方法
1.2.1 多糖提取纯化 取鲜冬虫夏草200 g,粉碎,加80%乙醇1 L加热至微沸,回流提取2 h以除去脂肪、色素及小分子组分,过滤,取滤渣并挥干。残渣加2 L纯水,煮沸回流提取2 h,共提取3次,用纱布过滤,合并滤液,45 ℃减压浓缩。向浓缩液中缓慢加入4倍体积无水乙醇,于4 ℃静置过夜,倾出乙醇取沉淀并用热水复溶,5000 r/min离心10 min,上清液用Sevag法[9]脱蛋白11次。减压浓缩脱蛋白溶液,并用3.5 kDa透析袋透析48 h,过0.45 μm滤膜,冷冻干燥,即得鲜冬虫夏草粗多糖(FCSP)。
1.2.2 多糖含量测定 以无水葡萄糖作为对照品,用苯酚-硫酸法[10]测定FCSP多糖含量。吸取0、0.2、0.4、0.6、0.8、1.0 mg/mL的葡萄糖对照品溶液以及0.1 mg/mL的FCSP溶液各1.0 mL于9支10 mL比色管中(FCSP溶液设三组平行),分别加5%苯酚1 mL,浓硫酸5 mL,密塞混匀,静置30 min,测量490 nm处吸光值。以葡萄糖浓度(mg/mL)为横坐标,吸光值(A490)为纵坐标,绘制标准曲线,得回归方程y=7.6458x+0.0118,R2=1.0000,根据回归方程计算FCSP中总糖含量。
1.2.3 蛋白含量测定 以牛血清白蛋白(BSA)作为对照品,用Bradford法[11]测定FCSP中蛋白含量。吸取0、62.5、125、250、500、1000 μg/mL的BSA对照品溶液以及10 mg/mL的FCSP溶液各100 μL于9只10 mL比色管中(FCSP溶液设三组平行),分别加5 mL考马斯亮蓝染色液,混匀,静置5 min,测量595 nm处吸光值。以BSA浓度(μg/mL)为横坐标,吸光值(A595)为纵坐标,绘制标准曲线,得回归方程y=0.8464x+0.0395,R2=0.9931,根据回归方程计算FCSP中蛋白含量。
1.2.4 分子量分布分析
1.2.4.1 样品处理 将FCSP和葡聚糖系列标准品分别溶于20 mmol/L乙酸铵中,过0.45 μm滤膜,用高效渗透凝胶色谱联用蒸发光散射检测器(HPGPC-ELSD)测定FCSP分子量分布[12]。
1.2.4.2 色谱条件 色谱柱:TSKgel G5000PWXL(7.8 mm×30 cm,10 μm)及保护柱TSKgel guardcolumn PWXL(6.0 mm×4 cm);流动相:20 mmol/L乙酸铵,等度洗脱;流速:0.6 mL/min;蒸发温度:30 ℃;漂移管温度:30 ℃;载气:空气;增益值:1.0。
1.2.4.3 标准曲线的建立 以葡聚糖系列标准品分子量的对数值(lg Mw)对保留时间(Time)进行线性回归分析,得分子量校正曲线y=-0.3725x+10.59,R2=0.9960。根据样品溶液中各色谱峰的保留时间,由校正曲线求得相应的分子量。用面积归一化法计算各组分所占的比例。
1.2.5 单糖组成分析
1.2.5.1 样品处理 取FCSP约10 mg于钳口瓶,加入2 mL TFA(2 mol/L)溶解、氮封,于120 ℃水解2 h,冷却至室温。水解液加入1 mL甲醇,氮吹挥干,重复3次。挥干后样品用1 mL超纯水复溶,稀释至合适浓度,据参考文献[13]用离子色谱分析,条件略作修改。
1.2.5.2 色谱条件 色谱柱CarboPac PA20(3 mm×150 mm)及保护柱CarboPac PA20 Guard Column(3 mm×50 mm)配备脉冲安培检测器,洗脱梯度见表1。
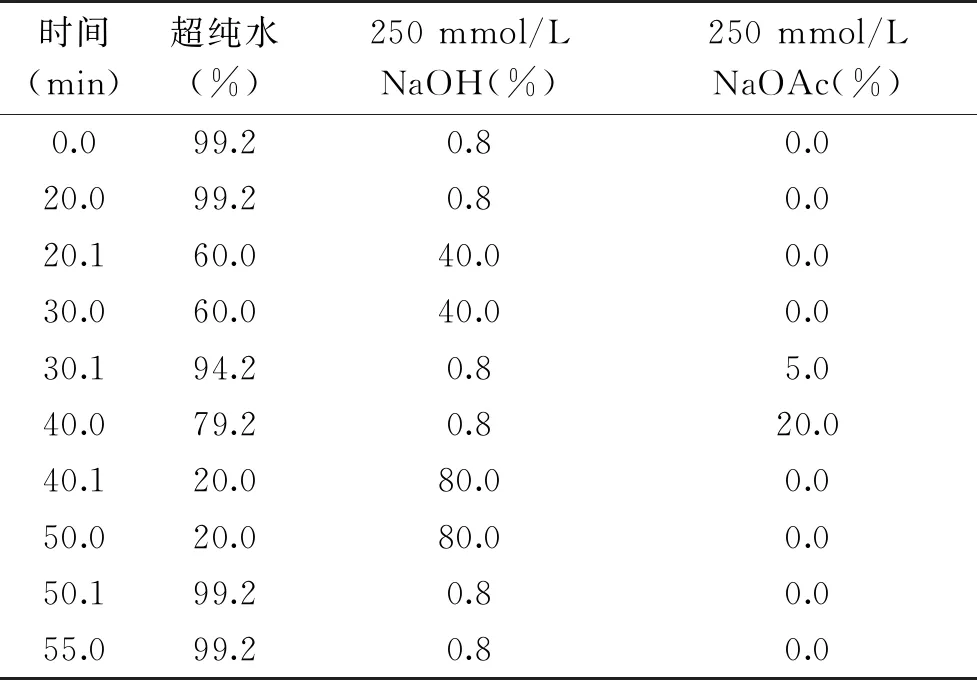
表1 离子色谱洗脱梯度Table 1 Elution gradient of HPAEC-PAD
1.2.6 红外光谱分析 根据参考文献[14],将FCSP与干燥的KBr混匀压片,用傅立叶红外变换光谱仪在4000~400 cm-1范围进行扫描分析。
1.2.7 FCSP的免疫活性研究 根据参考文献[15-16],测定FCSP对RAW 264.7细胞增殖和产生NO、TNF-α的影响。小鼠巨噬细胞株RAW 264.7用含有10%胎牛血清的DMEM完全培养基在恒温恒湿培养箱(37 ℃,5% CO2)中孵育培养。将处于对数生长期的细胞用培养基调整细胞浓度至2.0×105cell/mL接种到96孔板(100 μL/孔),培养24 h。细胞贴壁后除去旧的培养基,实验组加入用培养基溶解的FCSP溶液,使FCSP终浓度分别为6.25、12.5、25、50、100和200 μg/mL,阳性对照组加入100 μL LPS使其终浓度为1 μg/mL,空白对照组加入100 μL培养基,不含细胞的培养基作为空白组,每组设三个平行孔。继续孵育24 h后,用MTT法测定RAW 264.7细胞的增殖活性,用NO检测试剂盒和酶联免疫试剂盒分别测定NO和细胞因子TNF-α的浓度。
1.3 数据处理
数据以测定结果的平均值表示,采用IBM SPSS Statistics 20.0软件进行方差分析用于数据的显著性检验,P<0.05(*)表示数据间具有显著差异,P<0.01(**)表示数据间具有极显著差异;用Origin 2019软件绘图。
2 结果与分析
2.1 FCSP得率、多糖含量及蛋白含量
鲜冬虫夏草经过脱脂、水提醇沉、Sevag法脱蛋白和透析获得鲜冬虫夏草多糖FCSP,其多糖得率为0.46%。用苯酚-硫酸法测得FCSP的总糖含量为84.94%,用Bradford法测得FCSP的蛋白含量为2.49%。
2.2 分子量分布分析
FCSP经HPGPC-ELSD分析并通过葡聚糖线性回归方程及面积归一化法计算可知(表2,图1),FCSP主要由三个分子量多糖组成,分子量分别为1.186×104、1.070×103、2.115×10 kDa,分别占比3.510%、24.232%和72.258%。
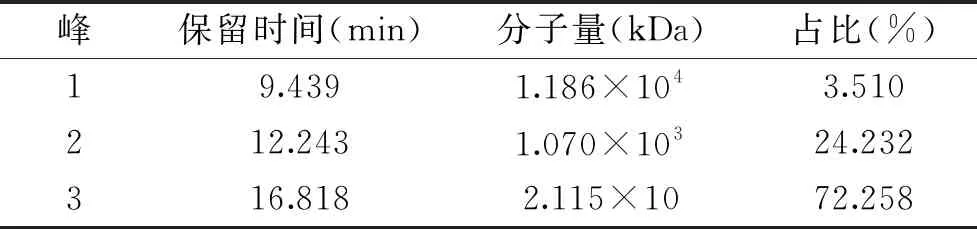
表2 FCSP分子量分布及其比例Table 2 Molecular weight distribution and its ratio of FCSP

图1 FCSP分子量分布色谱图Fig.1 Molecular weight distribution chromatogram of FCSP注:峰1~3分子量分别为1.186×104、 1.070×103、2.115×10 kDa。
2.3 单糖组成分析
FCSP经离子色谱分析显示(表3,图2),FCSP由葡萄糖(Glc)、甘露糖(Man)和半乳糖(Gal)组成,单糖组成百分比为Glc∶Man∶Gal=59.13∶21.73∶19.14。

表3 FCSP单糖组成Table 3 Monosaccharides composition of FCSP

图2 FCSP单糖组成离子色谱图Fig.2 Ion chromatogram of FCSP monosaccharides composition
2.4 FT-IR分析
FCSP的红外光谱如图3所示,3367 cm-1显示一明显宽峰,为O-H伸缩振动峰;2931 cm-1处为甲基或亚甲基的C-H振动峰;1420~1200 cm-1范围内为C-H的变角振动峰,以上三个区域的吸收峰可判定FCSP具有糖类结构[17]。1740 cm-1附近无吸收峰,说明FCSP不含糖醛酸[18],1081、1024和814 cm-1处分别为半乳糖、葡萄糖和甘露糖的特征吸收峰[19-20],以上信息与单糖组成分析结果一致。1651 cm-1为结合水峰[21]。1562、1531 cm-1为N-H的变角振动峰[22],说明FCSP可能为糖蛋白缀合物或含有蛋白质,与蛋白含量测定结果一致。1150~1010 cm-1区域内三个吸收峰及854 cm-1处的吸收峰表明FCSP中含有α-吡喃糖[19-21]。

图3 FCSP红外光谱图Fig.3 FT-IR spectrogram of FCSP
2.5 FCSP的免疫活性研究
巨噬细胞是单核吞噬细胞,在参与机体代谢、免疫防御和体内稳态调节等方面起关键作用[23]。巨噬细胞可以对外部刺激作出反应,迅速改变其生理状态,并通过释放生长因子、趋化因子和细胞因子到细胞周围而引发炎症反应进而被激活[24]。因此,本文用巨噬细胞模型研究多糖的免疫活性作用。
2.5.1 FCSP对RAW 264.7细胞增殖活性的影响 从图4结果可知,与空白对照组相比,不同浓度的FCSP均能够极显著(P<0.01)地促进RAW 264.7巨噬细胞增殖,且增殖率均高于LPS阳性对照组。在低浓度范围内(6.25~50 )μg/mL,RAW 264.7的细胞增殖率呈剂量依赖型。当FCSP浓度为50 μg/mL时,细胞增殖率为155.50%,达到最大效应,故随着FCSP浓度的继续升高,细胞增殖率无显著变化。

图4 FCSP对RAW 264.7细胞增值率的影响Fig.4 Effect of FCSP on proliferation of RAW 264.7 cells注:*代表差异显著(P<0.05),**代表差异极显著(P<0.01)。图5、图6同。
2.5.2 FCSP对RAW 264.7细胞NO释放量的影响 NO是一种重要的信号分子,在人体很多组织中调节多种生理过程,检测在多糖刺激下巨噬细胞上清液中亚硝酸盐浓度即可判断NO的产生量[25]。由图5结果可知,FCSP处理组释放NO的效果弱于LPS阳性对照组;与空白对照组相比,低浓度(6.25~50) μg/mL的FCSP对细胞NO释放量无显著(P>0.05)影响,高浓度(100~200) μg/mL的FCSP能极显著(P<0.01)促进巨噬细胞释放NO,并呈现剂量依赖型,当FCSP浓度达到200 μg/mL时,细胞NO释放量达到最高为12.75 μmol/L。

图5 FCSP对RAW 264.7细胞NO释放量的影响Fig.5 Effect of FCSP on NO production of RAW 264.7 cells
2.5.3 FCSP对RAW 264.7细胞TNF-α释放量的影响 检测细胞因子的产生量是表征人体免疫反应变化的一种简便方法,TNF-α等细胞因子的含量水平在衡量免疫调节作用中起着重要作用[26]。从图6可知,与空白对照组相比,不同浓度的FCSP均能够极显著(P<0.01)增强细胞对TNF-α的释放且具有明显的剂量依赖型。当FCSP浓度达到12.5 μg/mL时,RAW 264.7细胞对TNF-α的释放量超过LPS阳性对照组;当FCSP浓度为200 μg/mL时,RAW 264.7细胞对TNF-α的释放量达到最高,为2785.33 pg/mL。结果表明,FCSP能极显著(P<0.01)促进巨噬细胞分泌TNF-α。
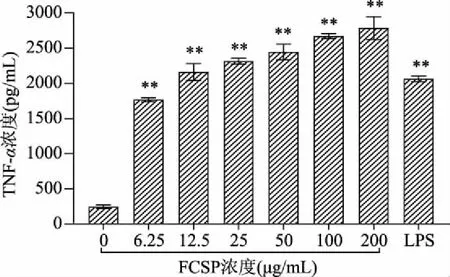
图6 FCSP对RAW 264.7细胞TNF-α释放量的影响Fig.6 Effect of FCSP on TNF-α production of RAW 264.7 cells
3 结论
本研究以鲜冬虫夏草为原料通过脱脂、水提醇沉、脱蛋白和透析,获得多糖FCSP,得率为0.46%。FCSP中多糖含量为84.94%,蛋白含量为2.49%;其主要含有分子量分别为1.186×104、1.070×103和2.115×10 kDa的三个多糖组分,并由葡萄糖、甘露糖和半乳糖组成,含量分别为59.13%、21.73%和19.14%,红外光谱结果印证了FCSP的单糖组成及其多糖的本质。本研究结果显示,FCSP对促进RAW 264.7巨噬细胞增殖和释放NO、TNF-α具有极显著(P<0.01)作用,且呈现明显的剂量依赖效应,表明FCSP可作为良好的免疫调节剂。本研究为冬虫夏草多糖产品的开发和应用提供了理论依据。
