ACE基因多态性与缬沙坦治疗房颤合并心功能不全患者疗效的相关性
2020-07-20居海宁葛俊纬
居海宁,葛俊纬,江 冰
0 引言
心房颤动(简称房颤)是临床上常见的心律失常,60岁以上人群的发病率高达1.8%[1]。房颤可能导致心腔内血流动力学异常,易形成附壁血栓,从而导致脑血栓、心肌梗死及心力衰竭等严重后果。研究已证实,房颤的发生与遗传密切相关,作为肾素-血管紧张素-醛固酮系统(RAAS)的关键转化酶,血管紧张素转化酶(ACE)在心房的电生理重构和结构重构中发挥重要作用,同时也影响房颤的药物治疗效果[2-3]。目前,血管紧张素Ⅱ(AngⅡ)受体拮抗剂缬沙坦常应用于房颤的治疗,但其疗效具有明显的个体差异性和不可预测性,故ACE基因多态性与缬沙坦治疗房颤合并心功能不全患者疗效的关系一直是研究的热点[4]。本研究拟对接受缬沙坦治疗的房颤合并心功能不全患者的ACE不同位点基因多态性进行研究,分析ACE基因多态性与疗效的关系,以期为临床治疗提供参考。
1 资料与方法
1.1 一般资料 选取2017年1-12月在我院接受药物治疗的持续性房颤合并心功能不全患者,共82例。纳入标准:①有反复房颤发作,并至少有2次经心电图或动态心电图证实者;②纽约心脏病学会(NYHA)心功能分级≤Ⅱ级;③知情同意的患者。排除标准:①左心房内径≥55 mm者;②甲状腺功能亢进症;③电解质紊乱;④既往曾行房颤消融术者;⑤有其他原因导致无法接受缬沙坦治疗患者。其中男47例,女35例,年龄45~78岁,平均(63.2±4.7)岁。
1.2 方法
1.2.1 用药方法 第1周胺碘酮0.3 g/d,第2周胺碘酮0.2 g/d,第3周及以后根据患者情况,停药或者给予0.1 g/d胺碘酮维持治疗。在胺碘酮治疗基础上,增加缬沙坦治疗,至少治疗6个月。
1.2.2 基因多态性检测 抽取患者入院第2天清晨空腹肘静脉血2 ml,置于含枸橼酸盐的抗凝管。采用细胞DNA提取试剂盒(上海博彩生物制剂有限公司)提取外周血DNA,置于-70 ℃冰箱保存。采用实时定量PCR技术进行基因扩增。依据ACE基因第16内含子I/D、第17个外显子G2350A多态性片断设计引物,并委托专业测序公司合成。其中,I/D位点上游引物:5′-CTGGAGACCACTCCCATCCTTTCT-3′,下游引物:5′- GATGTGGCCATCACATTCGTCAGAT-3′。G2350A上游引物:5′-CCTCCACGAGTCCCCTGCA-3′,下游引物:5′- CCTCCACGAGTCCCCTGCA-3′。PCR反应条件:95 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共进行40个循环;72 ℃最后延伸5 min。PCR产物中加入2%琼脂糖凝胶纯化回收,以DNA marker为参照,在紫外线灯下根据凝胶条带位置判断ACEI/D、G2350A基因分型。
1.2.3 临床指标收集 收集患者的年龄、性别、体重、收缩压(SBP)、舒张压(DBP)、心功能分级等基线资料。入院时,采用GE-Logic7彩色超声诊断仪评估患者的心功能,包括左房内径、左心室射血分数(LVEF)等,采用美国Roche公司Cobase411型全自动电化学分析仪测定血清脑钠肽(BNP)水平。
1.3 疗效评价指标 治疗结束后对患者进行12个月的随访,每个月至少门诊随访1次,如有房颤复发症状,立即行心电图或动态心电图检查。以治疗后3、6、9、12个月后窦性心律维持率及治疗后12个月复发率作为疗效评价指标。

2 结果
2.1 不同ACE基因患者治疗后窦性心律维持率比较 随着治疗后随访时间的延长,ACEI/D基因中DD、II基因型患者窦性心律维持率明显下降(P<0.05)。与ACEID型、DD型比较,II型治疗后9、12个月窦性心律维持率均升高(P<0.05)。见表1。

表1 不同ACE基因患者治疗后窦性心律维持率比较[例(%)]
2.2 不同ACE基因患者治疗后窦性心律维持率比较 随着治疗后随访时间的延长,ACEG2350A基因中GG、GA基因型患者窦性心律维持率明显下降(P<0.05)。与ACEGG型、GA型比较,AA型治疗后12个月窦性心律维持率均显著升高(P<0.05)。见表2。
2.3 房颤复发与未复发患者临床相关指标及ACE基因多态性比较 与复发患者比较,未复发患者心功能、LVEF、BNP以及ACEG2350A基因中AA基因型比例和I/D基因中II基因比例升高,SBP下降,差异均有统计学意义(P<0.05)。见表3。

表2 不同ACE G2350A基因治疗后窦性心律维持率比较[例(%)]
2.4 房颤复发的影响因素分析 以治疗后随访12个月房颤是否复发(复发=1,非复发=0)为因变量,将心功能分级(Ⅱ级=0,Ⅲ级=1,Ⅳ级=2)、LVEF、BNP、SBP、G2350A位点基因分型(AA=0,GA=1、GG=2)、I/D位点基因分型(II=0,DI=1、DD=2)作为自变量引入模型,进行多因素Logistics回归分析。结果显示,BNP是房颤复发的独立危险因素,差异有统计学意义(P<0.05);心功能分级(Ⅱ级)、I/D位点基因分型(II)、G2350A位点基因分型(AA)则是保护因素,差异有统计学意义(P<0.05)。见表4。
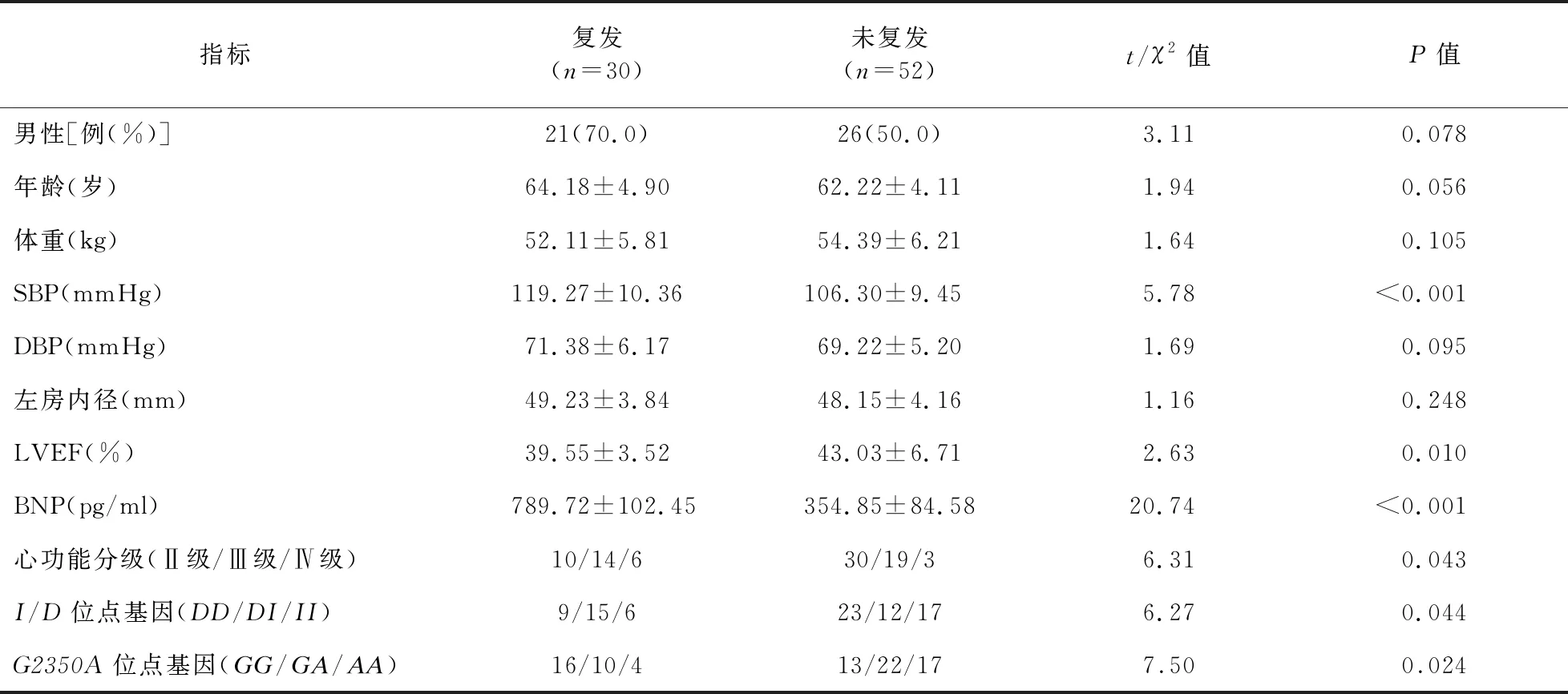
表3 房颤复发与未复发患者临床相关指标及ACE基因多态性比较
3 讨论
房颤是一个多因素作用的复杂病变,心房重构是最经典的机制学说。该学说主要包括结构重构、电重构、神经重构及心房代谢重构等。结构重构可通过心脏电传导异常引起电重构,从而导致房颤的发生与维持;而电重构亦可增加房颤的稳定性,并促进心房结构重构,形成恶性循环[5-6]。近年来,缬沙坦作为一种AngⅡ受体拮抗剂,已成为房颤治疗的首选药物。有证据表明,缬沙坦可与血管紧张素竞争性结合并拮抗血管紧张素受体,同时可能对ACE有一定的抑制作用,阻止AngⅡ的升高,减轻心房的结构重构和电重构[7-8]。有研究显示,在心房快速起搏房颤动物模型中多伴随明显的心房纤维化,而缬沙坦有助于预防心房快速起搏下的心房纤维化[9]。鉴于缬沙坦对房颤合并心功能不全患者治疗反应的悬殊差异,学者对致病基因多态性变异与临床疗效的关系愈发重视,ACE基因可能是房颤的候选基因之一[10]。
目前,关于RAAS中ACE基因多态性与房颤发生及疗效相关性的研究多集中于单基因的研究,对基因之间的交互作用、基因之间的连锁反应对房颤影响的研究并不充分。ACE基因位于常染色体17q23,其第16内含子因插入(I)或缺失(D)1个287 bp的DNA片段而表现出I/D多态性。I/D多态性能显著影响血浆、细胞中ACE水平。此外,有研究表明,ACEG2350A位点的多态性也会影响ACE的浓度,进而改变AngⅡ的生理学效应[11]。近期研究证实,G2350A位点G/A多态性与房颤也存在一定关系[12]。本研究结果显示,随着治疗后随访时间的延长,ACEI/D位点基因中DD、II基因型、G2350A基因中GG、GA基因型患者窦性心律维持率明显下降,而I/D位点基因中II型和G2350A基因中AA基因型窦性心律维持率最高,说明缬沙坦应用于携带II基因型、AA基因型患者不易复发,其可能与D、G等位基因患者的ACE活性及血浆AngⅡ水平较高有关。由于D、G等位基因是缺失寂性基元,转录时可出现基因活化,导致应用缬沙坦后有更多的AngⅡ介导的作用被拮抗,从而影响缬沙坦的临床疗效。
皮阳等[13]一项Meta分析显示,ACEI/D基因多态性是导致房颤发病的独立危险因素,II基因型患者65岁及以上人群的发病风险下降,而DD、DI基因型无明显差异。有研究发现,ACEDD基因型孤立性房颤患者对抗心律失常药物治疗效果较差[14]。Ueberham等[15]研究认为,ACEDD基因型房颤患者术后复发风险是DI、II基因型患者的2.3倍,并指出ACE变异所致心房纤维化与术后复发有关。Jiang等[16]报道,与健康人群比较,房颤患者AA基因型比例显著升高,且AA基因型患者左心房内径显著大于GG、GA型患者。因此,ACE基因多态性可能在房颤的发生与治疗过程中起到重要作用。目前,已有研究证实,ACEI/D、G2350A基因对高血压患者的降压效果具有交互作用[17-18],但对房颤患者药物效果仍未见相关研究。多因素分析发现,除了心功能分级外,I/D位点基因分型(II)、G2350A位点基因分型(AA)也是房颤治疗后复发的独立保护因素,推测RAAS中单个基因位点多态性并非导致房颤发生和持续的唯一因素,ACE多个位点基因之间的连锁反应或连锁失衡可能对缬沙坦的疗效产生影响。同时,II基因型、AA基因型可能存在一定协同作用,共同加强缬沙坦对房颤合并心功能不全患者的疗效。
综上所述,ACEI/D基因和G2350A基因多态性与缬沙坦治疗房颤合并心功能不全患者的疗效密切相关,可为房颤疗效与RAAS系统基因多态性的关系以及个性化临床用药方案的确定提供新的科学依据。但该研究仍处于起步阶段,尤其是ACE不同位点基因的多态性对疗效的协同作用尚处于初步阶段,具体机制仍需深入研究。
