生物靶向诊疗一体化探针多模态成像及增效高强度聚焦超声的实验研究
2020-07-18汪瑶台邹建中杨海燕王璐蒋富杰郝兰
汪瑶台,邹建中,2*,杨海燕,王璐,蒋富杰,郝兰
1.超声医学工程国家重点实验室,重庆医科大学生物医学工程学院,重庆 400016;2.重庆市生物医学工程学重点实验室,重庆 400016;3.重庆医科大学超声影像学研究所,重庆 400010;*通讯作者 邹建中 zoujzh@cqmu.edu.cn
肿瘤诊疗离不开影像技术[1],单一的成像模式受分辨率、敏感度、穿透深度等多种因素限制,对肿瘤的定位及定性诊断具有局限性[2]。多模态分子影像通过分子探针的多种显像效果,获得较全面的病变部位信息,克服了单一显像方式的不足[3-5]。但是分子探针靶向性不强,无法在肿瘤靶区聚集,削弱了其诊疗效果。因此,本实验制备包裹吲哚菁绿(indocyanine green,ICG)和全氟己烷(perfluorohexanes,PFH)的阳离子脂质纳米粒,利用静电吸附法将纳米粒和生物靶向载体双歧杆菌结合[6-10],构建生物靶向诊疗一体化探针,使肿瘤诊疗更加安全有效。
1 材料与方法
1.1 主要材料与仪器 二棕榈酰基卵磷脂(DPPC)、二硬脂酰基磷脂酰基乙醇胺-聚乙二醇-氨基(DSPE-PEG2000-Amine)、胆固醇盐酸盐(DC-CHOL)均购自美国Avanti公司。三氯甲烷(重庆川东化工集团),全氟己烷(PFH,英国Apolo公司),吲哚菁绿(ICG,上海阿拉丁公司),红色荧光染料细胞膜红色荧光探针(DiI)、绿色荧光染料异硫氰酸荧光素(FITC)均购自美国 Sigma公司。长双歧杆菌ATCC15707(重庆医科大学基础医学院提供)。旋转蒸发仪(上海亚荣生化仪器厂),声震仪(美国Sonic公司),光学显微镜(日本Olympus公司),激光共聚焦显微镜(日本Nikon公司),流式细胞仪(美国Beckman公司),粒径分析仪(英国Malvern公司),808 nm激光仪(西安中川光电科技有限公司),光声成像仪(加拿大Visual Sonics公司),Mylab 90超声诊断仪(意大利Esaote公司),LB983 NC320型活体成像系统(德国Berthold公司),DFY软件(重庆医科大学超声影像研究所),海扶刀®聚焦超声肿瘤治疗系统[重庆高强度聚焦超声(high intensity focused ultrasound,HIFU)医疗科技股份有限公司]。
1.2 生物靶向诊疗一体化探针的构建
1.2.1 包裹ICG和PFH的阳离子脂质纳米粒制备及性质检测 将DPPC、DSPE-PEG2000-Amine和DC-CHOL 以5∶2∶2的质量比溶于三氯甲烷中,旋转蒸发以去除有机溶剂,成膜后加入2 ml 去离子水洗脱薄膜。称取1 mg ICG 溶于200 μl 去离子水中,滴加200 μl PFH,均质乳化(占空比5 s∶5 s,总时间2 min)得初乳,将初乳加入至薄膜水溶液中,继续声震(占空比5 s∶5 s,总时间5 min)得复乳,低温高速离心机离心(8 000 转/min,5 min),去离子水洗涤3次,得到阳离子纳米粒,粒径仪检测其粒径电位。纳米粒稀释至1 mg/ml,808 激光仪辐照(2 W,5 min),光学显微镜采集辐照前后的纳米粒图像。
1.2.2 双歧杆菌的培养及表征检测 将双歧杆菌加入含MRS培养基的EP管中,于37℃孵箱中厌氧培养24 h,低温离心机离心(1000转/min,10 min),PBS重悬稀释双歧杆菌浓度至6×107个/ml备用。革兰染色后用光学显微镜观察形态,粒径仪测量其表面电位。
1.2.3 双歧杆菌于阳离子纳米粒的体外连接检测 将DiI 标记的阳离子纳米粒(浓度1 mg/ml)与Fitc标记的双歧杆菌(浓度为1×106个/ml)以体积比3∶1混合,静置5min,稀释备用。共聚焦显微观察两者的连接情况。
将双歧杆菌(浓度为1×106个/ml)分为3组,每组100 µl,分别加入300 µl PBS,经DiI 标记的表面电荷为负的纳米粒与阳离子纳米粒。A组为双歧杆菌+PBS组,B组为双歧杆菌+纳米粒组,C组为双歧杆菌+阳离子纳米粒组,3组均稀释200倍,混合静置5 min,用流式细胞仪检测各组的连接情况。
1.3 生物靶向诊疗一体化纳米探针对肿瘤的靶向性验证
1.3.1 建立荷瘤鼠模型 选取4~6 周龄雌性BALB/C-nu 鼠5只(重庆医科大学动物实验中心提供),体重(20.07±2.34)g。取对数生长期的MDA-MB-231细胞消化、重悬并调整细胞浓度至1×107个/ml,皮下注射至裸鼠臀部,待肿瘤体积长至100 mm3时,进行实验。
1.3.2 靶向性验证 将双歧杆菌稀释至1×106个/ml,尾静脉注射至5只荷瘤鼠体内(每只0.2 ml)。于注射后72 h 处死,取肿瘤、心、肝、脾、肺、肾做组织切片并进行革兰染色,光学显微镜下观察双歧杆菌在各组织中的分布。
1.4 体外多模态成像
1.4.1 体外荧光成像 以PBS为对照组,将阳离子纳米粒根据ICG浓度稀释至5 µg/ml溶液,各取200 µl于96孔板中,于荧光成像系统中成像(激发波长745 nm,发射波长800 nm)。
1.4.2 体外光声成像 以PBS为对照组,将阳离子纳米粒根据ICG浓度分别配置成10、20、30、40 µg/ml的溶液,于光声成像系统中成像,并用系统自带软件检测光声信号值(频率:21MHz,光声灰度:50dB,2D灰度:18dB,激发波长820 nm)。

图1 包裹ICG和PFH的阳离子脂质纳米粒与双歧杆菌的表征及连接率检测。A、B分别为阳离子纳米粒粒径图和电位图;光镜示双歧杆菌革兰染色成蓝色棒状(C,×400);D为双歧杆菌电位图;激光共聚焦显示双歧杆菌与阳离子纳米粒成功相连(×800,E);流式分析仪检测各组连接率(F)
1.4.3 体外超声成像 取200 µl ICG浓度为20 µg/ml的纳米粒,加入96孔板中,以PBS为对照组,用808激光仪辐照(2 W/cm2,3 min),用DFY软件观察并定量分析不同组辐照前后声强值的变化。
1.5 体外增效HIFU 在蛋清体模中注入PBS和ICG浓度为20 µg/ml的阳离子纳米粒各1 ml,HIFU 点辐照(150 W,3 min),在超声监控图像中勾画辐照前后的灰度变化区域,HIFU 自带软件计算灰度变化值。辐照后沿声束长轴以每层2 mm 切开蛋清体模,观察凝固性坏死区域形态,并计算坏死体积(坏死体积=Π/6×长×宽×厚)。能效因子(emergency efficiency factor,EEF)(J/mm3)=ŋPT/V,其中本仪器ŋ 取0.7,P(W)为HIFU总声功率,T(s)为治疗时间,V(mm3)为损伤体积。分析验证阳离子纳米粒对HIFU的增效效果。
1.6 统计学方法 使用SPSS 19.0软件,计量资料以表示,各实验组及对照组光声信号值比较采用单因素方差分析,两两比较采用LSD 法。纳米粒组与PBS组各参数比较采用成组资料t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 包裹ICG和PFH的阳离子脂质纳米粒与双歧杆菌的表征及连接率检测 成功制备的纳米粒平均粒径为(330.75±0.75)nm(图1A),表面电位为(24.9±3.4)mV(图1B)。双歧杆菌革兰染色呈蓝紫色的长棒状(图1C),表面电位为(-24.3±3.5)mV(图1D)。共聚焦显微镜下阳离子纳米粒呈红色,双歧杆菌呈绿色,双歧杆菌周围黏附聚集了大量阳离子纳米粒(图1E)。流式结果(图1F)显示,双歧杆菌与阳离子纳米粒连接率高达(99.14±0.55)%,而对照组连接率仅为(5.67±2.76)%。
2.2 包裹ICG和PFH的阳离子脂质纳米粒的相变能力检测 400倍光镜下观察可见,与激光辐照前的纳米粒比较,激光辐照后纳米粒逐渐变大(图2)。
2.3 对肿瘤的靶向性验证 组织切片结果显示,仅肿瘤组织中可见大量蓝染的双歧杆菌,而其余组织中未见明显的双歧杆菌分布(图3)。
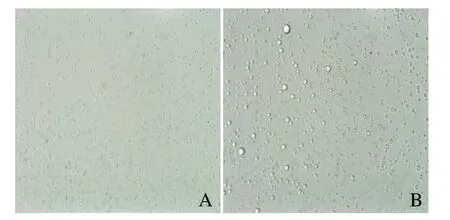
图2 包裹ICG和PFH的阳离子纳米粒的相变能力检测。激光辐照前光镜下的阳离子纳米粒(A);激光辐照后,可见纳米粒逐渐变大(B)
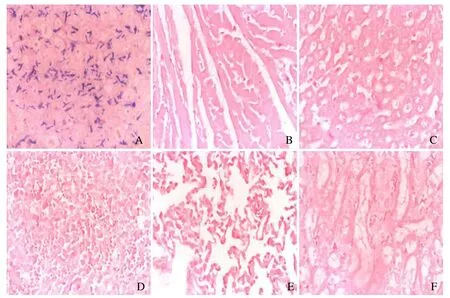
图3 对肿瘤的靶向性验证。组织切片革兰染色显示,肿瘤组织中可见大量蓝染的双歧杆菌(A);B~F 依次为心、肝、脾、肺、肾组织,未见双歧杆菌(×400)
2.4 体外多模态成像表现 荧光成像显示,阳离子纳米粒荧光信号明显,而对照组未出现明显的荧光信号(图4A)。光声成像显示,光声信号值随纳米粒中 ICG浓度的增加而逐渐增强(图4B),ICG浓度为10、20、30、40 µg/ml的纳米粒溶液,光声值分别为(0.23±0.04)、(0.45±0.06)、(0.72±0.08)、(1.08±0.06)a.u.,对照组光声值为(0.02±0.01)a.u.,组间差异有统计学意义(F=164.7,P<0.001),各实验组光声值均高于对照组,差异有统计学意义(P均<0.05),且各实验组间两两比较,差异有统计学意义(P均<0.05)。
观察激光辐照前后超声显像效果,与对照组相比,阳离子纳米粒组回声明显增强(图4C),DFY定量仪分析可知辐照前后阳离子纳米粒组声强差值为(56.67±4.73)dB,PBS组为(5.33±4.51)dB,差异有统计学意义(t=13.612,P<0.001)。
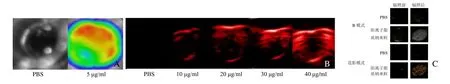
图4 体外多模态成像表现。A为PBS和阳离子脂质纳米荧光成像图;B为PBS和不同ICG浓度的阳离子纳米粒光声成像图;C为PBS和阳离子纳米粒激光激发前后超声声像图
2.5 体外增效HIFU的效果 HIFU辐照后,可见消融区回声增强(图5A),阳离子纳米粒组灰度变化值明显高于PBS组,凝固性坏死体积(图5B)远大于PBS组,EEF值小于PBS组(P<0.01,表1)。
3 讨论
分子探针在肿瘤诊疗中的运用一直是研究热点,现有的分子探针显影模式单一,靶向性不强[11-12]。本研究构建的生物靶向诊疗一体化探针有望弥补上述不足。
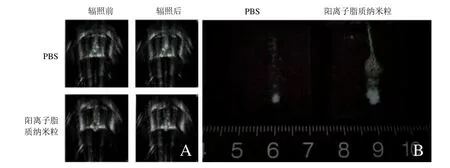
图5 体外增效HIFU的效果。PBS组和阳离子纳米粒组辐照前后超声声像图,绿色勾画区域即为灰度变化区(A);HIFU辐照后,PBS组和阳离子纳米粒组蛋清体模凝固性坏死体积截面图(B)
表1 各组蛋清体模灰度变化值、凝固性坏死体积及EEF(±s)
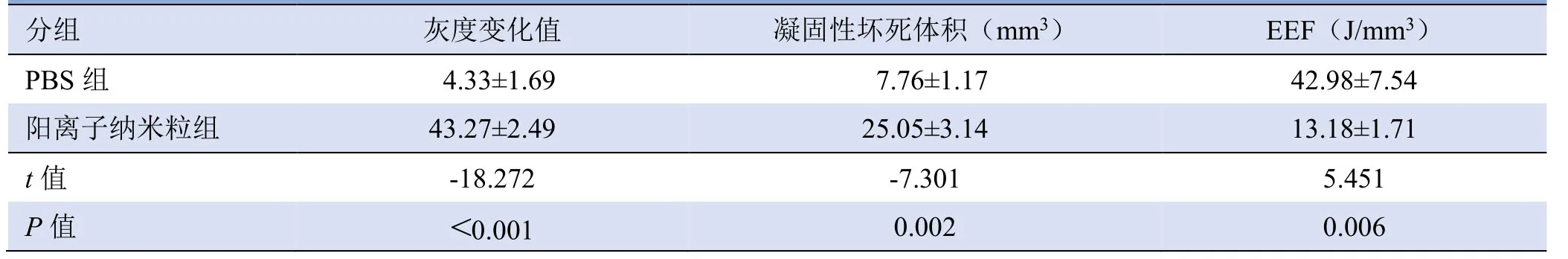
表1 各组蛋清体模灰度变化值、凝固性坏死体积及EEF(±s)
分组 灰度变化值 凝固性坏死体积(mm3)EEF(J/mm3)PBS组 4.33±1.69 7.76±1.17 42.98±7.54 13.18±1.71 t值 ‑18.272 ‑7.301 5.451 阳离子纳米粒组 43.27±2.49 25.05±3.14 P值 <0.001 0.002 0.006
本实验结果显示,双歧杆菌与阳离子脂质纳米粒可通过静电吸附法高效连接。探针可实现对肿瘤组织的主动靶向,为后续体内靶向多模态成像和增效HIFU奠定了基础。探针体现了良好的成像效果是因为探针中的纳米粒包裹了ICG和PFH,ICG本身不仅具有光声,荧光显像能力,还可以高效地将吸收的近红外光转化为热能[13]。激光激发下,ICG产热使PFH发生液气相变,产生改变组织声环境的气态微泡,实现增强超声的效果。这3种均为非侵入性成像模式,具有各自的优点,超声成像可以实时显示活动性器官结构,能较好地显示血管和检测血流动力学参数[14]。光声成像融合了声学、光学显影的优势,有较好的成像深度和图片分辨率,在观察肿瘤部位纳米粒富集的同时,还可以进行结构和功能成像[15],而荧光成像可以观察纳米粒在体内的动态分布。将这三者融合在一起,可以较大程度地满足日益多样化的诊疗需求。在增效实验中,HIFU辐照前后实验组的消融程度明显优于对照组,可能是因为阳离子脂质纳米粒中包裹的PFH在HIFU激发下,产生了空化、机械、热效应,进而增效了HIFU。
总之,制备的探针具备主动靶向肿瘤、多模态显像、增效HIFU的能力,实现了靶向诊疗一体化。但实验仅验证了双歧杆菌与纳米粒的体外连接,体内微环境可能会对两者的连接率造成一定的影响,同时对机制的研究尚有欠缺,将在后续实验中进一步探讨。
