人胎盘间充质干细胞的磁性标记及MR分子成像
2020-07-18王芳何花熊瑶朱凯胡洁婷王一帆郭玉林
王芳,何花,熊瑶,朱凯,胡洁婷,王一帆,郭玉林*
1.宁夏医科大学临床医学院,宁夏银川 750004;2.宁夏医科大学总医院放射科,宁夏银川 750000;*通讯作者 郭玉林 guoyulin66@163.com
干细胞治疗是再生医学的一种新的治疗途径。胎盘间充质干细胞(placental mesenchymal stem cells,PMSCs)具有来源丰富、采集方便以及靶向迁移到损伤组织等特点,成为研究热点[1],但其分子特性、基因表达及生物功能近年引起诸多争议[2-3];因此,需要大量实验评估其应用于临床的可行性。MRI是公认的细胞示踪的理想方法[4]。本实验拟采用多聚赖氨酸(polylysine,PLL)转染MR对比剂超微超顺磁性氧化铁(ultrasmall super paramagnetic iron oxide,USPIO)形成复合物对hPMSCs 进行标记并行MR分子成像,探讨hPMSCs 磁性标记的可行性及其成像规律,为hPMSCs的体内示踪及临床应用提供参考。
1 材料与方法
1.1 仪器与试剂 间充质干细胞表面标记检测试剂盒(广州Cyagen),USPIO(上海羧菲),多聚赖氨酸、台盼蓝染色液、普鲁士蓝染色液(北京Solarbio),细胞增殖及毒性检测试剂盒(日本同仁),Annexin VFITC/PI 细胞凋亡试剂盒(江苏凯基),琼脂糖(上海Sangon),倒置荧光显微镜(上海普丹光学仪器有限公司),流式细胞仪(BD公司),3.0T MR扫描仪(Philips公司),小动物专用线圈等。
1.2 实验方法
1.2.1 hPMSCs培养与表面标记鉴定 复苏hPMSCs待细胞长至培养皿底部80%~90%传代。收集第3代hPMSCs 调整浓度为3×106个/ml。取100 μl 细胞悬液分别加至已标记一抗名称的EP 管中,再分别加入2 μl 标记名称相对应的一抗(CD29、CD105、CD73、CD11b、CD14、CD45、IgG1)4℃孵育30 min后清洗、离心、去上清。每管再加入2 μl 荧光二抗PE 置于冰盒内避光孵育,30 min后清洗、离心、去上清,重悬于200 μl PBS 中检测细胞表面标志物的阳性表达率。
1.2.2 PLL-USPIO 对hPMSCs的标记制备 将USPIO与PLL 按1∶0.03 混合置于旋涡混合器2200 r/min 振荡30 min 形成PLL-USPIO 复合物。按10 μg/ml 将PLL-USPIO 加入hPMSCs的完全培养液中吹打混匀。用该培养基孵育hPMSCs 18~24 h。
1.2.3 铁标记率计算 将细胞爬片置于六孔板内,取2×104个hPMSCs 均匀滴至爬片,待细胞贴壁后加1.5 ml 培养基置于培养箱孵育,次日标记。24 h后去除培养液,以4%多聚甲醛固定,吸取普鲁士蓝染色滴满爬片,孵育30 min 用蒸馏水冲洗,再将普鲁士蓝复染液滴染于爬片,30 s后冲洗、晾干、镜检。铁标记率=蓝染细胞数/镜下细胞总数×100%。
1.2.4 标记后细胞生物学特性比较 ①台盼蓝拒染率计算细胞活力:取等量hPMSCs 悬液和0.4%台盼蓝混匀计数。由于细胞膜不完整的死细胞可被染成蓝色,活细胞不染色,细胞存活率=活细胞数/镜下细胞总数×100%。②CCK-8 试剂盒判断细胞增殖能力:按 2×103个hPMSCs/孔接种于96孔板。贴壁后标记细胞为实验组,未标记细胞为对照组,不含细胞的完全培养基为空白组,各组设5个复孔,标记后第1、3、5、7天分别加入含有10 μl CCK-8液的完全培养基100 μl。孵育2 h后用酶标仪检测波长450 nm 处每孔的吸光度(OD值),比较各组OD值并绘制细胞增殖曲线。③Annexin V-FITC/PI 试剂盒检测凋亡率:收集标记与未标记的hPMSCs 于不同离心管中,调整浓度约1×105个/ml 分装于EP 管中,依次加入500 μl Binding Buffer、5 μl Annexin V-FITC,充分混匀后加入5 μl 碘化丙啶,室温避光反应15 min后上机检测。
1.2.5 3.0T MR 体外扫描 配制浓度为1%的琼脂糖溶液,加热待沸腾置于60℃水浴缸内,分别取1×106、5×105、1×105、5×104、1×104、5×103个标记和未标记的hPMSCs 悬液,吸取1%琼脂糖600 μl 重悬混匀,迅速放入4℃冰箱1~2 min 使其凝固,固定于塑料支架内行MRI扫描。
MRI扫描序列包括 T2WI、T2mapping、T2*mapping,横断位扫描,层厚2 mm,层间距0.2 mm。T2WI 快速自旋回波序列扫描参数:TR 2000 ms,TE 140 ms,回波链长15,翻转角150°,FOV 35 mm ×35 mm,采集矩阵176×176;T2 mapping序列扫描参数:TR 2000 ms,TE n×13 ms(n分别为13、26、39、52、65、78 ms),翻转角90°,FOV 50 mm×50 mm,采集矩阵124×124;T2*mapping序列扫描参数:TR 28 ms、TE n×3 ms(n分别为3、8、12、16、20、24 ms),翻转角20°,FOV 30 mm×30 mm,矩阵100×96。在后处理工作站中,分别测量各序列各数量级细胞模型的MR信号值。某一特定序列及细胞数量下取3个面积为3 mm2的感兴趣区测量,比较不同细胞数目、不同序列横向弛豫时间(T2、T2*值)和弛豫率(R2、R2*值)。
1.3 统计学方法 使用SPSS 19.0软件,计量资料以表示。标记与未标记细胞活力与凋亡率比较采用χ2检验;增殖能力及信号值比较采用独立样本t检验。采用单因素方差分析比较相同序列不同细胞数量信号值。采用配对t检验比较各数量级标记细胞T2、T2*值。P<0.05表示差异有统计学意义。
2 结果
2.1 hPMSCs培养与表面抗原鉴定 细胞接种于培养瓶约3 h 开始贴壁,24 h后多数细胞由小圆形逐渐变成扁平不规则状,细胞生长速度加快,铺满约90%时开始融合呈旋涡状生长。倒置显微镜显示标记与未标记细胞均以梭形为主,偶见宽大平坦的多边形,传代后细胞均为分布均匀的纺锤形,表明该标记浓度对细胞形态无明显影响(图1)。
流式细胞仪检测结果显示,表面标志CD105表达94%、CD29表达98%、CD73表达96%,CD45、CD11b、CD14 几乎不表达,表明体外培养的第3代hPMSCs为较均一未分化的干细胞,可满足实验需要(图2)。
图1 倒置显微镜下细胞形态比较。A为未标记的hPMSCs(×100);B为磁性标记的hPMSCs(×100)
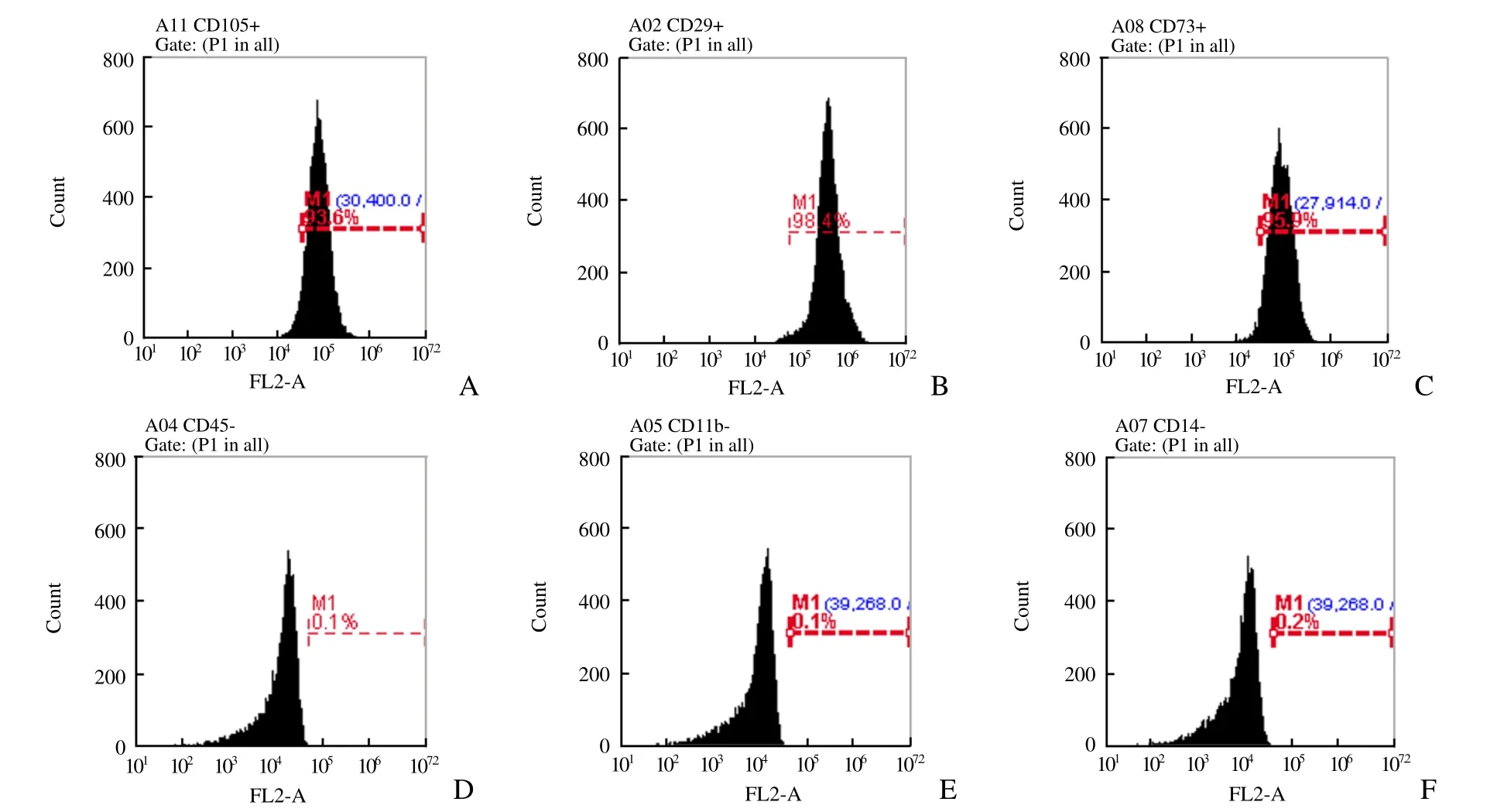
图2 流式细胞术表面抗原鉴定。A~C表示CD105、CD29、CD73 高表达,D~F表示CD45、CD11b、CD14 低表达
2.2 普鲁士蓝染色铁标记率计算 荧光显微镜下未标记细胞呈红色,标记细胞胞质内见蓝染的铁颗粒,细胞标记率>95%。随细胞的分裂增殖,细胞内蓝染颗粒逐渐减少(图3)。

图3 荧光显微镜下铁标记率比较。A为未标记hPMSCs 普鲁士蓝染色(×100);B为磁性标记的hPMSCs 普鲁士蓝染色(×100)
2.3 标记后细胞生物学特性比较
2.3.1 细胞活力 24 h后未标记组与标记组细胞的存活率分别为(95.50±0.50)%和(94.69±0.11)%,组间比较差异无统计学意义(χ2=0.245,P=0.63),表明该标记浓度对细胞活力无明显影响。
2.3.2 细胞增殖能力 标记细胞从第1天到第7天增殖曲线趋势与未标记细胞相似,OD值随时间增长而增加。标记组与对照组第1、3、5天OD值差异均无统计学意义(P>0.05),表明该标记浓度在一定时间范围内对细胞增殖能力无显著影响(图4)。
2.3.3 细胞凋亡率 未标记细胞早期和晚期凋亡率分别为5.9%和4.2%,标记细胞早期和晚期凋亡率分别为13.1%和6.0%,两组差异均无统计学意义(χ2=2.85,P=0.91;χ2=0.87,P=0.35,图5),表明该标记浓度对细胞凋亡率无显著影响。
2.4 体外成像MR扫描结果 当标记细胞数量为5×104个时,T2 mapping序列中可见信号降低;当细胞数为1×104个时,在T2*mapping序列中信号即出现差异(表1、图6)。各数量级标记细胞T2、T2*值差异均有统计学意义(P<0.05),R2、R2*值随细胞数量增加呈上升趋势(图7)。
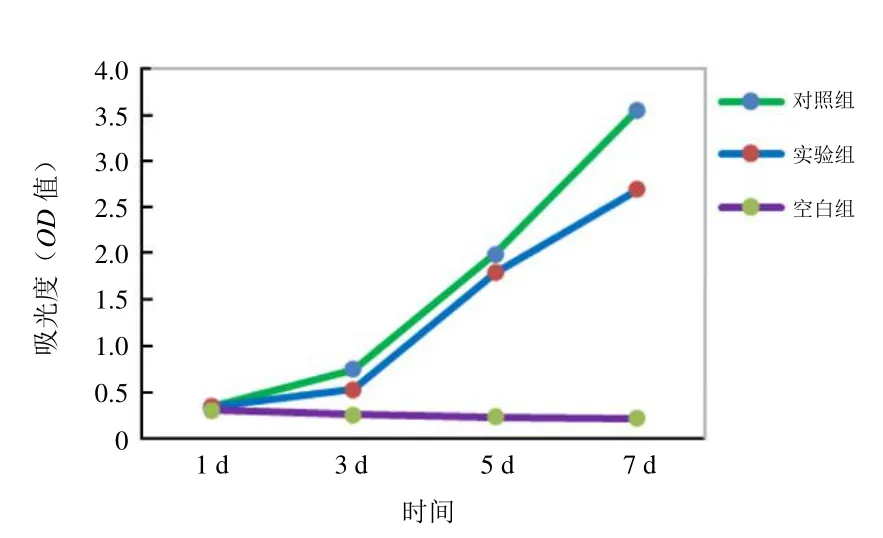
图4 未标记组与标记组细胞增殖能力比较

图5 未标记与标记细胞凋亡率比较。A为未标记hPMSCs凋亡图;B为磁性标记的hPMSCs凋亡图
表1 未标记组与标记组MR弛豫时间比较(±s)

表1 未标记组与标记组MR弛豫时间比较(±s)
细胞数量 未标记组T2 标记组T2 t值 P值 未标记组T2* 标记组T2* t值 P值 1×106 103.58±1.00 46.87±1.26 61.07 0.00 7.56±0.43 3.27±0.09 16.87 0.00 5×105 0.00 1×105 95.91±1.04 88.33±0.25 12.24 0.00 6.38±0.11 4.48±0.15 18.24 0.00 97.24±1.26 70.71±0.30 35.53 0.00 6.44±0.20 4.21±0.10 17.52 5×104 0.02 1×104 102.91±1.04 102.91±1.89 0.00 1.00 7.33±0.10 5.83±0.30 8.11 0.00 97.91±0.76 92.07±0.00 8.03 0.00 6.55±0.20 5.53±0.38 4.08 5×103 0.15 F值 28.27 1016.51 9.14 120.65 100.57±1.00 103.41±1.76-2.43 0.07 6.71±0.45 7.18±0.08-1.80 P值 0.00 0.00 0.01 0.00

图6 MR 不同序列扫描图像。A、B分别为未标记组与标记组细胞T2WI图像;C、D分别为标记组细胞T2mapping、T2*mapping图像
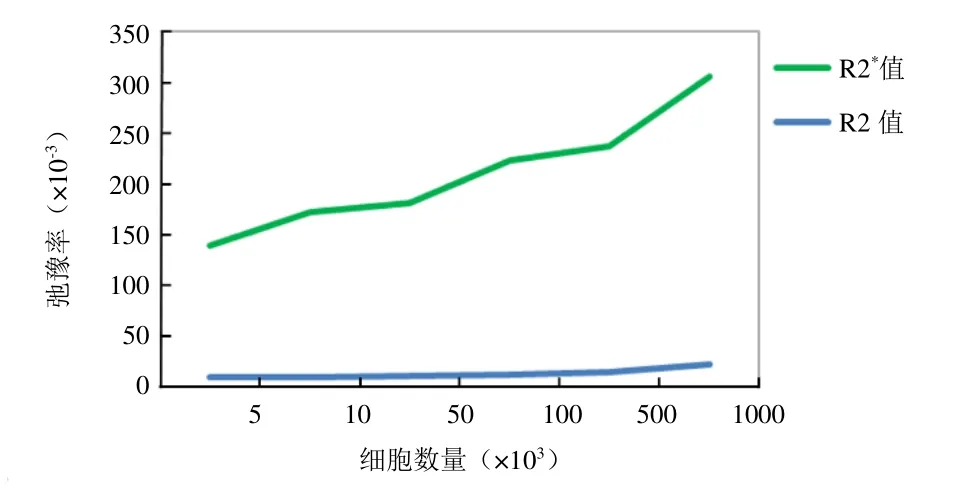
图7 标记组MR弛豫率与细胞数量的关系
3 讨论
目前用于临床研究的干细胞主要来源为骨髓间充质干细胞,但其含量极少,在衰老和疾病状况下细胞数量和分化潜能逐渐下降,且采集过程具有创伤性[5]。因此,对于间充质干细胞新的来源探索具有重要意义。脂肪、脐带甚至婴儿牙齿中均可分离获得间充质干细胞;而胎盘来源的间充质干细胞作为一种临床废弃物获取途径简单,易于体外培养扩增,体内移植免疫排斥反应较小,作为新型药物或基因载体应用于临床成为研究者新的希望[6]。
近年磁性标记各类细胞应用于疾病研究的成像技术逐渐趋于成熟[7-8]。氧化铁颗粒毒副作用小,具有较高的弛豫率,能够产生较强的组织信号对比,有研究采用氧化铁颗粒标记细胞进行广泛的体内外MR 示踪研究[9-11]。USPIO 直径更小、血浆半衰期长于超顺磁性氧化铁颗粒,可生物降解为机体的储备铁进入血红蛋白池代谢,是标记hPMSCs 更理想的MR对比剂[12-13]。然而,USPIO 标记浓度过高会引起细胞内的自由基增加,对细胞产生毒性,抑制细胞生长甚至导致细胞大量死亡;且纳米颗粒在空气中的不稳定性,极易氧化,故较低磁性标记浓度时对USPIO 进行局部修饰有助于增加细胞活性、稳定纳米颗粒并提高标记效率[13]。常用的修饰材料包括葡聚糖、脂质体、分子探针、聚乙烯亚胺及PLL 等[14],其中PLL包被USPIO 形成正电荷复合物,通过静电作用吸附于细胞表面逐渐进入细胞,应用较广泛。本课题组在预实验 中发现PLL浓度过大也会影响细胞状态。当USPIO∶PLL浓度在1∶0.01~1∶0.06时较安全。故本实验最终采用1∶0.03 对USPIO 进行转染,发现PLL-USPIO 终浓度为10 μg/ml 即可有效标记hPMSCs,与其他来源MSCs标记方法类似,但所需铁浓度更低,操作简单高效。
USPIO 标记细胞后造成磁场不均匀加速质子去相位的T2弛豫时间,但对T1弛豫影响较小,故本实验未选择T1WI序列。测量背景磁场不均匀时,T2*mapping 较灵敏[15-16]。因此,既往研究对以氧化铁为基础的分子探针MR扫描时通常选择T2WI、T2mapping和T2*mapping序列。由于信号强度受磁场、脉冲均匀性及TR、TE 等诸多因素的干扰,而弛豫时间相对恒定,反映组织变化更客观,R2*值的测量受磁性标记颗粒大小、回波时间间隔及表观扩散系数的影响,较R2值在定量检测中偏差更小[17]。因此,目前对于磁性标记细胞信号差异的衡量参数普遍为T2、T2*值以及相对应的R2和R2*值。本实验发现3.0T MR 图像质量较好,对信号变化敏感性高,一定数量级磁性标记的hPMSCs 在T2mapping、T2*mapping序列中较同数量级未标记细胞信号值明显降低,T2*mapping序列中104个细胞即可显像,表明T2WI、T2mapping、T2*mapping序列可实现对hPMSCs的体外成像。本实验同时显示磁性标记的hPMSCs的R2值和R2*值随细胞数量增加呈平滑上升趋势,标记细胞的T2、T2*平均值分别为45~105 ms、3~8 ms,对应的R2*值远大于R2值。由于弛豫率越大,信号差别越大,而序列敏感性则更高,故可判断T2*mapping序列在反映信号变化的敏感性及探测的准确性方面较T2WI、T2mapping序列更优越。
总之,采用10 μg/ml PLL-USPIO 对hPMSCs 标记,标记效率较高,且对细胞活性、增殖能力、凋亡率无明显影响。标记后细胞在T2WI、T2mapping、T2*mapping序列均可成功显像。但本实验仅限于hPMSCs的体外MR成像,其在活体内的增殖、代谢及具体作用机制尚需动物实验进一步探究。
志谢:感谢宁夏医科大学总医院干细胞研究所赠予人胎盘间充质干细胞!
