帕金森病患者肠道嗜黏蛋白阿克曼菌各亚型丰度的变化及其临床价值
2020-07-18黄东泉郑文霞谢惠芳彭永正
黄东泉 郑文霞 谢惠芳 彭永正,3
南方医科大学珠江医院1检验医学部,2神经内科,3输血科(广州510282)
帕金森病(Parkinson′s disease,PD)是一种α 突触核蛋白(alpha-synuclein,α-Syn)异常沉积于大脑神经元的神经退行性疾病,其特征是黑质多巴胺能神经元的进行性变形、丢失,在65 岁以上人群中的发病率>1%[1]。由于在PD 患者的肠道神经元中也发现了α-Syn 聚集体,因此一些研究人员推测α-Syn 聚集体首先出现在肠道神经系统,然后从肠道神经元转移到大脑神经元[2]。PD 患者中存在胃肠道功能障碍已经得到公认,并且被认为是发生在出现运动症状之前[3]。肠道菌群及其代谢产物在PD 的发病机制中的作用已经受到越来越多的关注,部分研究证实了PD 的表型与肠道菌群相关[4]。近年来研究发现,PD 患者肠道中嗜黏蛋白阿克曼菌(Akkermansia muciniphila,Akk)的丰度增加[5],这与过往的“Akk 具有修复肠黏膜屏障,降低系统性炎症的作用[6]”结论不相符。这也许是同种细菌的不同菌株对同一宿主发挥着完全不同的作用所致[7]。虽然笔者前期的工作表明Akk 在PD 组和对照组中差异没有显著性意义[8],但PD 患者肠道各亚型Akk 的丰度情况尚未见文献报道。目前对于PD 的临床诊断主要依靠患者表现出的运动症状,包括肢体僵硬,姿势不稳,震颤,动作迟缓,乃至神经精神症状[9],暂无可靠的客观指标。基于上述原因,本研究将探讨Akk 各亚型的丰度变化与PD 的关系,进一步分析Akk 各亚型的丰度变化与血清尿酸(UA),甘油三酯(TG),总胆固醇(TC)和空腹血糖(Glu)等生化指标的关联情况,旨在为PD 的早期诊断提供新型生物标志物。
1 材料与方法
1.1 材料细菌DNA 提取试剂盒,粪便DNA 提取试剂盒购自美基生物(Magen,广州美基生物科技有限公司);RT-qPCR 试剂盒(TB GreenTM Premix ExTaqTM II)购自日本TaKaRa 公司;AkkⅠ,AkkⅡ,Akk Ⅲ特异性引物和内参16S rRNA 引物由赛默飞世尔科技(中国)有限公司合成。引物序列见表1。

表1 引物序列表Tab.1 Primer sequence list
1.2 方法
1.2.1 研究对象收集2018年7月至2019年4月在我院就诊的PD 患者40 例,PD 组纳入标准:(1)根据2015年MDS 版的帕金森病诊断标准确诊的18~85 岁原发性PD 患者;(2)近3 个月内无抗生素或益生菌、益生元使用史。对照组纳入标准:18~85 岁的南方医科大学珠江医院门诊及健康体检中心的体检者。PD 组和对照组一般信息见表2。所有研究对象均签订知情同意书,本研究已经我院伦理委员会审批同意。

表2 PD 组和对照组一般信息Tab.2 General information of PD and control group
1.2.2 生化指标测定收集空腹静脉血于真空采血管(广州阳普公司)中,室温静置30 min 后,3 000 g 离心10 min 分离血清。用罗氏Modular P800 分析仪(瑞士罗氏)及其配套试剂检测血清中UA、TG、TC 和Glu 水平。
1.2.3 粪便DNA 的提取转移100 mg 粪便样品至2 mL 离心管中,立即加入1.2 mL Buffer SSL 至样品中,最高涡旋1 min 充分打散样品。70 ℃水浴10 min。涡旋15 s。室温下,14 000 g 离心10 min。转移250 μL 上清液至新的1.5 mL 离心管中。加入20 μL Proteinase K 和250 μL Buffer AL 上清液中。颠倒混匀10 次。70 ℃水浴10 min。加入250 μL 无水乙醇至样品中,颠倒混匀10 次。把Hipure DNA Mini ColumnⅠ装在2 mL 收集管中。转移混合液至柱子中。10 000 g 离心30 s。倒弃流出液,加入500 μL Buffer GW1 和GW2,重复3次。13 000 g 离心2 min 甩干柱子。加入60 μL 预热至70 ℃的Buffer AE 至柱子的膜中央,室温放置2 min。13 000 g 离心1 min。丢弃DNA 结合柱,将DNA 保存于-20 ℃备用。
1.2.4 单菌DNA 的提取转移0.5 mL 细菌培养液至1.5 mL 离心管中。10 000 g 离心1 min 收集细菌,倒弃培养液。加入200 μL Buffer STE 和10 μL Lysozyme 至细菌沉淀团中。涡旋充分重悬细菌,37 ℃水浴10 min。加入220 μL Buffer DL 和10 μL ProteinaseK 至细菌重悬液中。涡旋混匀,65 ℃水浴消化30 min。加入5 μL RNase Solution 至细菌裂解液中。混匀,室温静置20 min。加入220 μL无水乙醇至裂解液中。最高速度涡旋30 s。把Hi-Pure gDNA Micro Column 装在2 mL 收集管中。把第五步获得的混合液转移至柱子中。10 000 g 离心1 min。倒弃流出液,把柱子装回收集管中。加入500 μL Buffer GW1 至柱子上。10 000 g 离心1 min。倒弃滤液,把柱子装回收集管中。加入650 μL Buffer GW2 至柱子中。10 000 g 离心1 min。倒弃滤液,把柱子装回收集管中。再加入650 μL Buffer GW2至柱子中。10 000 g离心1 min。倒弃流出液,把柱子装回收集管中。10 000 g 离心2 min。将柱子装在新的1.5 mL离心管中。加入40 μL 预热至65 ℃的Buffer TE 至柱子膜中央。放置3 min。10 000 g 离心1 min。丢弃DNA 结合柱,将DNA 保存于-20 ℃备用。
1.2.5 实时荧光定量PCR(RT-qPCR)用于检测粪便中AkkⅠ、AkkⅡ和Akk Ⅲ的相对丰度。先用NanoDrop ND2000c 分光光度计(Thermofisher 公司)测定DNA 的浓度和纯度,再用Roche LightCycler480 PCR 仪检测粪便中AkkⅠ和AkkⅡ,AkkⅢ的相对丰度。反应体系为:Mix 10.0 μL,正向和反向引物各0.8 μL,粪便DNA 2.0 μL,DEPC 水6.4 μL,共20.0 μL。PCR 扩增的条件为:第一阶段Denature 为95 ℃30 s,1 个循环;第二阶段PCR 为95 ℃5 s,60 ℃30 s,40 个循环;第三阶段Melting为95 ℃5 s,60 ℃1 min,1 个循环;第四阶段Cooling 为40 ℃30 s,1 个循环。每份样品重复3 次。各亚型的相对丰度量采用2-△△Ct法进行计算。
1.3 统计学方法采用SPSS 23.0 统计软件进行统计分析,计量数据以()表示。两组间比较分析使用独立样本t检验;多组间均数比较采用单因素方差分析;计数资料比较用χ2检验;连续变量相关性分析用pearson 相关分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 AkkⅠ、AkkⅡ和Akk Ⅲ的引物特异性验证提取三个亚型Akk 的DNA,进行浓度梯度稀释,并进行RT-qPCR。实验结果表明三个亚型Akk引物具有特异性(图1)。
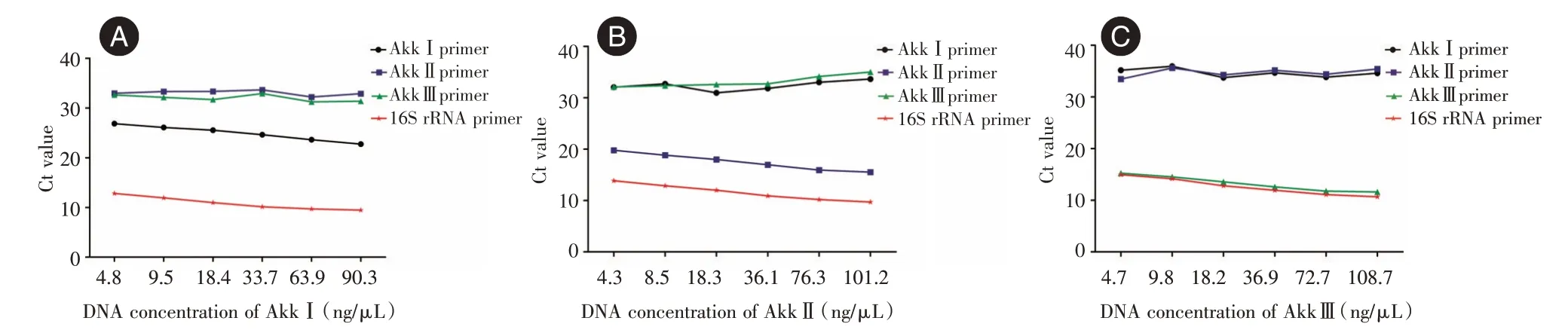
图1 AkkⅠ和AkkⅡ,AkkⅢ引物的特异性Fig.1 Specificity of AkkI and AkkⅡ,AkkⅢprimers
2.2 PD 患者肠道Akk 各亚型丰度的变化在PD组和对照组的肠道中,均表现为AkkⅠ的丰度最高,AkkⅢ的丰度最低(图2A)。不同的是,PD 组中AkkⅠ的丰度明显高于AkkⅡ(P<0.05),而对照组中AkkⅠ和AkkⅡ的丰度没有明显差异(P>0.05,图2A)。随后对比PD 患者和对照组各亚型的Akk 丰度的差异,发现PD 患者肠道AkkⅠ和AkkⅡ的丰度减少,Akk Ⅲ的丰度出现增加(图2B、C、D)。分析其在不同年龄层的差异,发现在65 岁及其以上的PD 患者肠道中AkkⅡ的丰度明显减少(P<0.05,图2F),AkkⅠ和Akk Ⅲ的丰度未出现明显的变化(P>0.05,图2E、G)。
2.3 PD 组和对照组的血清尿酸、血脂和血糖水平比较PD 组血清尿酸,总胆固醇水平明显低于对照组(P<0.05,图3A、B),甘油三酯和空腹血糖与对照组相比差异无统计学意义(P>0.05,图3C、D)。血清尿酸,总胆固醇的异常值(男:UA>420 μmol/L,女:UA>360 μmol/L,TC>6.00 mmol/L)剔除后,发现PD 组血清尿酸水平依然明显低于对照组(P<0.05,图3E),而总胆固醇水平差异无统计学意义(P>0.05,图3F)。
2.4 血清尿酸水平和Akk 各亚型丰度的关系为了探讨各亚型Akk 的丰度是否会影响血清尿酸的水平,将各亚型Akk 的丰度从低到高排序,取前20 例作为Akk 低丰度组,后20 例作为Akk 高丰度组。在PD 组中,AkkⅠ高丰度组的血清尿酸水平明显增加(P<0.05,图4A);在对照组中,两组血清尿酸水平差异无统计学意义(P>0.05,图4A)。AkkⅡ和Akk Ⅲ的丰度的高低对血清尿酸的水平没有影响(P>0.05,图4B、C)。
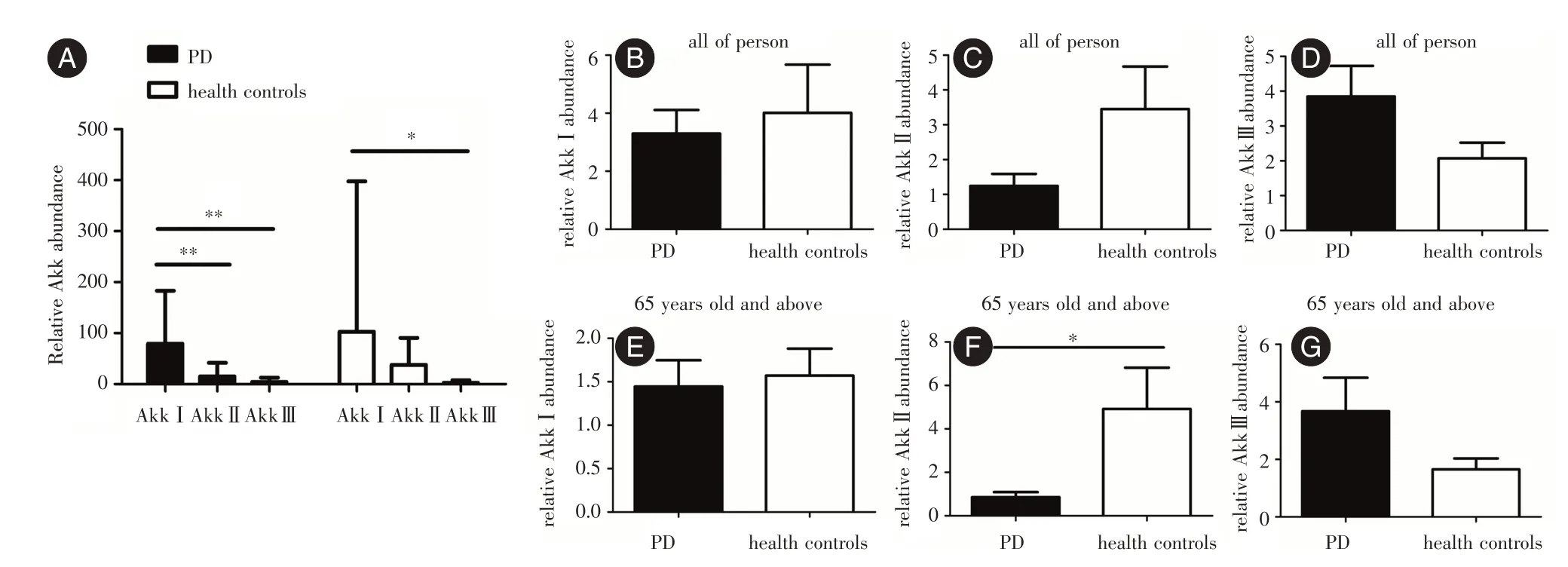
图2 PD 患者肠道Akk 各亚型丰度的变化Fig.2 Abunance changes each subtype of Akk in PD patients
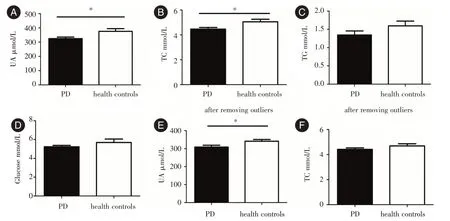
图3 PD 组和对照组的血清尿酸、血脂和血糖水平比较Fig.3 Comparison of serum uric acid,total cholesterol,triglyceride and glucose levels between PD group and control group
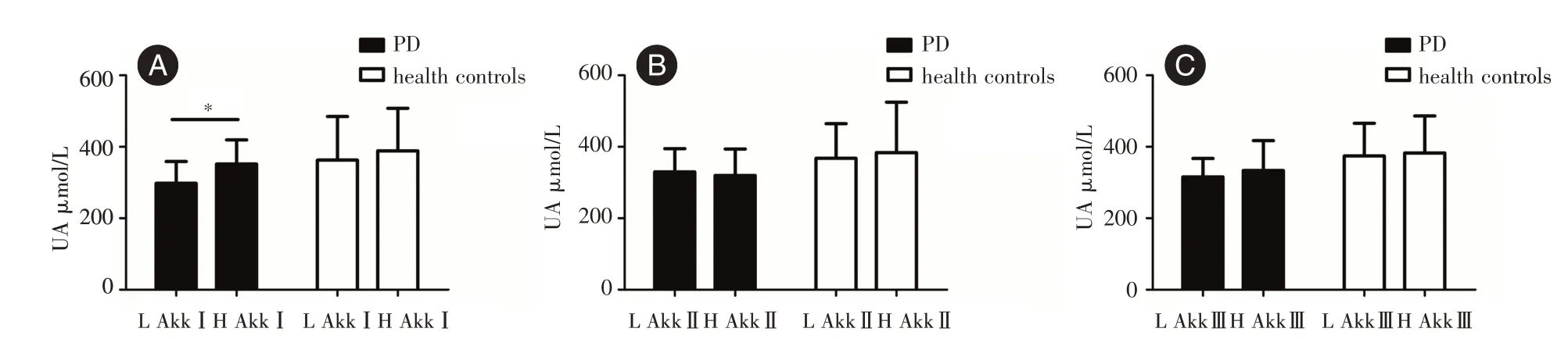
图4 血清尿酸水平和各亚型Akk 的丰度的关系Fig.4 Relationship between serum uric acid level and abundance of each Akk subtype
2.5 肠道AkkⅠ的丰度和血清尿酸水平对PD 患者病程和临床表型的影响鉴于PD 患者血清尿酸水平明显降低,且在PD 组中肠道AkkⅠ高丰度组的血清尿酸水平明显增加,进一步分析肠道AkkⅠ的丰度、血清尿酸水平对PD 患者病程和临床表型的影响,发现在PD 组中,肠道AkkⅠ的丰度和血清尿酸水平呈正相关(P<0.05,图5A)。PD患者病程和肠道AkkⅠ的丰度及血清尿酸水平呈负相关(P<0.05,图5B、C),即肠道AkkⅠ的丰度和血清尿酸水平随PD 患者病程的延长而降低。在PD 组中,将患者血清尿酸水平从低到高排序,取前20 例作为低水平血尿酸组,后20 例作为高水平血尿酸组,探讨肠道AkkⅠ的丰度和血清尿酸水平对PD 临床表型的影响,发现AkkⅠ的丰度、血清尿酸水平与PD 患者出现震颤型或者强直型的表型没有相关性(P<0.05),见表3。

图5 肠道AkkⅠ的丰度和血清尿酸水平对PD 患者病程的影响Fig.5 Effects of intestinal Akk Ⅰabundance and serum uric acid level on the course of PD patients
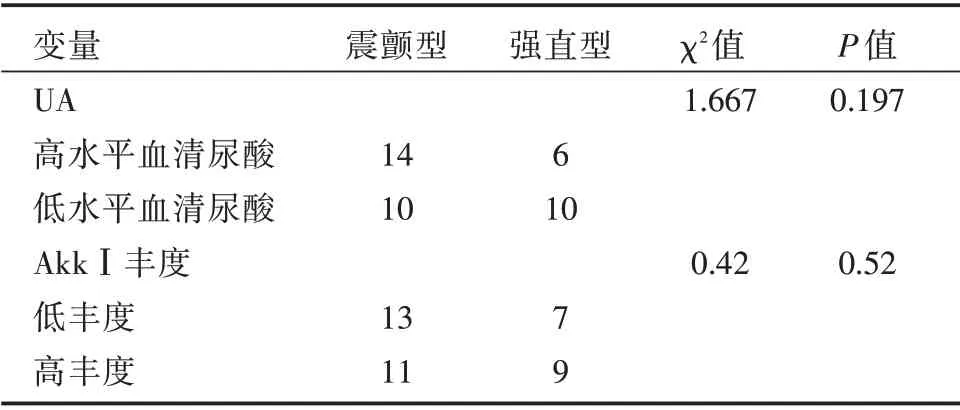
表3 AkkⅠ的丰度和血清尿酸水平对PD 临床表型的影响Tab.3 Effects of AkkⅠabundance and serum uric acid levelon clinical genotypes of PD
3 讨论
本研究率先分离了37 株人肠道Akk,通过测序将其分为Ⅰ~Ⅲ三个亚型,通过PCA 和CAZy 谱分析发现,AkkⅠ、AkkⅡ和Akk Ⅲ的基因组,以及对碳水化合物的代谢存在差异[10],还找到了三个亚型的Akk 的特异性序列,为探讨PD 与各亚型的Akk 的丰度变化的关系奠定了基础。
自发现Akk 以来,许多研究结果都表明Akk 具有修复肠黏膜屏障,降低系统性炎症的作用,并且在多种代谢紊乱的疾病中其丰度明显降低,包括肥胖症、血脂异常和2 型糖尿病[6]。本研究还对各亚型Akk 的功能及其作用机制进行了初步研究。本研究结果表明AkkⅠ亚型(GP01 株)能有效降低系统性炎症,改善糖耐量,缓解高脂饮食带来的代谢紊乱,并抑制小鼠神经退行性病变过程[11]。笔者自主分离的AkkGP01 株分解培养基成分产生乙酸、丙酸和异戊酸等短链脂肪酸(short chain fatty acid,SCFA)的能力强于Akk 模式菌株(ATCC BAA-835,AkkⅠ),而低水平的SCFA 对脑神经元能造成负面影响[11]。SUN 等[12]证明了特定的粪便菌群移植通过TLR4/TNF-α 通路对PD 模型小鼠的神经元起到保护作用。
本研究发现,在健康体检者和PD 患者肠道内Akk三个亚型的相对丰度分布大致相同,AkkⅠ亚型的丰度均为最高,这似乎表明AkkⅠ是Akk在肠道中行使菌群功能的主力军。虽然本研究没有发现各亚型的Akk的丰度在PD患者肠道中出现明显的变化,但发现在65岁及其以上PD患者肠道AkkⅡ的丰度出现明显降低(P<0.05)。鉴于PD在65岁以上的老人中病发率较高[1],未来将扩大65岁以上的老人的样本量来进行实验分析,重点关注AkkⅡ的作用机制,进一步探讨Akk各亚型与PD之间潜在的关系。
尽管PD 的发病机制尚不清楚,但氧化应激一直是PD 发病机制的研究热点[13]。越来越多的证据表明,氧化应激可能损伤神经元,而血清尿酸水平与氧化应激密切相关[13]。血清尿酸是体内天然的抗氧化剂,具有清除自由基和抗氧化的作用[14]。多项研究结果显示,较高水平的血清尿酸有助于降低PD的发病率[15]。本研究也发现PD组血清尿酸水平明显低于对照组,并且在PD组中AkkⅠ丰度的高低与血清尿酸水平呈正相关,AkkⅠ的丰度增高可以提高PD 患者血清尿酸的水平。AkkⅡ和Akk Ⅲ的丰度的高低与血清尿酸水平似乎没有相关性。LU等[16]发现,经胃旁路及袖状胃切除术后,测序结果表明大鼠肠道Akk 的丰度增加,并且同时伴随血清尿酸水平明显下降,这也表明了Akk 的丰度可能会影响血清尿酸的水平。血清尿酸水平还与PD 患者的病情有关,早期和中期PD 患者的血清尿酸水平明显高于晚期患者;预后良好PD 患者血清尿酸水平明显高于预后差的患者[17]。庄顺芝等[18]发现病程>3年的PD 患者血清尿酸水平明显低于病程>3年的PD 患者。有试验证明长期口服尿酸盐的前体——肌苷可以增加血清尿酸水平,并且可能以剂量依赖的方式改善PD 患者的病情[19]。本研究发现血清尿酸水平随着PD 患者病程的延长而减少(图5B),另外还发现AkkⅠ同样随着PD 患者病程的延长而减少(图5C),其中的机制可能是PD 患者肠道中AkkⅠ的丰度出现进行性减少,导致血清尿酸的水平减少,氧化应激增加,损伤的神经元增加。这种推测基于笔者前期研究证实了AkkⅠ抑制小鼠神经退行性病变[11]。PD 患者的肠黏膜屏障受损、微生物易位标记增强、细菌内毒素特异性配体TLR4,CD3+T 细胞表达增加,同时结肠活检样本呈现出较高的促炎基因谱[20]。未来将通过动物实验进一步探讨AkkⅠ的丰度与PD 的关系。目前对PD 的诊断主要取决于临床表现而缺乏客观的指标,这不利于早期诊断。血清UA 水平和PD 有密切联系,但其本身不足以作为PD 的诊断标准[21]。
综上所述,本研究首次利用RT-qPCR 方法快速分析肠道内Akk 三个亚型分布,发现在PD 组中,患者肠道AkkⅠ的丰度与血清尿酸水平呈正相关。PD 患者的病程与AkkⅠ的丰度、血清尿酸水平呈负相关;肠道低AkkⅠ丰度和低血清尿酸水平可能作为联合指标,为PD 的早期诊断提供新型生物标志物。肠道AkkⅠ丰度及其代谢产物与PD、血清尿酸水平的关系,以及AkkⅡ丰度与PD 的关系都有待进行深入研究。
