原发性高血压合并冠心病ACE I/D基因多态性与胱抑素C的相关性
2020-07-18徐先琳张斌强钱航陈琴华朱军李小雷陈继舜
徐先琳 张斌强 钱航 陈琴华 朱军 李小雷 陈继舜
1锦州医科大学国药东风总医院研究生培养基地(湖北十堰442008);2湖北医药学院附属东风医院(湖北十堰442008);3武当特色中药研究湖北省重点实验室(湖北十堰442008)
高血压和冠心病是最常见的心血管疾病,当原发性高血压合并冠心病时,因血管内皮功能障碍、氧化应激、遗传基因突变等因素所导致的靶器官损害更成为了预后不佳的危险因素之一,其中遗传基因突变在原发性高血压及冠心病的发生和发展中占据重要地位。位于血管紧张素转换酶(angiotensin converting enzy-me,ACE)基因第16 内含子存在I/D(插入/缺失)多态性,可扩增出480 bp(插入片段)和191 bp(缺失Alu 片段)两种长度片段,构成II、DD、ID三种基因型,已有研究表明,ACE I/D 基因多态性作为遗传基因标志可为评价心血管疾病的危险因素和识别易感人群提供依据[1]。传统的观点认为胱抑素C(Cys-C)是评价肾小球内皮功能障碍的标志,对急、慢性肾脏病有一定的预测价值[2],但实际Cys-C 也参与动脉粥样硬化的病理生理过程[3-4]。Cys-C 可由心肌细胞产生和分泌,在心肌缺血时合成增多,通过影响血管壁的完整性和重塑性影响血压[5],Cys-C 通过自嗜通路对抗细胞死亡,对动脉粥样硬化斑块有预测作用[6],提供冠心病患者心血管危险的有效信息,Cys-C 升高会增加发生急性冠脉综合征的风险[7]。目前国内外缺少ACE基因多态性与Cys-C 相关性的研究,但ACE I/D 基因多态性与Cys-C 均与血管内皮障碍有着密切的联系。综上,本研究的目的是通过在原发性高血压合并冠心病患者中,分析ACE I/D 基因多态性与Cys-C 之间的可能关系,为临床评估原发性高血压合并冠心病时所致靶器官损害提供思路。
1 资料与方法
1.1 一般资料选取2018年1月至2019年7月于国药东风总医院心内科住院的18~75 岁患者共计282 例为研究对象,其中172 例纳入高血压合并冠心病(高血压+冠心病)组,男100 例,女72 例,平均(56.51±9.62)岁,设为实验组;110 例选入单纯原发性高血压(高血压)组,男63 例,女47 例,平均(55.60±8.62)岁,设为对照组。入选患者均符合《中国高血压防治指南2018》的高血压诊断标准:(1)未使用降压药物情况下,非同日3 次测量患者血压,收缩压≥140 mmHg 和(或)舒张压≥90 mmHg;(2)有明确的高血压史,目前正服用降压药的情况下,血压虽然低于140/90 mmHg 亦可诊断。合并冠心病患者均为于我院行冠状动脉造影检查明确诊断(冠脉主干狭窄>50%)。
1.2 排除标准(1)继发性高血压、原发性肾脏病伴有高血压,如肾性高血压、肾血管性高血压及内分泌疾病引起的高血压;(2)合并糖尿病、家族遗传疾病、恶性肿瘤、慢性消耗性疾病和严重肝肾功能不全等;(3)慢性肾炎、遗传性肾病、继发性肾病、尿路感染等其他影响肾功能的疾病;(4)心力衰竭、严重心脏瓣膜病、心肌病、恶性心律失常等。
1.3 仪器和试剂由三力医用科技有限公司提供的K2 乙二四乙酸(EDTA)抗凝真空采血管;TIANGEN 血液基因组DNA 提取试剂盒;博日实时荧光定量PCR 仪9600plus;美国Thermo Heraeus Pico 17/21 微量离心机;宏灏基因ACE(I/D)基因多态性检测试剂盒(PCR-荧光探针法)。
1.4 实验方法
1.4.1 标本采集采集各组研究对象清晨空腹静脉血3~5 mL,分离、保存血清,于国药东风总医院检验科测定血生化指标,同日留取清晨中段尿5 mL,于检验科测定肾功能指标。总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDLC)、低密度脂蛋白胆固醇(LDL-C)、尿素(UREA)、肌酐(CREA)、肾小球滤过率(GFR)、Cys-C、尿蛋白定量(UPRO)采用雅培C16000 仪测定,尿微量白蛋白(UMA)、24 h 尿微量白蛋白排泄率(24HUAE)、尿微量白蛋白/尿肌酐比(UACR)采用普门ACR 仪测定。记录患者体质量指数(BMI)、平均收缩压(SBP)、平均舒张压(DBP)。
1.4.2 ACE 基因I/D 基因多态性检测(1)采取同日清晨空腹外周静脉血5 mL,于含有EDTA 抗凝管中密封,4 ℃保存待测;(2)按照TIANGEN 血液基因组DNA 提取试剂盒说明方法提取DNA;(3)紫外分光光度计(pharmacia biotech)测定DNA水平,基因组DNA 浓度应>20 ng/μL,A260/A280比值应介于1.7~2.0;(4)取2 μL 提取DNA 样品加入宏灏个体化基因核酸检测试剂反应液中上荧光定量PCR 仪检测,PCR 程序设定为:37 ℃,1 min;95 ℃,5 min;95 ℃,15 s,60 ℃,30 s,40 个循环。(5)结果判读以空白对照的荧光曲线无Ct 值,阳性对照Ct 值≤34 判定结果有效,ACE 基因型别判读方式为FAM 通道无Ct 值或Ct 值≥38,VIC 通道Ct 值≤34 为II 基因型;FAM 通道Ct 值≤34,VIC 通道Ct 值≤34 为ID 基因型;FAM 通道无Ct 值≤34,VIC 通道无Ct 值或Ct 值≥38 为DD 基因型。
1.5 统计学方法采用SPSS 17.0 统计软件进行统计学分析。符合正态分布的计量资料(年龄、BMI、TG、TC、HDL-C、LDL-C、24hSBP、24hDBP、UREA、CREA、GFR、UPRO、UACR、Cys-C、UMA)用均数±标准差表示,两组比较采用t检验,3 组比较用方差分析。计数资料(性别、吸烟史)用频数表示,两组和三组比较均采用χ2检验。偏态分布的资料(24HUAE)用中位数(95%CI)表示,3 组比较采用秩和检验。应用χ2检验对Hardy-Weinberg平衡进行验证。基因型频率与等位基因频率采用卡方检验。均以P<0.05 为差异有统计学意义。
2 结果
2.1 ACE I/D 等位基因频率比较单纯高血压组和原发性高血压合并冠心病组的年龄、吸烟史、BMI、血脂等一般资料差异无统计学意义(P>0.05)。DD、ID、和II 基因型分布符合Hardy-Weinberg 遗传平衡定律(χ2=0.496,P=0.78),具有群体代表性。DD、ID、II 以及I、D 等位基因频率在两组间的分布差异有统计学意义(χ2=9.193,P<0.05),高血压+冠心病组的DD 基因型及D 等位基因频率明显高于高血压组,见表1。
2.2 ACE 基因型分组资料比较原发性高血压合并冠心病中根据ACE I/D 基因型分组的一般资料比较:DD 型、ID 型、II 型一般临 床资料比较UREA、CREA、GFR、UPRO、UACR 等差异无统计学意义(P>0.05),Cys-C(P<0.01)、UMA、24HUAE差异有统计学意义(P<0.05),见表2。DD 型组Cys-C、UMA 值明显高于ID 型、II 型组。

表1 单纯原发性高血压组与原发性高血压合并冠心病组ACE 基因型及基因频率比较Tab.1 Comparison of ACE genotype and gene frequency between primary essential hypertension and essential hypertension combined with coronary heart disease 例(%)
表2 原发性高血压合并冠心病中根据ACE I/D 基因型分组的一般资料及Cys-C、肾功能比较Tab.2 Comparison of general data and biochemical indicators in patients with essential hypertension combined with coronary heart disease grouped by ACE genotype ±s
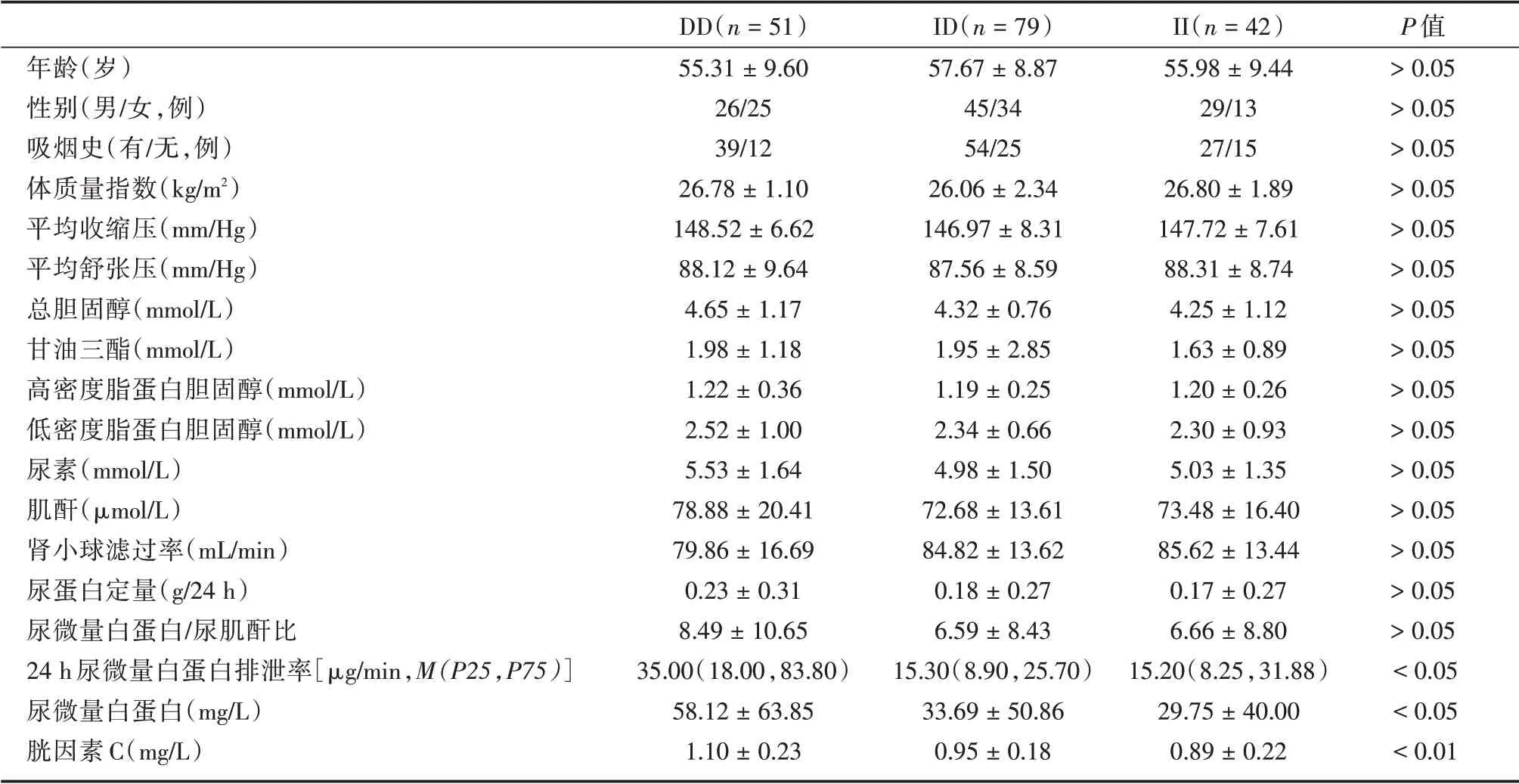
表2 原发性高血压合并冠心病中根据ACE I/D 基因型分组的一般资料及Cys-C、肾功能比较Tab.2 Comparison of general data and biochemical indicators in patients with essential hypertension combined with coronary heart disease grouped by ACE genotype ±s
年龄(岁)性别(男/女,例)吸烟史(有/无,例)体质量指数(kg/m2)平均收缩压(mm/Hg)平均舒张压(mm/Hg)总胆固醇(mmol/L)甘油三酯(mmol/L)高密度脂蛋白胆固醇(mmol/L)低密度脂蛋白胆固醇(mmol/L)尿素(mmol/L)肌酐(μmol/L)肾小球滤过率(mL/min)尿蛋白定量(g/24 h)尿微量白蛋白/尿肌酐比24 h 尿微量白蛋白排泄率[μg/min,M(P25,P75)]尿微量白蛋白(mg/L)胱因素C(mg/L)DD(n=51)55.31±9.60 26/25 39/12 26.78±1.10 148.52±6.62 88.12±9.64 4.65±1.17 1.98±1.18 1.22±0.36 2.52±1.00 5.53±1.64 78.88±20.41 79.86±16.69 0.23±0.31 8.49±10.65 35.00(18.00,83.80)58.12±63.85 1.10±0.23 ID(n=79)57.67±8.87 45/34 54/25 26.06±2.34 146.97±8.31 87.56±8.59 4.32±0.76 1.95±2.85 1.19±0.25 2.34±0.66 4.98±1.50 72.68±13.61 84.82±13.62 0.18±0.27 6.59±8.43 15.30(8.90,25.70)33.69±50.86 0.95±0.18 II(n=42)55.98±9.44 29/13 27/15 26.80±1.89 147.72±7.61 88.31±8.74 4.25±1.12 1.63±0.89 1.20±0.26 2.30±0.93 5.03±1.35 73.48±16.40 85.62±13.44 0.17±0.27 6.66±8.80 15.20(8.25,31.88)29.75±40.00 0.89±0.22 P 值>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05<0.05<0.05<0.01
2.3 ACE 基因型中Cys-C 异常频率分布根据Cys-C 水平分组分析原发性高血压合并冠心病中ACE I/D 位点不同基因型的频率分布:以Cys-C=1.03 mg/L 为临界值,将高血压+冠心病患者分为Cys-C>1.03 组和Cys-C≤1.03 组,DD 基因型在Cys-C>1.03组中的分布频率更高(χ2=8.47,P<0.05),见表3。
2.5 ACE I/D 等位基因预测Cys-C 水平的相关ROC 曲线曲线下面积为0.662,差异有统计学意义(P<0.05),D 等位基因存在时对Cys-C 升高有一定预测意义,见图1。
3 讨论
我国原发性高血压及冠心病的患病率逐年升高,当两种疾病合并时不仅会严重影响患者的生活质量,而且随之而来的靶器官损害也会增加不良事件发生率,因此从遗传基因突变角度结合特异性临床检测指标对靶器官损害的评估具有重大意义。动脉粥样硬化是原发性高血压及冠心病共同的病理基础,有研究表示,控制危险因素是预防动脉粥样硬化的有效手段[8]。
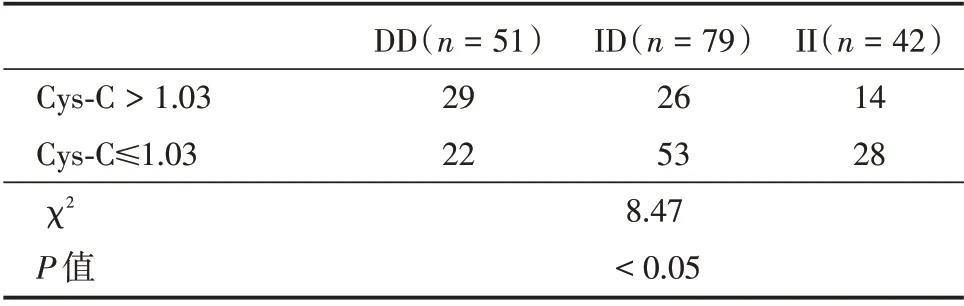
表3 原发性高血压合并冠心病不同ACE 基因型组Cys-C正常频数及异常频数比较Tab.3 Comparison of normal and abnormal frequency of Cys-C in different ACE genotypes of essential hypertension combined with coronary heart disease 例

图1 ACE I/D 等位基因预测Cys-C 水平的相关ROC 曲线Fig.1 ROC curve of ACE I/D allele in predicting cystatin level
本次研究中,高血压合并冠心病组的DD 基因型、D 等位基因频率均高于单纯高血压组,D 等位基因可能是冠心病发病的危险因素。经典观点中,ACE 作用于血管紧张素Ⅰ之后生成的血管紧张素Ⅱ(AngⅡ)是一种强有力的血管收缩剂和醛固酮促分泌剂[9],通过刺激血管平滑肌细胞中的G 蛋白以及肾上腺皮质的醛固酮分泌而升高血压、加重冠状动脉内皮细胞的损伤[10]。ACE I/D多态基因造成了mRNA稳定性改变,进一步调节ACE的表达与分泌,DD 基因型正是由于缺失相关序列导致了转录时ACE 基因的活化与高表达[11]。与Ⅱ基因型相比,DD基因型的血浆ACE水平更高,这不仅增强了RAAS系统作用,加重血管内皮损伤,使心血管疾病发生率增加[12],而且能够抑制缓激肽诱导的组织血纤维蛋白溶酶原激活剂(tPA)释放,诱发血栓形成和心肌梗塞[13]。因此,虽然ACE 多态基因在基因调控层面的具体机制尚不清楚,但与DD 基因型相关的心血管风险增加可能是通过内皮细胞损伤、RAAS激活、凝血功能异常、血栓形成等复杂机制所介导。在老年高血压患者的研究中发现,DD 基因型者血管性假血友病因子和血栓调节蛋白水平升高,提示血管内皮细胞损伤在DD 基因型患者中增强[14]。而在另一项大样本对照试验中的分析发现,DD 基因型作为一种危险基因型,使东亚人发生左心室肥厚的几率增加59%[15]。
本研究中,高血压合并冠心病的DD 基因型组的Cys-C 水平较ID 型、II 型更高,且DD 基因型可能对Cys-C 升高有一定预测意义,考虑Cys-C 水平可能与ACE I/D 基因有着一定的相关性。在血管损伤过程中,炎性细胞因子的产生增加,进而刺激弹性水解半胱氨酸蛋白酶的产生,Cys-C 则作为蛋白酶抑制剂调节蛋白酶的活性,在组织重塑中起着重要的功能[16]。国外学者表示,体内自噬作用的失衡正是动脉粥样硬化进展的特征,而Cys-C 则在自噬中起调节及抗动脉粥样硬化的作用[17]。近年来越来越多的数据显示,Cys-C在评价冠心病发病、预后等方面具有较高价值,Cys-C升高心血管疾病的死亡率也随之增加[18]。DONG 等人的结果表明,Cys-C>1.055 mg/L可用于预测急性缺血性脑卒中后短暂脑缺血发作的发生发展[19],也有研究认为血清Cys-C水平与亚临床动脉粥样硬化密切相关[20]。Cys-C的升高可作为判断糖尿病患者心血管疾病风险的一个有价值的代表指标[20]。除此之外,笔者也发现相较于II 基因型和ID 基因型,DD 基因型患者的UMA、24HUAE 水平也较其他两组高,已有研究表示UMA 升高时发生冠心病的几率比UMA 正常时高4 倍[21],在心血管病患者药物治疗期间,减少24HUAE 水平会降低心血管事件的发生率[22]。可见UMA、24HUAE 与心血管疾病也存在着紧密的联系,内皮功能障碍和慢性炎症、肾小球滤过膜的损害、经血管渗漏的大分子物质增加是解释Cys-C、UMA、24HUAE 与冠心病、高血压等心血管疾病之间的关联的重要候选条件[23],DD 基因型患者的RAAS 系统作用更强,因此各病理因素所致的UMA、24HUAE 水平可能也随之升高。近期一项研究证明,在妊娠高血压的早期肾损害中,Cys-c 与UMA 联合检测较单一检测更能提高诊断效率[24]。国内也有研究认为Cys-c 联合斑块评分可以提高筛查严重冠心病的能力[25]。但以往的研究未从遗传基因层面进行探讨,本研究不仅证明了ACE I/D 基因与Cys-c的相关性,而且可见ACE I/D基因与Cys-c、UMA、24HUAE 联合检测用于评估原发性高血压合并冠心病的病情进展是具有现实意义的。
本研究可能存在样本量偏小、生化指标尚不全面等问题,而且国外有学者表示自噬活动与动脉粥样硬化进展存在反向关联,随着氧化应激的时间延长,自噬活动减弱[26],可能在一定程度上影响了Cys-c 水平。未来的研究中我们仍需继续随访评估不同ACE 基因型患者病情进展与Cys-c 的变化。综上所述,ACE 基因多态性从遗传基因水平对高血压、冠心病的易感人群进行早期预测,而Cys-C 作为冠心病的预测因子,也与ACE 基因多态性有着一定相关性,因此我们认为这种相关性或许可以更准确的反映高血压合并冠心病时的靶器官损害水平,辅助我们在临床工作中对患者提供更为准确的诊断以及合理有效的治疗。
