13CO2示踪不同化学形态氮素添加对高寒草甸植物光合碳分配的影响
2020-07-17宋明华于飞海
宋明华,陈 锦,蒋 婧,王 枫,于飞海
1 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室, 北京 100101 2 中国科学院大学, 北京 100049 3 江苏丘陵地区南京农业科学研究所, 南京 210046 4 内蒙古赤峰市产品质量计量检测所,赤峰 024005 5 台州学院浙江省植物进化生态学与保护重点实验室, 台州 318000
青藏高原的高寒草地大部分由嵩草类植物占据优势,这类植物地上呈密集的丛生型,盖度很高,而地下发育着密集的根系,往往形成致密的草毡层[1]。嵩草草地范围从海拔3000 m至5900 m均有分布[1],覆盖面积约为421591 km2[2],占整个高原面积约三分之一,储藏着大量的土壤有机碳。如此大的碳储量源于植物将大量的光合作用固定的碳输入到土壤[3],同时较长的旱季和冷季也使固持的有机碳较长时间滞留于土壤中,周转缓慢[4]。当土壤碳截存的状态受到环境变化的干扰时,土壤中的碳就会被快速和大量地释放到大气中。土壤碳库的微小变化将会引起大气中二氧化碳的剧烈变化[5]。
由于低温和土壤养分(尤其是低有效氮(N))的限制,高寒草甸生态系统的初级生产力很低[4]。施肥(N肥等)成为改善青藏高原的饲草质量、提高地上生产力的经营方式之一[6- 7]。此外,根据IPCC(2010)的报告,全球大气氮沉降增加的同时,青藏高原的氮沉降量也逐渐增加。肥料(N肥)的使用和大气氮沉降的增加等引起土壤有效氮的增加,而土壤有效氮素的提高会引起植物群落物种组成的改变,如禾草类植物增加,逐渐取代嵩草类植物的优势地位,而禾本科植物对植物群落生物量有较大的贡献[8];禾草与杂草类植物在群落中的比例也发生了变化,物种丰富度会随着生产力的增加而降低。另外,增加氮输入会引起植物光合碳(C)的增加,也会改变植物向地下输入的C量,进而通过根系分泌物、根际碎屑等活性碳激发土壤原有有机质的分解。氮输入会引起植物群落结构上的改变,植物群落的这些变化最终会影响植物光合碳在地上和地下碳库中的分配,进而影响土壤碳库动态与截存。此外,氮的长期输入还会引起土壤微生物组成及类群的变化,这些变化会直接影响微生物的活性进而影响有机质的分解。
除了氮素输入剂量对光合碳分配及土壤碳动态的影响外,氮素输入的化学形态也会通过对植物群落和土壤微生物组成的影响进而作用于碳动态的变化。已有研究表明输入低剂量N能够增加植物凋落物的输入,进而提高N匮乏的生态系统的碳固持量[9- 11]。同时,高剂量N输入引起莎草草甸[12]、泥沼[13]和一年生草地[14]的碳排放量的增加。目前,关于不同形态氮素的长期添加对草地植物的光合C在植物-土壤系统各碳库中的分配以及动态变化的影响的研究较少。一般而言,群落中的优势物种会优先利用土壤中含量较高的化学形态的氮素[15]。尽管不同植物物种对不同形态氮素利用存在偏好,但是植物对不同化学形态的氮素吸收利用具有一定的可塑性[16]。因此,不同化学形态的氮素输入可能会引起群落内不同养分利用方式的植物的响应方式不同,进而引起群落结构的变化。因此探寻草地生态系统地上、地下生态过程对不同形态氮素添加的敏感性,阐明不同形态氮素的长期添加对草地光合C动态的影响和作用机制,能够为制定草地科学合理的经营管理方式,实现资源可持续利用提供理论依据。
基于青藏高原海北高寒草甸生态系统研究站已经开展10年的不同化学形态氮素长期输入的实验,利用13CO2示踪技术,量化氮素添加处理下光合碳在植物地上组织、地下根及土壤中的分配,以及土壤呼吸中释放的CO2。回答以下科学问题:(1)不同形态不同剂量N输入引起高寒草甸土壤C储量的变化如何?(2)长期N输入引起光合碳在植物组织、土壤中分配量的变化如何?(3)植物光合碳分配模式与土壤呼吸释放CO2-C的关系如何?
1 研究地概况
研究地位于中国科学院海北高寒草甸生态系统定位研究站(简称海北站,37°37′ N,101°19′ E,海拔3200 m)。该站位于青藏高原东北隅,祁连山北支冷龙岭东段南麓的大通河谷。气候是高原大陆性季风气候,仅有冷、暖两季之分,年平均气温-1.7℃,夏季温暖多雨,冬季寒冷干燥,7月平均气温9.8℃,1月平均气温-14.8℃。年均降水量约580 mm,植物生长季(5—9月)集中了全年降水的80%[17]。
研究区域的优势物种为矮嵩草(KobresiahumilisSerg)和异针茅(StipaalienaKeng)、垂穗披碱草(ElymusnutansGriseb)。植被覆盖率超过95%[18]。该地区土壤为高山草甸土、高山灌丛草甸土和沼泽土[19]。该地区土壤有机质和全量养分丰富,但速效养分很低 (表1)。 高寒草甸土壤总氮含量较高,但有效氮含量匮乏[20]。因其降水量80%分布于植物生长季的5—9月,所以在6—8月间,土壤水分含量较高,能保证植物的生长需求。
2 研究方法
2.1 样地布设和实验设计
自2005年,在青海海北站选取60 m × 80 m大小的一片均匀一致的草地作为实验样地,此样地自设置起用围栏围封,不存在大型家畜,如牦牛、羊等的采食。该实验采用完全随机化区组设计,设置3个裂区,每个裂区10个样方,样方大小为2 m × 2 m,共30个。任何相邻两个样方间隔1 m。样方内植被与样方外植被的分割采用高为30cm的铁皮沿样方四周打入地下25cm,地上部分保留5cm。添加的氮素化学形态是:铵态氮(Am)、硝态氮(Ni)、NH4NO3(AN),氮素添加剂量是低(L,0.375 g N m-2a-1)、中(M,1.5 g N m-2a-1)、高(H,7.5 g N m-2a-1)3个氮浓度的正交实验,共9个处理,记作AmL,AmM, AmH, NiL, NiM, NiH, ANL, ANM, ANH,另设置一个对照CK。每种处理3个重复。每年7月初和8月初各施肥一次,每次施肥量是总剂量的1/2。将相应剂量氮化合物溶于5 L水中,用喷壶均匀洒于对应的样方内,对照只洒5 L水。3种形态氮素所对应的化合物试剂分别为(NH4)2SO4, NaNO3和NH4NO3。
该实验基于上述长期氮素添加实验。实验开展后第6年的研究结果表明,低、中剂量的氮素添加没有引起群落物种组成和地上生物量的显著变化[18],而高剂量氮添加处理下植物群落地上生物量和土壤微生物量氮及土壤理化性质发生了显著变化(表1)。考虑到试验费用和操作时间上的可行,该实验仅选取其中3种氮形态的高浓度和对照4种处理开展13C-CO2的标记实验,即AmH, NiH, ANH, CK。总共12个样方。实验于2014年8月1日开始,于8月31日结束。

表1 不同化学形态氮素长期输入对土壤理化性质的影响
2.2 13C脉冲示踪实验
实验于8月1日至8月31日期间进行,在高氮处理及对照每个2 m×2 m的样方内选取两个40 cm×40 cm的小样方,其中一个用于13C示踪实验,另一个为对照样地。用于对照处理的小样方其4个角用木棍做好标记;用于示踪的小样方沿着小样方的四个边外侧挖开至2 cm深左右,将立体金属架安置在槽内,金属架大小为40 cm×40 cm×30 cm(长、宽、高);在实验开始的前一天下午,将塑料薄膜包裹在立体架外面,并将底部沿4个边埋入槽内,用湿土把薄膜盖好,避免漏气。箱壁插入地面5 cm深,并用孔径为45 μm的尼龙网裹住,尼龙网延伸至地面下10 cm深,以便隔断来自标记箱外的植物根系,而养分和水分可以相互交换。箱的内表面抹上防雾剂来降低标记过程中水蒸汽浓度,从而增加光强和降低13CO2溶解在箱内表面水滴中的量。标记选在晴朗的天气中午10:00,CO2(99 at%13C)被储藏在高压瓶内,通过降压阀和直径4 mm的进气管输入箱内,流速为0.125 L/min,并用流量计测量流量。密闭箱上部侧面安装了两个风扇,用于降低内部温度。为了消除CO2浓度对植物光合过程的影响,需将实验中的CO2浓度控制在大气CO2浓度或者略高于大气中的CO2浓度范围内。13CO2输入1 h后停止,箱保持密闭状态再持续5 h[21]。气体输入流量和标记时间根据以往观测的光合速率和地下生产力来确定,确保植物地上茎、叶和地下根系样品有足够高的13C丰度[22]。
2.3 植物组织取样
在标记后第1,6,14,21,30天,气体取样同时收获植物样品,将植物地上部分贴地面剪下,仅绿色茎和叶用于13C分析。植物取样时将植物地上茎和叶混匀后随机取样,代表整个群落水平的物种组成。植物根系在采集土壤样品同时采集,根系放在孔径为0.5 mm的筛子内仔细清洗,去除吸附的土壤和暗棕色/黑色碎屑物质。茎、叶和根样品在70℃下48h烘干,用于测量植物生物量、植物样品中13C、C含量指标。
2.4 土壤呼吸取样
预计在示踪后第1,6,12,24小时和第4、7,15和30天收集土壤呼吸释放CO2。在13C示踪后的实际取样过程中,第1,6,12,24小时进行了呼吸取样,而13C示踪后的第4天下雨,为了减少降雨的干扰,我们将取样时间推迟到第6天,随后的取样时间大体按照14、21、30d进行,推后的时间也控制在1d之内。由于根系取样是在第1,6,14,21,30天,所以土壤呼吸样品13C的测定也抽取相应时间点上的样品进行了分析。样品收集采用2种不同型号的透明PVC箱,大箱高15 cm直径20 cm,用于收集植物-土壤系统呼吸释放的CO2。这些箱内植被地上部分保留,用于测定生态系统呼吸。小箱的高为25 cm直径5 cm,这些箱放置的位置植被地上部分被收获,用于测定植物根与微生物呼吸。每个箱的顶部有一个用橡皮塞密封的孔用于针头取样。每个箱内抽取70 mL气体立即注射进铝-塑料组合的气袋内(TPV-005,Dalian Delin Gas Packing Co.,Ltd.,Dalian,China)用于分析呼吸释放CO2-13C。每一次取样同时在距地面2 m高用注射器取大气样品作为13C的对照测定。
2.5 土壤样品取样
在标记后的第1,6,14,21,30天,用直径5 cm、深度20 cm的土钻在每个样方内的2个小样方取6份土,将同一样地收集的土壤样本混合成一个复合样本,并通过一个2mm的筛子将根系和粗石清除后,筛选出的土壤放入在4℃保存,并将其转移到实验室用于后续的测量,风干后分析总C和13C。此外,用环刀在每个样方内取得土壤样品,测得土壤容重指标。
2.6 植物和土壤样品的有机碳、氮含量及其 δ13C的测定值
其分析的基本原理和测定过程是:样品经高温燃烧后(氧化 /还原炉温度为 950℃),通过 TCD (Thermal Conductivity Detector)检测器测定有机碳、氮含量,剩余气体进入 ConFlo IV 导入稳定同位素质谱仪,在质谱仪上测定 δ13C值(Delta Plus, Thermo Fisher Scientific, Bremen, Germany)。在计算时,将刚刚标记完的茎和叶内13C的量视为标记过程中植物固定的全部13C,样品中13C的回收率为其他时间点的样品中13C的值除以刚标记完的植物茎和叶内13C的量。植株(根系和地上部)和土壤中13C含量的计算如下:
13C样品=[(At13C%) L- (At13C%) uL]×TC×100
式中,13C样品表示样品中13C含量,At13C% 表示样品中含13C的丰度; L 和 uL 分别表示标记和非标记; TC 样品表示样品中总有机碳的含量。
2.7 植物、土壤C浓度,土壤容重
用于C浓度分析的土壤子样品风干后,过2mm筛,然后在球磨机中研磨。采用改良的Walkley-Black法,在175℃下煮沸土壤-硫酸混合物5min[23- 24]。采用1.1逆变换因子对Walkley-Black方法获得的SOC测量结果进行校正[23],修正了含水率和干重对有机物含量的影响。对植物样品烘干称重后,利用连续流动同位素质谱仪(EA 1110; CE Instruments, Milan, Italy) (EA-IRMS)和连接到IRMS的ConFlo II设备(FinniganMAT 253, Bremen,Germany)进行分析。土壤水分的重量测量。用已知体积的土壤环刀测定土壤容重。
2.8 C储量的测定值
植物C储量公式如下:
Cpool=B样品×C样品%
式中,Cpool(kg/m2)为植物样品的C库,B样品(kg/m2)为植物样品干重质量,C样品%(%)为样品C含量。
土壤碳储量[25- 26]公式如下:
SOC=Cs×D×E×(1-G)/10
式中,SOC(kg/m2)为土壤有机碳密度,Cs、D、E、G分别为土壤有机C含量(%),土壤容重(g/cm3),土壤层厚度(cm)和大于 2 mm 的石砾所占的体积百分比(%)。
2.9 数据分析与统计
采用Oneway-ANOVA(单因素方差)分析方法,多重比较采用 Tukey 法,分析了氮素添加处理下植物地上生物量、地下生物量、土壤碳库和土壤呼吸速率的差异,检验了氮素添加处理对光合碳在茎和叶、根、土壤以及土壤呼吸中分配的比例及随时间变化动态。利用回归分析拟合了光合碳在土壤呼吸释放CO2中随时间衰减的关系。数据统计分析采用 SPSS 16。
3 结果
3.1 不同化学形态氮素长期添加对植物地上、地下生物量,土壤碳库及根碳比例的影响
外源氮素添加10年后,氨态氮处理下的地上生物量高于对照处理下的地上生物量的值的49.5%,其他处理之间地上生物量的值没有显著差异(图 1)。与对照相比,氨态氮处理下的地下生物量的值增加了111.3%,并且氨态氮处理下的地下生物量也显著高于硝态氮和硝酸氨处理下的值,而对照、硝态氮和硝酸氨3个处理之间没有显著差异。同时,氨态氮处理下的土壤碳储量显著高于硝态氮处理下的值(P=0.007),而其他处理之间无显著性差异。氨态氮处理下根碳比例显著高于对照和硝态氮及硝酸铵处理下的值(P=0.002)。
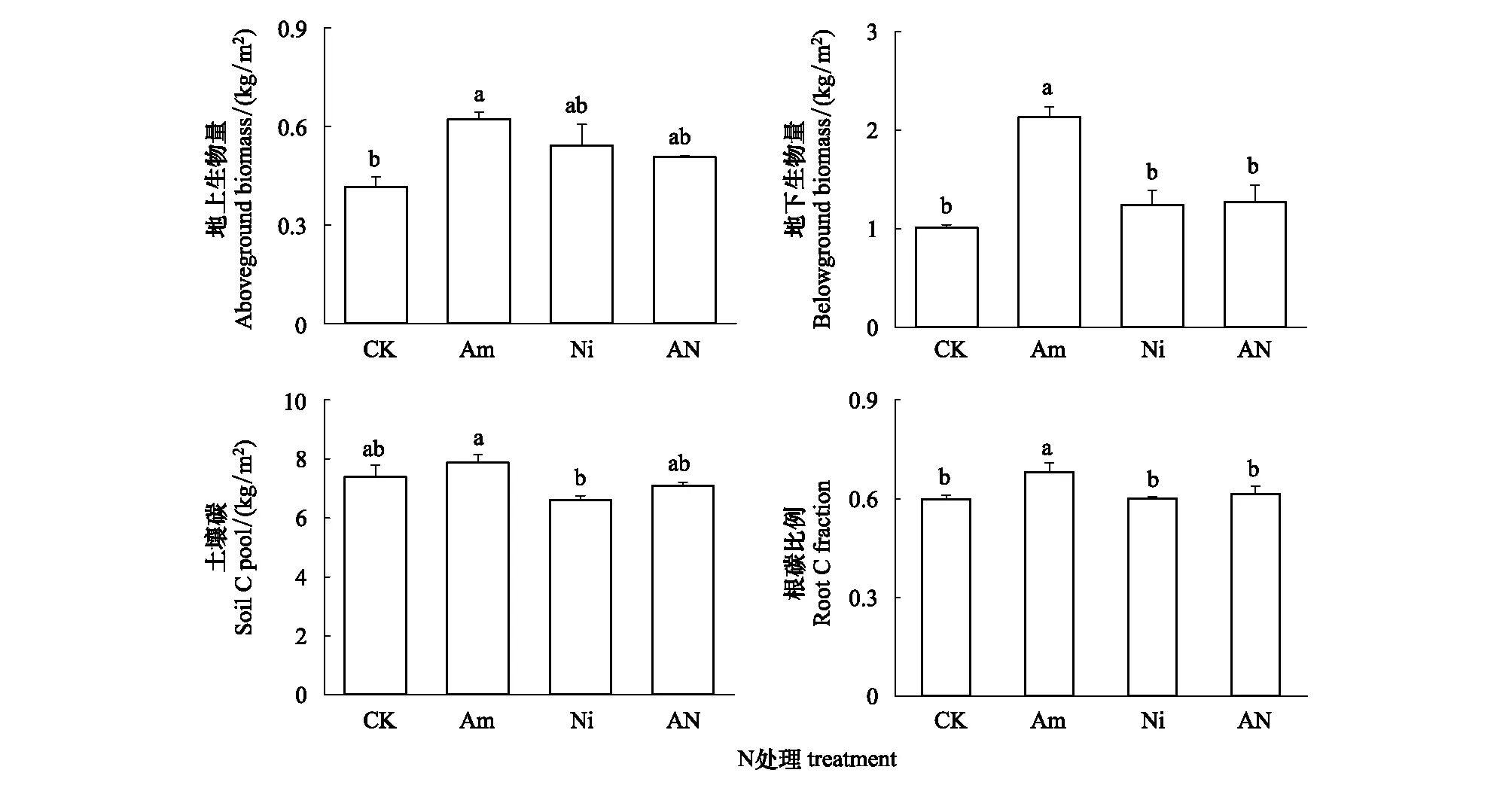
图1 不同化学形态氮素长期输入对土壤-植物系统的不同碳库的影响Fig.1 Effects of long-term N addition in different chemical forms on on different carbon pools in soil-plant systemsCK, 代表不加N处理; Am, 代表7.5 g N m-2 a-1剂量添加的NH4-N的处理;Ni,代表7.5 g N m-2 a-1剂量添加的NO3-N的处理;AN,代表7.5 g N m-2 a-1剂量添加的NH4NO3-N的处理;相同小写字母表示处理间差异不显著
3.2 不同化学形态氮素长期添加对光合碳在植物地上茎和叶和地下根中分配比例的影响
13C同位素标记后1天测定植物茎和叶内的13C占刚刚标定完茎和叶内13C的80%左右,不同处理之间没有显著性差异。随着植物不断固定光合碳输入的稀释以及13C向地下组织的分配,茎和叶内13C随时间呈现下降的趋势,到标定后的第30天,茎和叶内13C的滞留量约占初始量的30%左右(图 2)。而且,硝态氮处理下的值到第21和30天显著低于对照和氨态氮处理下的值,表明硝态氮处理下,植物光合固定的碳在短期内迅速输入地下组织和土壤中(P<0.05; 图 2)。相反,根系中13C的量随时间呈现缓慢增加的趋势,从标记后第1天的10%增加到30天的22%左右。而且,标记完的14天至第30天期间氨态氮处理下的根系组织中滞留13C的量显著高于硝态氮处理下的量(P<0.05; 图 2)。

图2 13C示踪的不同化学形态氮素长期输入对植物光合碳在地上茎和叶、地下根中分配比例的影响Fig.2 13C tracing photosynthetic carbon dynamics in shoot and root of plant species during the chase period in the 10th year of the N fertilization experiment
3.3 不同化学形态氮素长期添加对土壤呼吸释放CO2速率的影响,以及对光合碳在土壤呼吸释放CO2中动态的影响
土壤中滞留的13C整体呈下降趋势,相对其他处理,硝态氮处理下的土壤中13C下降速率较快,而且至标记后30天,硝态氮处理下的土壤中13C滞留量最低(图 3)。实验观测的30天期间,土壤呼吸速率随时间呈增加趋势。硝态氮处理下的土壤自第14天起呼吸速率增长幅度最快,显著高于其他三种处理(P<0.05; 图 3)。而氨态氮处理下的土壤自第21天起呼吸速率显著低于其他三种处理下的值(P<0.01; 图 3)。从土壤呼吸中13C的动态上看,不同处理下的土壤呼吸中13C的滞留量随时间呈指数衰减的变化趋势(图 4)。其中硝态氮处理下的13C随土壤呼吸释放出CO2量衰减最快(图 4)。

图3 13C示踪的不同化学形态氮素长期输入对光合碳分配到土壤中的比例以及对土壤呼吸释放CO2速率的影响Fig.3 13C tracing photosynthetic carbon dynamics in soil during the chase period and the effect of addition of N
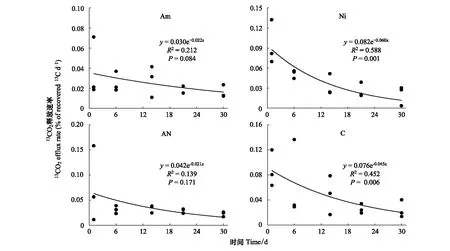
图4 13C示踪的不同化学形态氮素长期输入对光合碳分配在土壤呼吸释放出的CO2中的动态变化Fig.4 13C tracing photosynthetic carbon dynamics in soil 13CO2-C efflux rate during the chase period in the 10th year N fertilization experiment
4 讨论
4.1 植物光合碳在地上和地下组织中的分配对不同化学形态氮素输入的响应
我们的结果发现与对照处理相比,氨态氮添加处理下的地上生物量增加了49.5%,氨态氮处理下的地下生物量的值增加了111.3%。这是因为在高寒草地生态系统,植物的生长受N素限制。添加N肥之后,N素受限解除,植物生长加快,植物的生物量增加。张林海等[27]认为植物光合固定的大部分C保留在地上部分。此外,在我们之前的研究中发现,长期添加不同形态N肥,氨态氮处理下的禾本科植物物种丰富度和生物量都会增加,而在植物群落中,禾本科植物对群落水平的生物量有较大的贡献,地上生物量也会相应增加[28]。同时,植物也会将较多的光合产物分配到地下,从而增加地下生物量。另外,许多研究表明不同植物物种对不同形态氮素的利用存在一定的偏好差异[29- 30]。在养分(如N)受限的土壤中,为了促进植物群落中不同物种共存,植物物种之间会存在生态位互补[16,31,32]。一般情况下,莎草科和豆科植物更加偏好利益氨态氮,杂草植物更喜欢偏好利用硝态氮[32]。与氨态氮相比,有些植物更偏好吸收硝态氮的部分原因是硝态氮在土壤溶液中移动的速度更快,植物能更加快速的吸收利用[30,33]。因此,即使在长期添加N肥之后,植物物种丰富度和地上生物量都发生了改变[28],在群落水平上,植物地上生物量对不同N形态的响应不大。
4.2 不同化学形态氮素输入对植物光合碳在土壤和土壤呼吸中的分配的影响
在研究中,我们发现氨态氮处理下的土壤碳库显著高于硝态氮处理下的值。不同处理下的土壤呼吸中13C的滞留量随时间呈指数衰减的方式变化,其中,硝态氮处理下的13C衰减最快(图 4)。土壤碳库主要的来源是植物凋落物残体和根系的死亡。在氨态氮处理下,地上、地下生物量都显著高于对照处理,而其他处理之间没有显著的差异,这与土壤碳库(图1)的结果一致。植物固定的光合碳以根渗出物和分泌物等方式输入到土壤中,根渗出物和分泌物主要是活性C物质,如非结构碳水化合物,淀粉,糖类和小分子酚醛等[34]。这些物质的输入会改善微生物活性受土壤中活性C限制的强度,从而提高微生物活性。而微生物的活动直接调节着植物根际激发效应的强弱和方向。在N受限的生态系统中,微生物通过增加胞外酶的分泌来分解土壤中的有机质,从而释放营养元素(如:N),产生正的激发效应。而在N充足的生态系统中,微生物会偏好利用易于分解的小分子有机物(如:根系分泌物),从而产生负的激发效应[35]。微生物中采取r策略的类群(如:细菌),更倾向利用易于分解的有机物(如:根分泌物);而采取K策略的微生物类群(如:真菌),则是缓慢利用难以分解的土壤有机质[36]。氮素的长期输入会显著降低真菌和菌根真菌的数量,从而,可能会降低对惰性C组分有机质的分解。有研究发现,氮肥可诱导有机碳的负激发过程[37]。另外氨态氮的长期添加会显著改变土壤理化性质(如:土壤pH的降低、土壤团聚体结构等的变化表1),土壤性质的改变也会引起土壤微生物组成和活性的变化[25]。这些变化最终导致氨态氮处理下土壤呈现负的激发效应,而硝态氮处理下土壤呈现正的激发效应[29]。这些结果与本研究中观测到的氨态氮和硝态氮下土壤呼吸以及光合碳在呼吸中的分配结果相一致。
4.3 植物光合碳模式对不同化学形态氮素输入引起的植物与土壤碳库变化的作用机制
植物通过光合作用固定大气中的CO2,而在不同环境下,植物对光合产物分配的模式也不一样。不同化学形态氮素的长期输入引起的植物变化的作用机制是,在植物群落水平上,不同功能群的植物对不同形态N素有不同的偏好,功能群之间的相互补偿性也使得不同化学形态N素输入下,地上生物量具有一定的稳定性。研究结果表明,氨态氮处理下的土壤碳储量显著高于硝态氮处理下的值,而其他处理之间无显著性差异(图 1)。不同化学形态氮素的长期输入引起的土壤碳库变化的可能的作用机制是,不同化学形态氮素的长期输入引起了植物种类发生改变,进而引起土壤微生物组成的变化,而不同类型的微生物对土壤有机质的影响是不同的。同时,植物根系分泌物进入到土壤中,提高微生物的活性,微生物分泌胞外酶加快土壤有机质的分解[35]。氮肥可能提高了植物光合碳在土壤中的周转率,但没有改变水稻系统有机碳的绝对含量[38]。由于植物根系的分泌物多少的改变以及长期N素的输入下土壤理化性质和土壤微生物类群的改变(表 1),最终引起土壤有机碳贮存的改变。
5 结论
基于在青藏高原矮嵩草草甸开展的不同化学形态氮素添加的长期实验,利用13C示踪方法揭示了光合碳在植物地上、地下组织的分配,及其随时间在土壤中的滞留和随土壤呼吸的释放。实验结论回答了我们提出的科学问题,研究结果表明不同化学形态氮素的长期输入引起光合碳在植物地上、地下组织分配的差异,并且不同化学形态氮素处理下的土壤中光合碳的滞留以及光合碳随土壤呼吸释放的速率也存在显著差异。总体上,硝态氮与氨态氮处理下光合碳分配存在显著的差异,相比于氨态氮处理,硝态氮处理下光合碳在各个库之间的转移速率较快,最终通过土壤呼吸释放的速率也最快。在全球变化(N沉降增加)的情况下,高寒草地的地上生物量会增加。在养分(如N)受限的土壤中,植物地上生物量在群落水平上对不同N形态的响应不大。而在氨态氮处理下的土壤碳库显著高于硝态氮处理下的值,因此,在对青藏高原高寒草地施肥时,选择氨态氮比选择硝态氮更利于土壤中碳的固持。
