免疫性血小板减少症转化为RUNX1基因阴性的儿童急性巨核细胞白血病临床分析
2020-07-17陈天平王亚萍屈丽君
陈天平 王亚萍 程 杰 许 喆 李 艳 汪 俭 屈丽君
免疫性血小板减少症(immunothrombocytopenia, ITP)是由体液和细胞免疫介导骨髓巨核细胞成熟障碍所致血小板生成不足,和/或免疫因素所致血小板过度破坏的一类自身免疫性疾病,其发病机制复杂多样,具有明显的异质性[1]。近年来,随着分子遗传学技术的发展,该病的发病机制得以进一步阐述,部分既往诊断为慢性ITP的患儿最终确诊为遗传性血小板减少症。其中,RUNX1基因突变的具有急性髓系白血病(acute myeloid leukemia,AML)倾向的家族性血小板疾病(familial platelet disorder with predisposition to acute myeloid leukemia, FPD/AML)具有易于向AML转变的特征[2-3]。本研究通过对2例ITP转化为RUNX1基因阴性的急性巨核细胞白血病(acute megakaryocytic leukemia,AMKL)患儿进行临床及实验室检查,并结合国内外相关文献,探讨此类罕见疾病的临床特征。
1 资料与方法
1.1 一般资料 收集安徽省儿童医院血液科2018年1~12月收治的AMKL患儿2例,均为女婴,就诊时年龄较小,都因出血症状就诊。追问病史,既往皆有ITP病史,曾行骨髓细胞学检查排除血液造血系统疾病,并行自身抗体谱系等检查排除自身免疫性疾病。所有患儿均否认阳性血液系统疾病家族史,亦否认异常孕产史。患儿一般资料见表1。
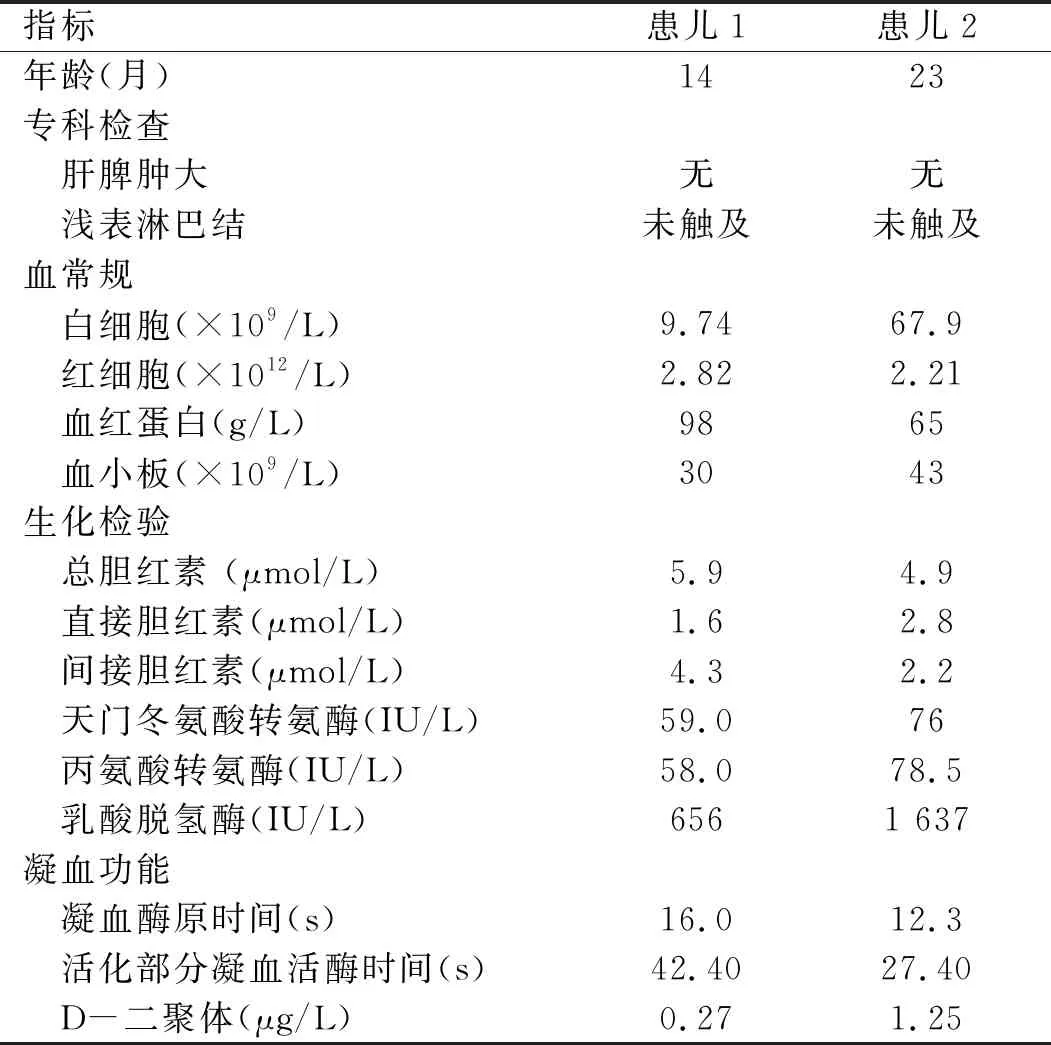
表1 2例患儿一般资料
1.2 检查方法
1.2.1 骨髓细胞检查 采用局部麻醉,选取髂后上棘为穿刺部位,将抽取的骨髓液迅速涂片3~5张,实行瑞-吉姆萨染色,使用低倍镜对骨髓增生度进行观察判断,油镜下观察骨髓细胞的分类、形态及计数。
1.2.2 骨髓活组织检查 局麻处理后,取髂后上棘行骨髓活检穿刺,钻取0.4~1.0 cm的骨髓组织。使用Bouin液对骨髓组织固定,经脱水、浸透处理后运用塑料包埋,将其制成切片,行HE染色和免疫组化染色。采用显微镜对骨髓病理形态进行观察。
1.2.3 流式细胞学分析 取骨髓液1~2 mL,EDTA抗凝,调整细胞数至(4~10)×109/L,取100 μL骨髓液加入单克隆抗体20 μL,分析60 000个细胞表面抗原的表达情况。以CD45/SSC设门,按五色免疫荧光直接标记法测定骨髓有核细胞各种抗原的表达,分别检测细胞的CD10、CD19、CD5、CD13、CD33、HLA-DR、CD38、CD34、CD16、CD11b、CD36、CD64、CD56、CD14、CD20、CD2、CD3、CD4、CD7、CD8、CD22、CD24、cTDT、cCD79a、cCD22、cCD3、cMPO、IgM、CD79b、CD45、CD61等抗原的表达。所用抗体以及溶血剂、破膜剂购自贝克曼-库尔特公司,仪器为贝克曼FC-500MPL。
1.2.4 RT-PCR检测融合基因 Trizol法提取细胞总RNA,采用多重巢式RT-PCR技术,定性检测43种常见的白血病融合基因。使用日本Thermo 公司PTC-200 型PCR 仪,试剂盒为科研用白血病融合基因检测试剂盒(上海源奇生物公司)。检测的基因包括MLL/AF4、TEL/AML1、SIL/TAL1、ETV6/RUNX1、dupMLL、MLL/ENL、E2A/PBX1、SET/CAN、BCR/ABL、TLS/ERG、E2A/HLF、CALM/AF10、HOX11L2、HOX11、MLL/AF10、NPM/ALK等。
1.2.5 染色体核型分析 取肝素钠抗凝新鲜骨髓液约3 mL,应用植物血凝素进行短期培养(24 h)后立即制片,收集骨髓细胞中有丝分裂中期细胞行吉姆萨染液染色,经G显带于染色体分析仪上,行骨髓染色体核型分析。
2 结果
2.1 临床表现 2例患儿既往行骨髓细胞学检查排除血液造血系统疾病,并经ANA系列等自身抗体谱检查排除自身免疫性疾病,诊断为ITP。患儿都曾经对激素、丙球显效或部分显效。患儿1发病时年龄较小,在新生儿科曾经使用丙球、激素治疗,出院后予口服泼尼松维持治疗,曾经一度血小板恢复正常,并予激素减停。初诊14个月后,该患儿再次因“发热咳嗽5 d,皮肤瘀点瘀斑4 d”入住我科。患儿2在初次诊断时给予静脉使用地塞米松治疗,出院后予口服泼尼松片维持,但其出院后血小板计数反复减少,约5个月后,因“反复便血22 h”入住我院。
2.2 白血病MICM分型 2例患儿入院后,完善骨髓MICM分型检查。患儿1的骨髓细胞学即提示AMKL,见图1。白血病免疫表型:可见约1.10%免疫表型异常髓系原始细胞,表达CD41、CD42b、CD61,原始巨核细胞可能性大,请结合骨髓形态学、小巨核酶标等结果综合考虑;骨髓染色体:54,XX,+2,+i(6)(p10),+7,+8,+10,+10,+19,+19[16]/46,XX;白血病融合基因筛查及髓系预后基因筛查(包括RUNX1基因)均为阴性。
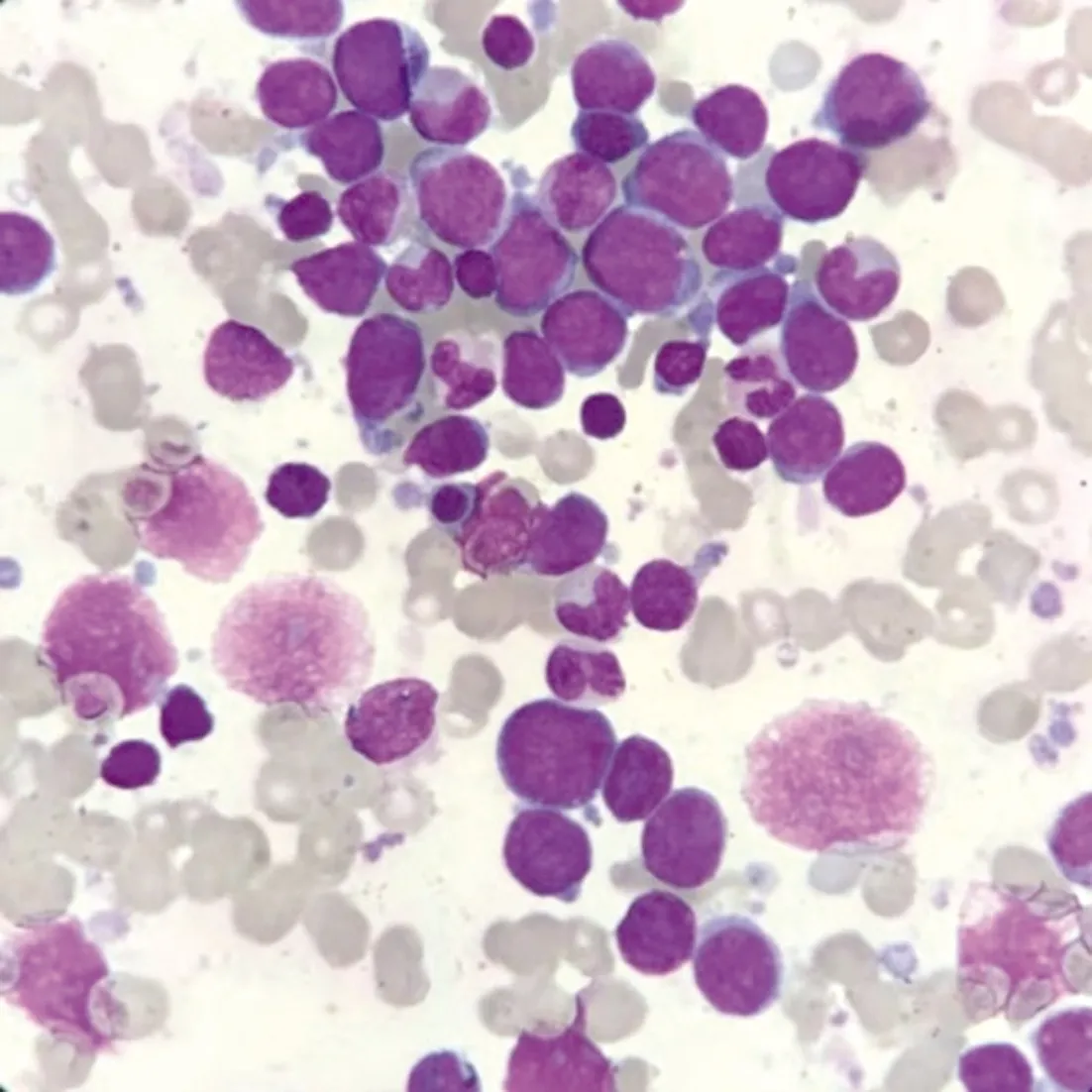
图1 患儿1骨髓细胞学(瑞-吉姆萨染色×1 000)
患儿2再次诊断时骨髓细胞学形态并不典型,见图2。白血病免疫分型:原始细胞占有核细胞总数约69.4%,该群细胞表达为CD4、CD36、CD41,部分表达为CD7、CD33、CD38、CD61、CD117,少量表达为CD13,不表达CD2、CD3、CD5、CD8、CD10、CD11b、CD14、CD15、CD16、CD19、CD20、CD42b、CD56、CD64,倾向于AML-M7可能性大;骨髓染色体核型为复杂核型:46,XX,der(8)t(8;12)(q24;q21),der(9)t(9;10)(p22;p11.2),-10,der(12)t(10;12)(q11.2;q15),add(17)(p13),-19[7]/46,XX[13];白血病融合基因筛查(包括RUNX1基因)均为阴性。患儿2因经济原因,未行髓系白血病预后基因检测。

图2 患儿2骨髓细胞学(瑞-吉姆萨染色×1 000)
2.3 骨髓病理检查 患儿1在白血病MICM分型检查后,进行骨髓病理学检查。骨髓病理结果:骨髓有核细胞增生程度大致正常(60%);粒/红比例略高;粒系以偏幼稚细胞散在易见;红系以中晚幼红细胞为主;未见明显巨核细胞;淋巴细胞散在少数;骨髓间质未见纤维化。骨髓免疫组化提示:CD34小血管(+);CD117少(+);CD20散在少(+);MPO散在(+);Lyso部分区域多(+);CD99少(+);CD61巨核细胞(+),为小淋巴样巨核细胞;E-cad偶见(+)。其骨髓病理及组化染色结果均支持AMKL诊断。见图3。
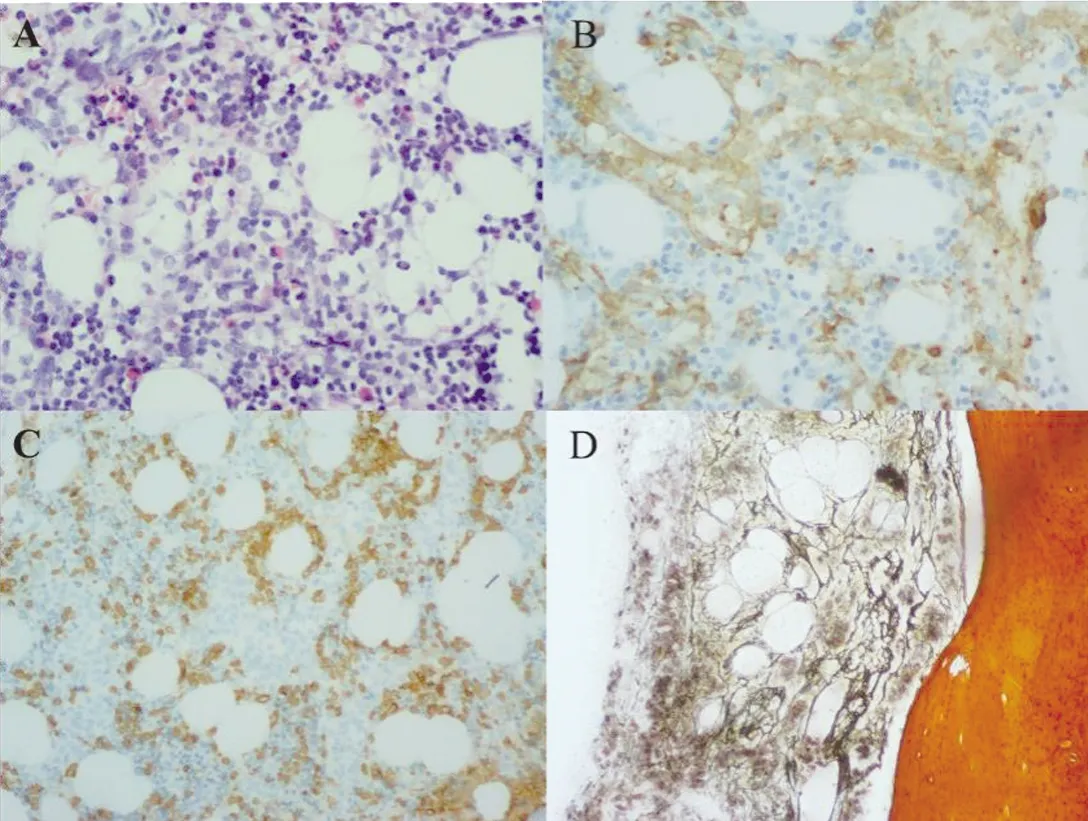
图3 患儿1骨髓病理检查
2.4 治疗与预后 患儿1入院后,经骨髓MICM分型及骨髓病理学检查,明确诊断为AMKL,进入CCLG-AML2016协作组方案化疗。先后给予诱导化疗(DAE方案)、诱导后巩固化疗(IAE方案)、巩固化疗(HA方案)及CLASP方案化疗,DAE诱导第28天即达骨髓细胞学完全缓解,已行异基因造血干细胞移植(脐带血),移植术后恢复可,目前仍在密切随访中。患儿2入院后,经骨髓MICM分型诊断为AMKL,最终因经济原因放弃进一步治疗,电话回访时,患儿2已经死亡,自其血小板减少起病至死亡时间仅5个月余。
3 讨论
ITP 是一类自身免疫性疾病,早在1951 年,Harrington等[4]就已经通过实验验证了ITP 的病理生理机制为自身抗体引起的自身免疫功能紊乱,导致网状内皮系统过度清除自身血小板。ITP 的发病机制甚为复杂,其病理生理过程主要由体液免疫及细胞免疫异常介导的血小板生成不足和破坏增多所致[1],涉及细胞因子、细胞程序性死亡、氧化应激、感染、妊娠和药物等诸多方面[5]。无论是成人[6]亦或是儿童[7],目前在ITP的诊断方面主要强调“排他性”诊断,即排除其他任何已知明确可致血小板减少的疾病,包括遗传性血小板疾病。本例报告中,初诊时2例患儿经骨髓细胞学除外血液造血系统恶性疾病及骨髓衰竭性疾病,并经自身抗体谱筛查初步排除其他自身免疫性疾病,结合2例患儿曾经对激素、丙球有效,故诊断为ITP。
目前,国内外报道血小板减少症转化为血液造血系统恶性疾病的病例不多,大多转化为髓系恶性疾病,包括AML和骨髓增生异常综合征(myelodysplastic syndrome, MDS),但大部分见于成人。儿科患者以具有AML倾向的家族性血小板疾病(familial platelet disorder acute myelogenous leukemia, FPD/AML)最为常见[3,8]。FDP/AML绝大部分都以血小板减少和/或出血倾向为首发症状起病,是由位于21q22.1上的RUNX1基因发生突变所致,可有阳性血液病家族史[9]。据统计,20%~65%的FDP/AML患者逐渐发展成为AML/MDS,其转变过程长短不等,已有M1、M2、M4和M5的报道。
研究[9-10]显示,FDP/AML发生MDS或AML的高峰年龄约40岁,预后较差,但目前报道的FDP/AML转化为AML的儿科病例亦不在少数[11-12]。本研究2例患儿均以血小板减少起病,逐渐出现血象其他两系改变,后经骨髓MICM分型确诊为AMKL,融合基因检查证实为RUNX1基因阴性,这在儿童血液专科实属罕见,目前未见相关文献报道。自诊断ITP起病,至AMKL发病时间,2例患儿分别为14个月和5个月,转化白血病时间较成人更短。遗憾的是,由于经济条件限制,本研究2例患儿皆未能完善遗传性血小板减少症相关基因检测,这也为进一步研究带来了困难。
AMKL系一种较为少见的髓系起源急性白血病,在儿童血液专科,非21-三体伴发的AMKL被认为是一种具有独特肿瘤生物学特征的白血病亚型,其预后较差,治疗强调早期行造血干细胞移植[13-14]。随着流式单克隆抗体免疫标记的广泛应用,使得血小板特异性的单克隆或多克隆抗体标记可以识别巨核细胞,1985年FAB协作组确立了AMKL的诊断标准[15]。本研究患儿1骨髓细胞学、骨髓病理学及流式免疫分型均提示AMKL;而患儿2骨髓细胞学形态虽不典型,但其白血病免疫分型提示CD41、CD61、CD36等较特异性的巨核系分化抗原均为阳性,故此诊断AMKL亦可成立。AMKL预后凶险,建议在完全缓解后尽早行骨髓移植。本研究患儿1在骨髓完全缓解、配型成功后即行造血干细胞移植,目前仍然存活。
通过本文病例分析,结合相关文献报道,对于反复血小板减少的儿科患者,尤其是小婴儿,即使病程不长,也应密切随访骨髓细胞学,及时完善HT相关基因检查,达到及时诊断、早期治疗的目的。同时,在今后的儿童ITP诊疗指南中,应加入遗传学检查的建议,让更多的患儿得到规范、合理的诊治。
