Breg Tfh Tfr细胞在免疫性血小板减少症患者中的表达及意义
2020-07-17梁兴林夏瑞祥曾庆曙杨明珍李庆生
梁兴林 夏瑞祥 曾庆曙 杨明珍 李庆生
免疫性血小板减少症(immune thrombocytopenia,ITP) 是一种免疫介导的血小板过度破坏所致的出血性疾病[1]。B细胞在免疫系统中执行多重功能,包括递呈抗原、分泌抗体和各种细胞因子等。调节性B细胞(regulatory B cell,Breg) 是一类具有免疫抑制功能的B细胞亚群,参与维持机体免疫稳态,并且在各种免疫病理过程中发挥着重要调节作用。滤泡辅助性T细胞(follicular helper T cell,Tfh)为新近发现的效应性T细胞亚群,是辅助生发中心B细胞产生抗体的主要细胞[2],其作用可被滤泡调节性T细胞(follicular regulatory T cell,Tfr)所抑制[3]。多种自身免疫性疾病的发生与Tfr细胞分化不足、Tfh细胞数量增多及Tfr/Tfh失衡有关[4-5]。研究[6]显示,Breg细胞通过分泌白介素-10(interleukin-10,IL-10)调控着Tfh细胞和Tfr 细胞在二级淋巴器官的分化和迁移。本文通过流式细胞术(flow cytometry,FCM)检测ITP中Breg、Tfh、Tfr细胞的表达水平,探讨Breg、Tfh、Tfr在ITP发病机制中可能的作用。
1 资料与方法
1.1 一般资料 选择2017年10月至2019年10月安徽医科大学第一附属医院收治的初次诊断的30例ITP患者为ITP组,所有患者均符合中国《原发免疫性血小板减少症诊断与治疗专家共识(2016年版)》诊断标准,其中,女性19例,男性11例,年龄16~76岁,平均(36.25±11.62)岁。选择同期健康体检者25例作为健康对照组,其中,女性15例,男性10例,年龄18~68岁,平均(38.21±15.37)岁。两组对象一般资料进行比较,差异无统计学意义(P>0.05)。纳入研究对象均排除具有药物过敏史、自身免疫性疾病及糖皮质激素应用史等。
1.2 检测试剂 Breg相关流式单抗CD19-PECy7、CD24-PE、CD38-FITC、IL-10-APC和Tfh/Tfr相关流式单抗CD4-FITC、CXCR5-PE、ICOS-710、Foxp3-APC均购自美国BD公司。
1.3 方法
1.3.1 血样采集和处理 治疗前,取两组对象静脉血5 mL,肝素抗凝。应用Ficoll密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。
1.3.2 FCM检测外周血Breg细胞 取已分离的PBMC,加入培养液,5%CO2培养箱中培养4 h,磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤,加入荧光标记的CD19-PECy7、CD24-PE和CD38-FITC单抗,避光染色30 min,PBS洗涤后,加固定液,避光保存30 min,PBS洗涤后,加入破膜剂和IL-10-APC,避光胞内染色20 min,PBS洗涤后,上流式细胞仪(FACSCanto,BD公司)检测,CD19+CD24hiCD38hi细胞群为Breg细胞,CD19+CD24hiCD38hiIL-10+就是分泌IL-10的Breg细胞。
1.3.3 FCM检测外周血中Tfh和Tfr 细胞 取已分离的PBMC,分别加入荧光标记的CD4-FITC、CXCR5-PE和ICOS-710单抗,避光孵育30 min,加入固定液,避光保存30 min, PBS洗涤离心后,加入破膜剂和Foxp3-APC,避光胞内染色20 min,PBS洗涤后,上流式细胞仪检测,CD4+CXCR5+ICOS+细胞群为Tfh细胞,CD4+Foxp3+CXCR5+ICOS+细胞群为Tfr 细胞。
1.4 观察指标 采集两组对象外周血进行FCM检测,应用FlowJo V10.0软件分析,测定Breg细胞、分泌IL-10的Breg细胞、Tfh细胞和Tfr细胞的百分比,并计算Tfr/Tfh的比值。
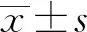
2 结果
2.1 外周血Breg细胞表达水平、IL-10+Breg细胞比例比较 ITP组患者外周血CD19+B细胞中,Breg细胞表达水平、IL-10+Breg的比例均低于健康对照组,差异均有统计学意义(P<0.05)。见表1、图1。
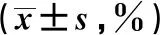
表1 两组对象外周血Breg表达水平、IL-10+ Breg细胞比例比较
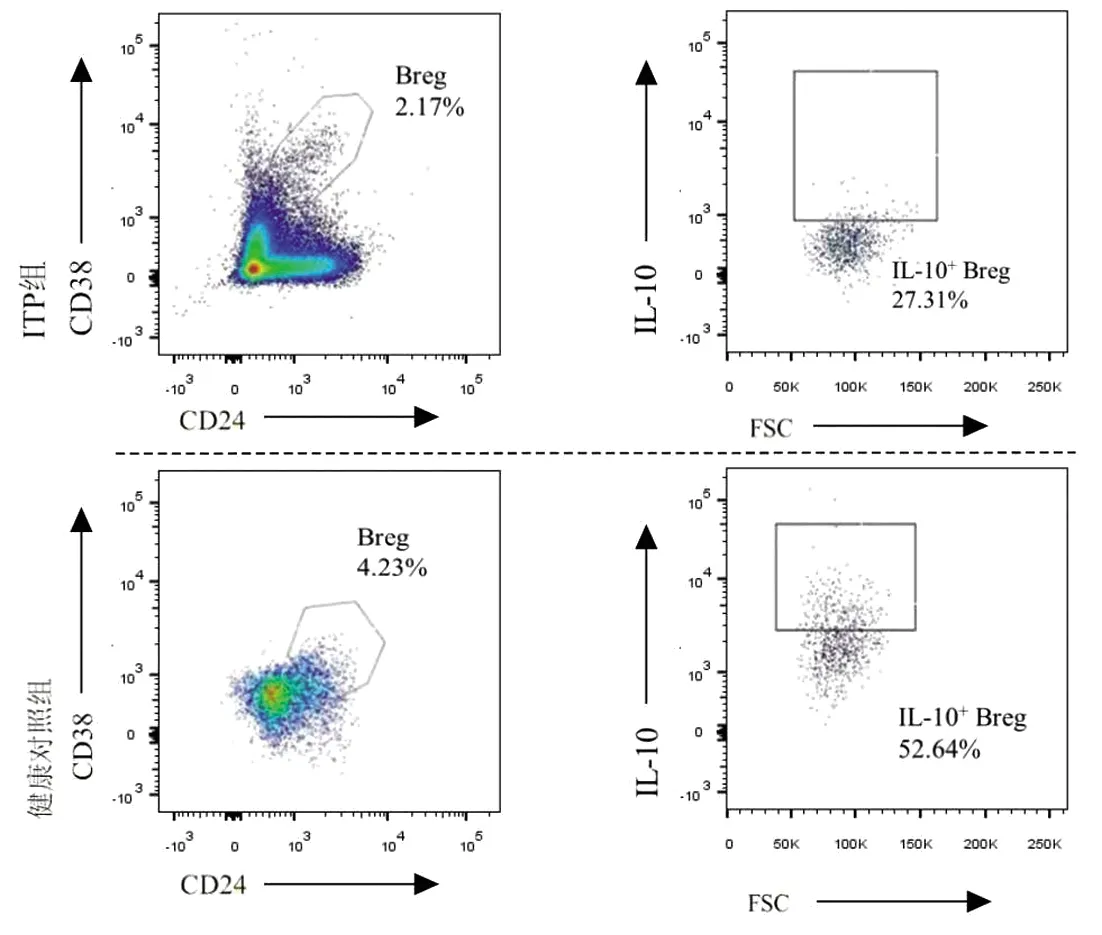
图1 两组研究对象Breg与IL-10+ Breg的FCM检测结果
2.2 外周血Tfh、Tfr 细胞表达水平及Tfr/Tfh比较 ITP组患者外周血CD4+T细胞中Tfh细胞表达水平高于健康对照组,Tfr细胞表达水平低于健康对照组,Tfr/Tfh低于健康对照组,差异均有统计学意义(P<0.05)。见表2、图2。

表2 两组对象外周血Tfh、Tfr 细胞表达水平及Tfr/Tfh比较
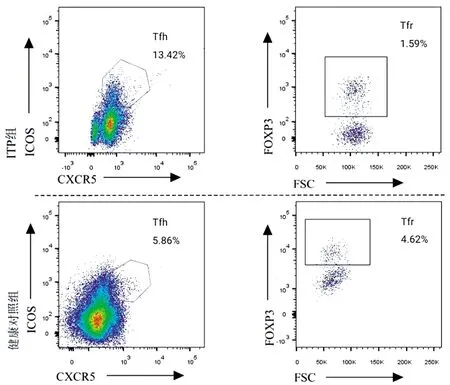
图2 两组研究对象Tfh与Tfr的FCM检测结果
3 讨论
ITP发病机制尚未完全明确,研究[7-8]显示,B淋巴细胞分泌的血小板自身抗体是ITP的主要发病原因,结合自身抗体的血小板最终被机体的单核吞噬细胞系统所清除,从而导致外周血血小板减少。阐明血小板自身抗体产生的调控机制,对明确ITP的发病机理及治疗有重要的意义。本文通过FCM检测Breg、Tfh、Tfr细胞在ITP患者中的表达,探讨Breg、Tfh、Tfr在ITP发病机制中的作用。
边缘区来源的Breg细胞通过分泌IL-10和转化生长因子-β控制初始T细胞向Tfh、Tfr 细胞的分化[9]。有研究[10]显示,ITP患者体内Breg细胞表达明显下降,其分泌IL-10的功能也随之降低,抑制单核细胞活化的能力受损。狄正霞等[11]研究发现,ITP组患者血清Breg细胞表达水平较健康对照组低,初诊ITP组IL-10 mRNA水平较健康对照组明显减低,治疗后其IL-10 mRNA水平较治疗前显著升高。本研究结果发现,初诊成人ITP患者对比健康对照组,外周血Breg细胞数量和IL-10+Breg细胞比例下降,差异均有统计学意义(P<0.05),与上述结果相同。Breg细胞水平的下降可导致Tfh和Tfr细胞比例失衡。
B淋巴细胞的活化及分化需要Th细胞提供第二信号及分泌细胞因子,Th细胞在体液免疫中具有重要作用,但Th细胞的本质一直未明确。研究[4]发现,Tfh细胞在生发中心与B细胞相互作用,并主要通过分泌多种细胞因子来调控B细胞的增殖分化、Ig类型转换和抗体亲和力成熟。Tfr 细胞表面同时高表达Treg细胞相关分子和Tfh细胞相关分子,在功能上,Tfr 细胞具有Tfh细胞及Treg细胞的双重特性,可以调节Tfh数目、控制生发中心的反应、防止自身反应性B细胞产生。研究[12]发现,Graves病、SLE、风湿性关节炎、重症肌无力等多种自身免疫性疾病患者外周血存在Tfh和Tfr 细胞数量异常。在儿童ITP患者体内发现,Tfr 细胞和Tfr/Tfh明显减低,且与外周血血小板计数呈正相关[13]。本研究结果显示,ITP患者外周血Tfh细胞水平比健康对照组升高,而Tfr细胞出现下降,Tfr/Tfh降低,差异均有统计学意义(P<0.05)。成人ITP患者Breg细胞数量及IL-10+Breg细胞比例下降,引起Tfh和Tfr细胞比例失衡,可以进一步影响B淋巴细胞分化成熟异常及血小板自身抗体的产生,最终导致患者血小板减少。
综上所述,ITP患者外周血Breg细胞减少,IL-10分泌降低,造成Tfr/Tfh比例失衡,从而影响B细胞的分化增殖,最终导致血小板抗体分泌过多,这可能是ITP发病机制之一。深入研究ITP患者Breg、Tfh和Tfr细胞相互作用的调控机制,对阐明ITP的发病机制和提供新的治疗思路有重要的意义。
