基于核心素养的高考化学计算题探究
2020-07-16雷婷倪刚
雷婷 倪刚


[摘要]在新课程标准的指导下,以学科核心素养为导向的化学计算往往综合多个知识点,以实际情境为背景,解题过程较为复杂,学生在解题过程中因考虑不足导致失分。以近三年的高考全国卷为研究对象,分析高考化学计算题命题方向,并对计算题中的高频考点及题型进行分析,归纳解题技巧,提出复习建议。
[关键词]核心素养;高考化学;计算题
[中图分类号] GJ633.8
[文献标识码] A
[文章编号] 1674-6058(2020)14-0056-03
化学计算是运用数学的方式将物质组成、结构、性质及变化规律量化的过程,在实验、化工等方面多有涉及,考查学生运用数学方法解决化学及实际问题的能力。在高考化学中,计算题是必考题型之一,也是容易失分的题型,尤其是水溶液中的离子平衡计算题及工艺流程题。学生面对化学计算题时常常无从下手、思维混乱。基于此,笔者整理分析近三年的高考全国卷理综化学卷,以期找出高考化学计算题的命题特点及高频考点,为教师的复习教学及考生的复习提供参考。
一、高考化学计算题考查情况分析
1.考查内容全面,体现学科地位
自新课程改革以来,化学计算不再单独命题,而是渗透在选择题的选项或大题的填空中,与其他知识点相融合,综合性增强。将2017-2019年高考全国卷理综化学卷计算题整理分析得表1。其中,利用阿伏加德罗常数计算微粒数及水溶液中的离子平衡相关计算是选择题中考查计算的两大主要内容,大题中的实验题、下艺流程题、化学反应原理题以及选考题中的物质结构与性质题都会涉及计算。计算可以说渗透了整套高考化学试题,与多个知识点息息相关,相互保持着动态联系。
虽然高考化学计算题考查面较广,但涉及的知识点是有主次之分的,主干知识点一直被重点关注,如阿伏加德罗常数的相关计算,水溶液中的离子平衡、质量分数、焓变、平衡常数、转化率、原子间的距离等的计算都是高频考点。对比近三年的高考命题情况,全国卷I、卷Ⅱ、卷Ⅲ中,卷Ⅱ较另外两套卷子计算题的分值相对较小,且卷Ⅱ、卷Ⅲ连续三年考查了微粒数。而九套卷子中的化学反应原理题均涉及计算,主要考查焓变、平衡常数、转化率、反应速率等内容。
2.考查形式多样化,信息多元化
近几年的高考化学计算题考查形式多变,出现了不同主题形式相融合的现象。如2019年全国卷Ⅲ第11题,将阿伏加德罗常数放在离子平衡题中进行综合考查;2019年全国卷I第28题,工业题和化学反应原理题相结合,综合考查了水煤气的变换,以及物质的量分数、焓变、活化能和平均反应速率等内容。除此之外,考题也不再限于文字表达,而是文字、图形、表格等多种信息交错㈩现。这就要求学生能在众多的信息中找出解题关键点并合理处理信息。
3.考查解题能力,体现学科思想
从题目的难易程度和陌生程度来看,计算题的计算量并不大,更加注重对概念的理解、信息的处理,以及解题技能与方法的考查,且均是常规题,没有出现难题、怪题,涉及的也是常见的学科思想。如离子平衡题、工艺流程题和化学反应原理题主要考查平衡思想、守恒思想和数形结合思想;物质结构与性质题主要考查结构思想;阿伏加德罗常数题主要考查宏微结合、定性与定量相结合的解题方法。
4.素材源于生活,体现应用价值
环境、技术、社会、能源、材料等社会热点问题都是高考关注的对象,从生活素材中挖掘化学知识,提出问题。化学学科注重理论联系实际,化学问题来源于生活,回归于生活,这不仅考查了学生从素材中发现问题、解决问题的能力,还体现了化学试题的科学价值和人文价值。
二、经典题型的解题技巧
1.依据“一混、二标、三反应”解阿伏加德罗常数计算题
阿伏加德罗常数计算大多以选择题的形式出现,对计算的要求不高,所包含的计算内容大多是先利用物质的量的相关公式算㈩物质的量,再利用阿伏加德罗常数求出微粒个数。但“陷阱”较多,选项中常涉及物质之间的反应,在分析反应时注意用宏微结合、定性与定量相结合等思想解决问题。
[例1](2018年全国卷Ⅱ第11题)NA代表阿伏加德罗常数的值。下列说法正确的是( )。
A.常温常压下,124 gP4中所含P-P键数目为4NA
B.100 mL l mol·L-1FeCl3、溶液中所含Fe3+的数目为0.1NA
C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数日为2NA
D.密閉容器中,2 mol SO2和l mol 02催化反应后分子总数为2NA
这是一道常见的阿伏加德罗常数题,A选项中,124 g P4等于l mol P4,关键在于一个P4分子中P-P键的数目,有些学生可能会被P4的角标4误导,认为一个P4分子中有4个P-P键其实P4A是正四面体型,所以一个P4分子中有6个P-P键,1mol P4A中有6NA个P-P键。A选项就是典型的宏微结合,希望学生遇到此类题目时,能够善于运用宏微结合思想。B选项乍一看非常简单,但要注意Fe3+会发生水解反应,所以溶液中Fe3+的数目达不到0.1NA。C选项中两种物质的微观组成是解题关键,1 mol甲烷和乙烯的氢原子数相同,以此作为定量计算的依据,可算出氢原子数为2NA。D选项中打着计算的名号考查可逆反应,通过定性分析就可将其排除。故选C。
在做此类题时学生一定要注意“一混、二标、三反应”:(1)一混:出现两种物质的混合物时,最简式相同往往是解题的关键。(2)二标:出现“标准状况”时,注意物质是否是气体,避免将SO3、H2O2等物质判断成气体,尤其注意肉代烃在标准状况下的状态。(3)三反应:遇到物质之间反应时,首先判断是否是可逆反应;在氧化还原反应中,歧化反应和归中反应中的电子转移是易错项,若某一反应物既作氧化剂又作还原剂,从产物人手可避免出错;另外,考查离子数目时,常以离子水解或电离作为“陷阱”。
2.用三步法解水溶液中的离子平衡计算题
离子平衡计算题也是高频考点,且常出现在选择题中的后两道题,难度较大。近几年此类题多伴随着图像出现,因此对图像的分析尤为重要,重点考查生的数形结合思想、守恒思想、平衡思想等学科思想。
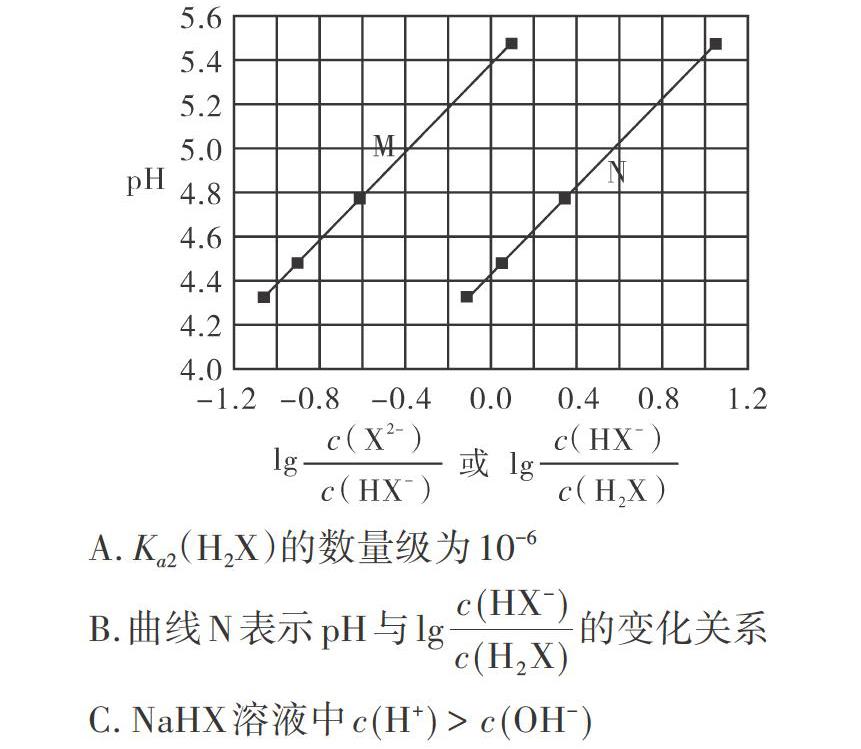
[例2](2017年全国卷I第13题)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )。
A.Ka2(H2X)的数量级为l0-6
B.曲线N表示pH与lg[〔c(HX-)〕/〔c(H2X)〕]的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>C(HX-)>C(X2-)>c(OH-)=c(H+)
在看选项之前先分析图像,图中M曲线和N曲线对应的横轴数值分析以及对数的计算,是此类题的常考点。A选项,先运用数形结合思想,确定一个pH值,得到两个对数值,再代人电离平衡常数的计算公式,便可得出A项正确,这一选项的计算相对较难,容易出错,要求考生巧妙计算,避免“死算”。B选项,根据己二酸的电离顺序,再综合横轴中对数的正负值,可以判断出曲线N表示pH与lg[〔c(HX-)〕/〔c(H2X)〕]的变化关系,B选项正确。C选项看似要定性分析,实则考查的是定量计算,己二酸氢根离子的电离程度和水解程度的强弱比较是判断这一选项的直接依据,因此,学生需根据图中信息及电离、水解的计算公式先算出己二酸氢根离子的电离常数和水解常数,然后通过比较发现电离常数大于水解常数,C选项正确。D选项是定性分析,由M曲线可知C(X2-)>c(HX-),D选项错误。
此类题的一般解题思路分为三步:分析图像→分析离子关系→计算。(如表2)
3.用推算法快速计算必做卷大题
大题中的计算有难也有易,一般在化学反应原理题中出现焓变、反应速率、平衡常数等的计算时,大部分学生是可以拿到分的,但在实验题或工艺流程题中出现质量分数、含量、产率等的计算时,学生的失分率就比較高了。因此,在这里笔者将不再赘述化学反应原理题中的计算,将重点放在失分率较高的实验题或下艺流程题的计算上。
在实验题或工艺流程题中,设问之前会有大量的实验描述、工艺描述以及数据信息,学生面对大量的背景资料和信息时往往无从下手,无法找到计算的突破口。实验题或工艺流程题考查较多的内容是质量分数、理论产量、转化率、含量或纯度,而计算这些都需要用到物质的质量,要知道物质的质量就得知道物质的量,由此可见,问题最终被转化为物质的量的计算。用已知物质推算未知物质的物质的量常要用到的推算方法有:原子守恒、电子守恒(氧化还原反应)等。
三、计算题复习建议
在高考计算复习方面,学生最大的问题不是不够重视,而是没有正确的解题方法。因此在复习时要做到以下两点:
1.克服恐惧
第一轮复习是梳理高中化学所有知识点的一个过程,计算贯穿于整个复习过程。复习时,教师要帮助学生克服对计算题的恐惧,只有学生从心理上不排斥计算题了,后续的专项训练才能事半功倍。
2.避免盲目刷题
在第一轮复习中,很多知识点都会出现相关的计算题,分析高考试卷可发现计算知识点来回就那么几个,因此在第二轮复习中不要盲目刷题。首先,分清哪些是高考计算的重点,再对这些重点内容进行重点练习。其次,练习强度及方法也要有针对性,做题在“精”不在多,要学会归纳整理及灵活应用。
[参考文献]
[1]夏时君,周小凡,黄文军,广东高考理综化学计算的命题取向及教学策略[J].化学教学,2015(7):71-75.
[2]黄世英,余大斌,化学计算:一个不容忽视的高考考点及备考策略探究[J].才智,2012(6):233.
[3]胡嘉谋,从高考化学计算谈学科素养的培养[J].福建基础教育研究,2016(8):65-67.
(责任编辑 罗艳)
