重视基础 联系生活 强调应用
2020-07-16何楚灵张丽霞
何楚灵 张丽霞
[摘要]通过分析2019年高考全国卷Ⅲ理综化学试题的考查内容,总结出2019年高考化学试题的三个特点:立足基础,注重综合考查;联系实际,强化应用意识;重视化学用语的应用,并从中得出两点启示:夯实基础,提高信息加工能力;重视应用,聚焦化学学科核心素养培养。
[关键词]基础;生活;应用;2019高考全国卷Ⅲ;理综化学试题
[中圖分类号] G633.8
[文献标识码] A
[文章编号] 1674-6058(2020)14-0050-04
2019年高考全国卷Ⅲ理综化学试题整体呈现出以“能力测试”为考查日的的命题原则,贯彻落实发展素质教育和深化高考考试内容改革的要求,结合高考评价体系[1-2],落实“基础性、应用性、综合性和创新性”[3]的考查要求,测试考生的必备知识、关键能力和思维方法,体现了化学学科在促进民族发展、社会进步以及提升学生化学学科核心素养方面的重要价值。通过对试题的分析,可以看出综合能力测试的发展和变化趋势,以及综合试题对化学学科的层次要求,这对今后化学学科的教学以及学生的学习和复习都会有良好的导向作用。
一、2019年高考化学试题考查内容
从题型分布上来看:7道选择题、5道大题(第35题和第36题二选一),均为常规题型,没有出现偏题、难题和怪题,整体难度不大,仍然遵循知识难度由浅入深,知识点由简单到复杂再到综合的趋势。各题考查内容如下:
第7题:化学与生活。该题的考查目的是让学生明白化学源于生活,用于生活,要求学生在日常生活中关注化学的发展及应用。
第8题:常见有机物的结构。这是选择题中唯一涉及有机知识的题目,目的是考查学生对碳杂化轨道知识的掌握和理解。杂化轨道知识是有机化合物中最基本的理论知识,体现了以基础知识为本的原则。
第9题:原子结构与元素周期律的关系、离子化合物与共价化合物的区分。该题综合性较强。今年是元素周期表创立150周年,其目的很明显,一方面纪念那些对周期表的创立做出贡献的科学家和学者,另一方面强调周期表中原子排列的规律性,以及由原子或离子组成的物质的类型、物质的简单物理性质和化学性质。
第10题:离子共存、离子交换。该题通过让学生观察图示,并运用所学知识进行有效分析,从而得出正确结论。既考查了学生读图和析图的能力,同时间接考查了离子共存的知识,又让学生明白离子交换树脂净化水的实质。
第11题:溶液中的电离平衡。该题虽然涉及阿伏加德罗常数,但重在考查强碱弱酸盐中的酸根离子的电离平衡问题,涉及电离度、弱酸根电离过程中的质子守恒、平衡移动问题等多个层面的知识。
第12题:涉及无机物制备和有机物质制备等知识,如次氯酸的制备、催化剂的功能、乙酸乙酯的制备、二氧化硫的制备。次氯酸、二氧化硫、乙酸乙酯的制备在工业生产中占据很重要的地位;同时乙酸乙酯的制备也是中学实验中的一个重要实验,该题虽未涉及具体的实验技能,但考查了实验过程中粗产品处理中的一个重要环节;催化剂的开发和应用也是目前社会生产的一个重要研究方向,该题涉及催化剂的功能。由此可看出,试题的用意旨在强调知识与社会实践的关系,考查学生运用所学知识解决相关问题的能力。
第13题:二次电池、电化学。这是一道与生活密切相关的考题,主要涉及电化学知识,如二次电池充放电时的电池反应,及电池内部离子迁移的方向等问题。突出了高中化学知识的基础性,同时也引导学生较深刻地理解化学、技术、社会和环境之间的相互关系,认识化学对社会发展的重大贡献[4]。
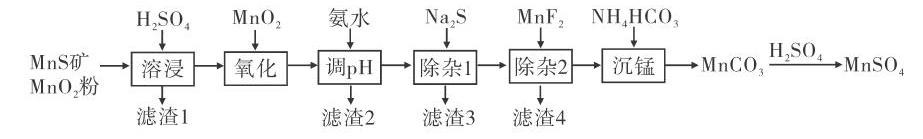
第26题:该题是生产工艺流程题,是由天然二氧化锰粉与硫化锰矿制备高纯硫酸盐。硫化锰矿和二氧化锰粉经过溶浸,制得MnSO4,含有杂质Fe2+、Fe3+、A13+、Mg2+、Zn2+、Ni+;加入MnSO2,使Fe2+氧化成Fe3+,通过调节溶液pH去除;加入Na2S除去杂质中的Ni2+、Zn2+;加入MgF2:除去Mg2+;加入H2SO4:使MnCO3沉淀,生成高纯MnSO4。该题综合性较强,学生在校学习的知识多是理论知识,物质的分离、提纯等情境的设计也较简单,常常脱离生产实际。工艺流程题来源于工业生产,原料复杂,处理过程复杂,要求学生具备综合运用所学知识、全面考虑问题的能力,需要学生对所学知识有较为深入的理解。
第27题:这是一道考查学生实验基本技能的测试题。考查的是实验仪器的选择、提纯与除杂、产率的计算。
第28题:该题主要考查学生对化学平衡、电化学知识的掌握;化学平衡是高中知识的一个重要组成部分,同时与工业生产密切相关。在工业生产中需要打破化学平衡,提高反应物的转化率,因此研究化学平衡主要是为实际生产提供理论指导。该题同样体现了基础理论知识的重要性,同时考查学生的读图能力以及有效从图中提取关键数据进行相关计算和分析的能力。
第35题:该题主要考查结构化学知识,以锂离子电池的正极材料磷酸亚铁锂为依托,从结构化学的角度考查了原材料中所涉及元素的原子核外电子排布、晶胞的计算、原子杂化轨道方式及杂化类型的判断、物质的结构式和化学式等,同时也涉及价层电子对互斥理论。
第36题:该题涉及有机化学基础知识,如有机物的命名、官能团的识别、反应类型、同分异构体的书写,同时考查学生从题目中获取信息的能力及将获得的知识信息迁移到新的合成环境中的能力。题目以信息的形式给出了在Pd催化下的Heck反应,要求学生能够将此知识点迁移到以苯和溴乙烷为原料,合成目标产物的步骤中,涉及合成方法论。这也进一步提醒教师在讲授有机化学时,應适当介绍合成方法论,这对学生是一种激励。
二、2019年高考化学试题特点分析
每年的高考试题都有不同的侧重点,2019年高考全国卷Ⅲ理综化学试题的特点如下:
1.立足基础,注重综合考查
在考查化学基础知识、基本概念的基础上,还考查了各分支主干知识,但不刻意追求知识的覆盖面,在各知识网络的交汇处注意解题的灵活性和综合性。选择题第9、10、11、12题和大题的第26题等综合考查迹象比较明显。下面以第9、12题为例进行分析。
[例1](第9题)x、Y、z均为短周期主族元素,它们原子的最外层电子数之和为10,x与z同族,Y最外层电子数等于x次外层电子数,且Y原子半径大于z。下列叙述正确的是( )。
A.熔点:X的氧化物比Y的氧化物高
B.热稳定性:X的氢化物大于z的氢化物
C.x与z可形成离子化合物ZX
D.Y的单质与z的单质均能溶于浓硝酸
解析:短周期主族元素次外层电子数只能为2或8,主族元素最外层电子数不可能为8,故Y最外层电子数为2;三个原子最外层电子数和为10,x与z同主族,所以它们最外层电子数相同,故而x与z的最外层电子数为4,则x为C,z为Si,Y半径大于z,所以Y为Mg。
A选项,碳的氧化物CO、CO2,常温下是气态,硅的氧化物Si02为固体,Si02的熔点显然更高,故A错误。B选项,非金属性越强,气态氢化物稳定性越强,CH4稳定性大于SiH4,故B正确。C选项,SiC是原子晶体,不是离子化合物,只含有共价键,故C错误。D选项,硅单质与浓硝酸不反应,常温下也不能与氢氟酸反应;在加热或有氧化剂存在时,硅单质可以与氢氟酸反应,反应方程式为3Si+18HF(aq)+4HNO3(浓)=3H2SiF6+4NO↑+8H2O,故D错误。
从该题可以看出,要正确做出选择,学生必须掌握元素周期表的周期性,比如原子半径的变化规律、核外电子排布及规律、同周期非金属元素氢化物的稳定性、物质的状态、物质的熔点、物质的热稳定性、晶型种类的判断、单质的特性反应等。
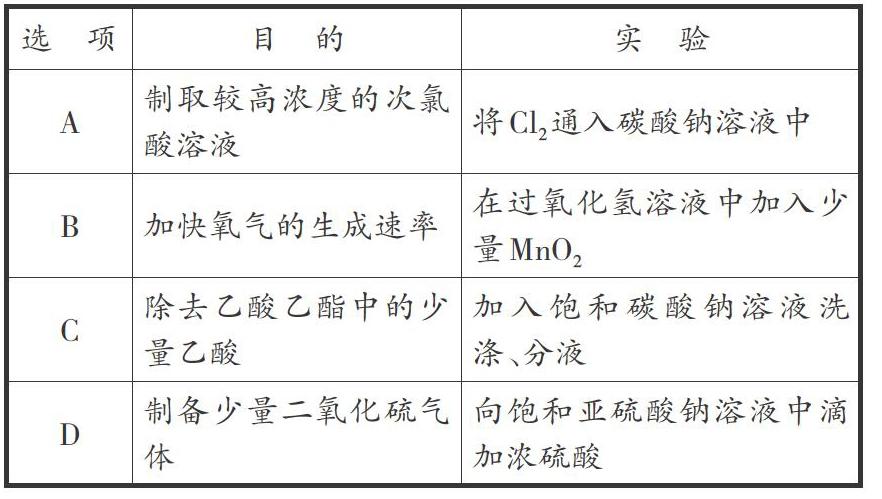
[例2l(第12题)下列实验不能达到日的的是( )。
解析:要想对A选项做出正确判断,必须考虑盐酸、碳酸、次氯酸、碳酸氢根离子的酸性。由于酸性:HCl>H2CO2>HClO>HCO3-,当氯气通入水溶液中,发生如下可逆反应:Cl2+H2O→←HCl+HClO,生成的HCl与Na:CO、反应,生成NaHC03;而生成的HClO与NaCO,反应生成NaHCl0:2Na2CO3+Cl2+H2O=NaCl+2NaHCO3+NaClO,从方程式可以看出是得不到次氯酸的;若通入的氯气过量,上述反应就会变为Na2CO3+2Cl2+H20=NaCl+CO2↑+2HClO。由于题中并未给出氯气过量,所以A选项不能达到实验目的。B选项,在过氧化氢溶液中加入少量二氧化锰作催化剂,可加快其分解速度,因此可以加快氧气的生成速率,故B选项能达到实验目的。C选项,乙酸可以跟Na2CO3发生反应,因此饱和Na2C03溶液可以吸收乙酸;同时饱和Na2CO3溶液可以降低乙酸乙酯的溶解度,所以可以采取饱和Na2CO3溶液洗涤、分液的方法除去乙酸,故C选项能够达到目的。D选项,由于Na2S03+H2S04=Na2S04+S02↑+H2O,所以可以制备少量的SO2,还要注意到SO2在饱和的亚硫酸钠溶液中溶解度小,若忽略了此点,可能认为生成的SO2,可以溶于水,就不能做出正确判断。
从该题可看出,每个选项中考查的知识点都是多重的。
2.联系实际,强化应用意识
试卷中的应用问题联系生活,贴近实际。如第7、13、26、27、28、35、36题,其中选择题第7题的背景知识涉及高科技、基础建设和医用常识领域;第13、26、35题涉及电池领域;第27、28、36题涉及医学领域,这些题目集中考查学生应用化学知识解决实际问题的能力。下面以第26题(1)(2)(3)(4)(5)问为例进行分析。
[例3](第26题节选)高纯硫酸锰作为合成镍钻锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
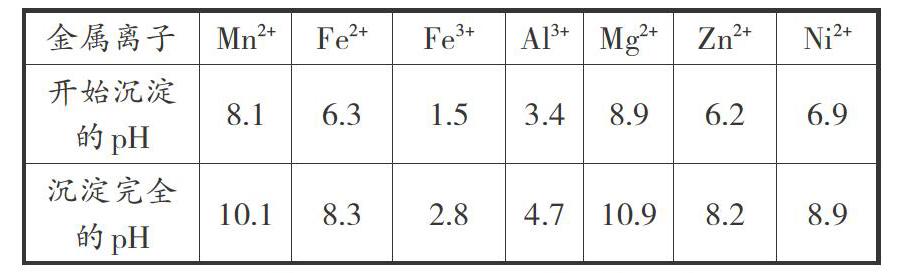
相关金属离子[C0(Mnn+)=0.1 mol·L-1”]形成氢氧化物沉淀的pH范围如下:
(l)“滤渣1”含有________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_________。
(2)“氧化”中添加适量的Mn02的作用是________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去zn2+和Ni2+,“滤渣3”的主要成分是________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_________。
解析:(1)问考查了元素在自然界中的存在状态及性质,需要注意硅在自然界中主要以Si02的形式存在,且Si02不与硫酸反应;“溶浸”过程中发生如下反应:Mn02+MnS+2H2S04=2MniS04+S+2H20,因此“滤渣1”含有S和Si02。(2)问中“氧化”过程添加Mn02的作用是将Fe2+氧化成Fe3+,通过调节溶液pH为2.8,使Fe3+完全沉淀,故答案为:将Fe2+氧化为Fe3+。(3)问中“调pH”除铁、铝时,要使铁和铝都沉淀完全,则pH应大于4.7。故答案为:4.7。(4)问中“除杂1”加入Na2+S后,生成沉淀ZnS和NiS,除去Zn2+和Ni2+,故答案为:NiS和ZnS。(5)问中由于存在MgF→←Mg2++2F-沉淀溶解平衡,若酸度过高,溶液中的H+与F结合生成弱电解质HF,使沉淀溶解平衡朝着溶解的方向移动,Mg2+沉淀不完全。故答案为:F-与H+结合形成弱电解质HF,MgF→←Mg2++2F-平衡向右移动。
考虑问题周到全面是解决本题的关键,题目给出的相关金属离子形成氢氧化物沉淀的pH范围非常重要,对于正确判断出除杂的离子、除杂的顺序、除杂过程中溶液pH值的要求提供了较多的信息,同时还要注意到题目本身在叙述过程中提供的信息。该题涉及的是基本理论知识在真实冶金情景中的应用,进一步强调了信息的获取能力和知识的应用意识。
从历年高考试题可以总结出,冶金工艺流程题考查的知识主要有以下几个方面:(1)加入试剂的作用,如加入酸的作用:浸溶、调节pH值、除杂;加入碱的作用:调节pH值、使某些离子转化为沉淀等;加入盐的作用:使某些离子转化为沉淀;加入氧化剂的作用:改变某些离子的价态,方便去除或保留。(2)涉及的操作:溶解、搅拌、过滤、蒸发等。(3)需要回答的问题:浸溶或除杂过程中方程式或离子方程式的书写、滤渣的主要成分、濾液中存在的物质或离子、加入某种溶剂的作用、加入氧化剂后氧化产物或还原产物的判断等。总之是将基础知识综合应用到实际中去。
3.重视化学用语的应用
化学用语是化学学科的一个显著特点,能够正确理解和使用化学用语是对化学学习的基本要求。试卷中回答第26题(1)(6)问用到化学式、化学方程式、离子方程式;第27题(1)(2)问用到仪器名称,(5)问用到纯化方法;第28题(4)问用到反应方程式;第35题(1)问用到元素名称、结构式;第36题(1)问用到化学名称,(2)问用到官能团,(3)问用到反应类型、分子式、结构简式。很显然,化学用语贯穿了高考化学的所有试题。
三、两点启示
教学活动是教师的“教”与学生的“学”的有机结合,只有二者都适得其法,才能事半功倍。通过对2019年高考全国卷Ⅲ理综化学试题的分析,笔者受到以下启示:
1.夯实基础,提高信息加工能力
《2018年普通高等学校招生全国统一考试大纲》规定,对化学学科学习能力的要求包括“接受、吸收、整合化学信息的能力”[5],具体内容有:“通过对自然界、生产和生活中的化学现象的观察,以及实验现象、实物、模型的观察,对图形、图表的阅读,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储。”“从提供的新信息中,准确地提取实质性内容,并与已有知识整合,重组为新知识块。”例如,第28题提供量化数据关系,给出HCl平衡转化率随温度变化的关系,要求学生从宏观和微观两个角度认识平衡常数K以及转化率;第27题提供转化流程信息,给出制备高纯硫酸锰的工艺图,以及相关金属离子形成氢氧化物沉淀的pH范围,要求学生分析流程图中的物质变化以及操作,结合所给数据,从中分析产物分离方法,同时结合已经学过的元素知识、反应原理等回答相关问题,考查学生对常见金属、非金属及其化合物的基本性质、沉淀溶解平衡等知识的掌握情况。
因此,在教师的“教”与学生的“学”的过程中,要回归教材,夯实基础,以考试大纲为纲,以课本为本,以基础知识为基石,以联系生活为升华,同时不忘培养学生的信息加丁能力和迁移能力。
2.重视应用,聚焦化学学科核心素养培养
化学是一门理论与实践相结合的科学,在提高人类生活水平和推动人类社会进步中具有非常重要的作用。2019年高考全国卷Ⅲ理综化学试题的情境多来源于生产、生活、社会和科研实际,并涉及环保、医药、材料、能源等多个学科,考查学生合理正确地使用化学原理与技术分析和解决实际问题的能力,由此可以引导学生关注与化学有关的社会热点问题,形成可持续发展的意识和绿色化学理念。例如,第13题以SCience报道的具有高稳定性和高循环效率的Zn-NiOOH二次电池为载体,将科学研究热点引入考题,考查新型电池结构、充放电原理、电极反应等内容;第7题涉及碘酒、铝合金、活性炭及高纯硅在生产和生活中的应用,考查学生的理解与辨析能力;第36题要求对比分析不同碱、不同溶剂对合成反应的影响,进而论证不同条件对Heck反应的影响,归纳条件简单、试剂简单、转化率高的合成反应条件,重点考查学生的归纳论证能力。因此学生在备考时要紧紧围绕主干知识进行复习,充分理解化学的核心思想,在保证思维扩散性的同时增强复习的针对性,加强理解与辨析能力、分析与推理能力、归纳与论证能力、探究与创新能力等关键能力的培养。
总之,作为中学化学教师,每年要关注和分析高考化学试题的特点,并及时调整教学的方向和思路;同时为了提高自身的知识水平,还应不断加强更深层次的学习,比如有机化学合成的方法论、元素化学的理论知识等,为自己的教学拓宽领域,给学生创造更广阔的知识空间;关注与专业相关的社会前沿问题和研究成果,拓宽学生的化学视野,让教师的“教”与学生的“学”取得双赢效果。
[参考文献]
[1]姜钢.探索构建高考评价体系 全方位推进高考内容改革[N].中国教育报,2016-10-11(3).
[2]于涵.不忘初心 推进新高考改革 面向未来 构筑现代化考试[J].中国高教研究,2018(3):17-23.
[3]教育部考试中心,贯彻改革要求 推动素质教育:2018年高考化学试题评析[J].中国考试,2018(7):24-28.
[4]中华人民共和国教育部,普通高中化学课程标准(2017年版)[s].北京:人民教育出版社,2018.
[5]教育部考试中心.2018年普通高等学校招生全国统一考试大纲:理科[M].北京:高等教育出版社,2017.
(责任编辑 罗艳)
