考马斯亮蓝G250法测定蛋白质含量的教学实践及方法学探讨
2020-07-16祝连彩唐士金周丽
祝连彩 唐士金 周丽

[摘 要] 该文研究之目的:考马斯亮蓝G250法测定蛋白质含量是生物化学实验教学的基本实验之一。为了更好地开展实验教学,对实际教学中发现的该方法组间稳定性及线性相关性存在的问题进行研究和探讨。之方法:在对问题出现原因进行解析的基础上,对影响实验稳定性的因素和线性范围进行了实验研究。之结果:发现该方法的显色稳定时间为60min,线性范围为1.0-30.0μg/mL。之结论:将研究成果引入实验教学,将有利于学生对于实验原理的理解,并消除学生对组间实验结果差异大的疑虑,提高实验教学效果。
[关键词] 蛋白质含量;考马斯亮蓝G250;显色稳定性;Lambert—Beer定律;线性范围
[作者简介] 祝连彩(1975—),女,山东费县人,工学博士,重庆大学生物工程学院、现代实验教学中心高级实验师,主要从事生物化学实
验、生物制药工程领域教学与研究。
[中图分类号] G642 [文献标识码] A [文章编号] 1674-9324(2020)23-0266-04 [收稿日期] 2019-10-16
蛋白质是生命的物质基础,是构成细胞的基本有机物,是生命活动的主要承担者。蛋白质含量测定法,是生物科学研究中最常用、最基本的分析方法之一,也是“生物化学实验”的重要教学内容之一。目前,常用蛋白质含量测定方法有凯氏定氮法、双缩脲法、Folin-酚试剂法、紫外吸收法和考马斯亮蓝法(Bradford法)[1-3]。其中考马斯亮蓝法是由Bradford于1977年根据蛋白质与染料相结合的原理设计的[4]。这一方法是目前灵敏度最高的蛋白质测定法,因而得到了广泛的应用[5-7]。考马斯亮兰G-250染料,在酸性溶液中通过氢键和范德华力与蛋白质结合,染料蛋白质复合物的最大吸收峰的波长由染料的465nm变为595nm,溶液的颜色也由棕黑色变为亮兰色[4]。在595nm下测定的吸光度值A595,与蛋白质浓度成正比。
一、学生实验结果的数据分析
(一)标准曲线制作方法
1.0~100微克/毫升标准曲线的制作。
取6支试管,按表1数据配制0~100微克/毫升牛血清白蛋溶液各1毫升:
准确吸取所配各管溶液0.1毫升,分别放入10毫升具塞试管中,加入5毫升考马斯亮蓝G-250试剂,盖塞,将试管中溶液纵向倒转混合,放置2分钟后用10毫米光径的比色杯在595nm下比色。绘制标准曲线。
2.0~1000微克/毫升标准曲线的制作。
另取6支试管,按表2数据配制0~1000微克/毫升牛血清白蛋白溶液各1毫升,按前述方法进行实验,绘制标准曲线。
(二)实验结果
共有10组同学开展实验,5个组进行0~100微克/毫升标准曲线的制作,另5个组进行0~1000微克/毫升标准曲线的制作。进行0~100微克/毫升标准曲线的制作的有2组同学出现操作失误,进行0~1000微克/毫升标准曲线的制作的有1组出现操作失误。我们对不存在操作失误的同学的数据进行了分析,结果见表3和表4。
从表3、表4的RSD项看,实验的标准偏差在13.6%~27.3%,在相同试剂和相同仪器条件下,组间的实验结果相差大,组间稳定性不好。从表3我们可以看到在反应体系蛋白质浓度0.39~1.96μg/mL范围内,溶液的吸光度值较小,除1个以外都在0.100以下,且在该浓度范围内,吸光度和蛋白质浓度的线性相关性低,第2组同学的线性相关系数最大,也仅是0.9711。表4的相关系数结果表明在反应体系蛋白质浓度3.92~19.61μg/mL范围内,吸光度和蛋白质浓度具有较好的线性相关性。
(三)存在问题
通过对操作过程和实验结果分析,我们认为造成组间实验结果差异大,线性相关性低的原因可能有:
1.显色时间不一样。同学们需要在规定的课堂时间完成实验,所以基本上是同时开始实验的。但由于实验室只有1台分光光度计,显色完成后测定的时间就无法控制一致。因此考马斯亮蓝G250与蛋白质的显色反应的时间稳定性可能是造成组间差异的重要因素。
2.操作方法。在两个浓度范围的标准曲线制作方法中,均是先配制系列蛋白质浓度的1mL的蛋白质溶液,再取0.1mL加入反应体系。由于0.1mL的量太少,而在本科实验教学中又不可能使用进口的高精度的移液器,易于造成误差。特别是在0~100微克/毫升牛血清白蛋溶液的配制中,移液量為20μL~100μL,更易造成组间差异。
3.线性范围。分光光度法被用来测定溶液中存在的光吸收物质的浓度,其理论依据是Lambert和Beer定律。而Lambert—Beer定律具有一定的适用范围,一般情况下,吸光值在0.2-0.8时,浓度与吸光度才具有良好的线性范围[ 10 ]。在吸光度小于0.2和大于0.8的情况下,线性是否良好,需要进行试验研究和探讨。
二、方法学探讨
针对上述问题,我们对考马斯亮蓝G-250法测定蛋白质含量的线性范围、显色稳定性、染料用量进行了研究。
(一)主要仪器和试剂
T6型紫外可见分光光度计,北京普析通用仪器有限责任公司,标准蛋白质溶液:称取牛血清白蛋白(Sigma公司),用蒸馏水配制成250μg/ml、250μg/ml和10μg/ml标准蛋白质溶液。考马斯亮蓝G-250试剂:考马斯亮蓝G-250(进口分装,上海进出口试剂公司)100mg溶于50ml 95%乙醇,加入100ml 85%磷酸,用蒸馏水稀释至1000ml,滤纸过滤。
(二)试验方法
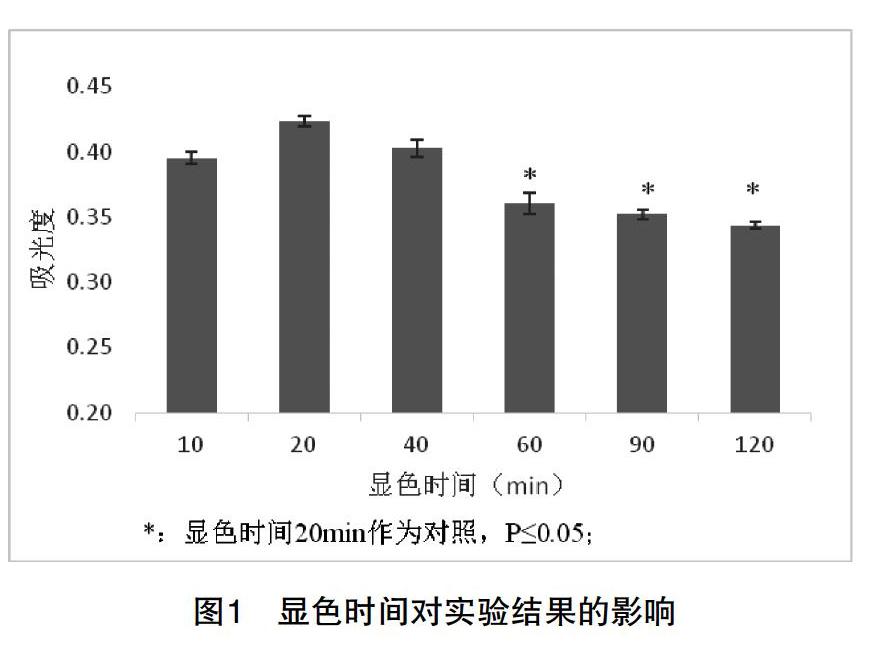
1.显色稳定性。取50.0微克/毫升牛血清白蛋白标准溶液1.0mL加入10毫升具塞试管中,在加入4.0mL考马斯亮蓝溶液,将试管中溶液纵向倒转混合,分别放置10min、20min、30min、40min、50min、60min、90min、120min后,在595nm下测定吸光度。每个时间点做3个平行,取平均值。
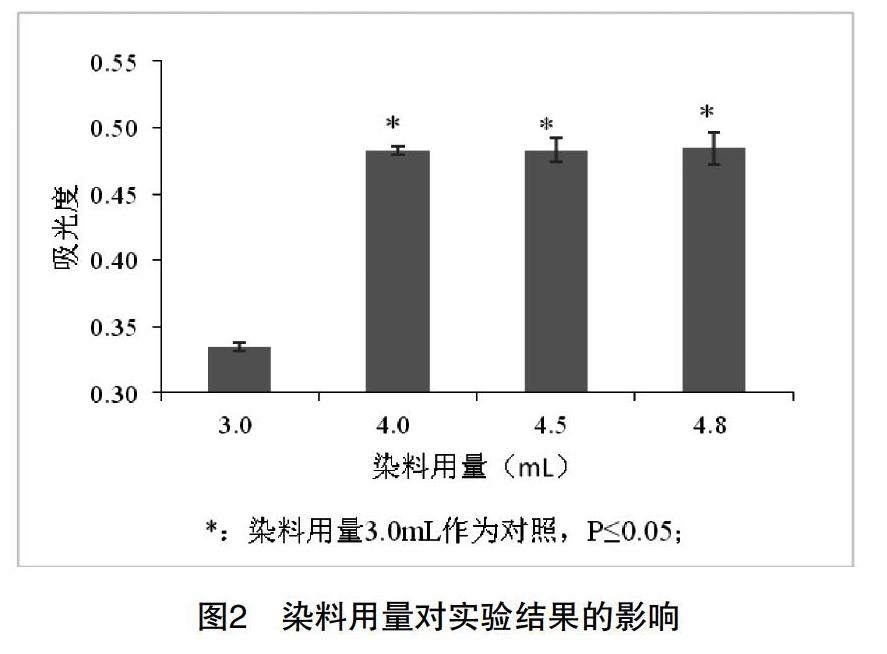
2.考马斯亮蓝G-250染色液的用量。在反应体系蛋白质浓度为10μg/mL的条件下,按表5考察染料用量对吸光值的影响。每管做3个平行,取平均值。
3.线性范围。按表6进行试验,考察蛋白质浓度0.2μg/mL~50.0μg/mL范围的线性。每管做3个平行,取平均值。
(三)数据处理
数据以平均值±标准偏差(x±SD)表示,应用SPSS 16.0 for Windows进行统计学分析。两组间比较采用t检验,P<0.05被认为具有统计学差异。
(四)试验结果与讨论
1.显色稳定性。从图1可知,在蛋白质浓度为10μg/ml时,显色时间在20min时,吸光度达到最大,为0.423。20min后,随显色时间的延长,吸光度降低,60min時降至0.361,与20min时的吸光度相比差异显著(P≤0.05)。显色60min后,吸光度趋于稳定,90min和120min的吸光度值与60min的相比无显著差异性。表明蛋白质与考马斯亮蓝G250的显色反应要达到60min后才能达到稳定。以往的生物化学实验教材中指出该显色反应在2min达到稳定,这导致很多方法学探讨的文献忽略了显色时间的研究。我们在以往的教学中也忽略了对学生实验显色时间的严格控制,这可能是造成在学生实验数据偏差大的主要原因。在学生实验中由于实验条件的限制(仪器的数量),可以要求学生控制标准曲线制作和样品测定的显色时间保持一致来确保含量测定的准确性。但在科学研究中,最好将显色时间控制在60min,显色稳定后再进行测定。
2.考马斯亮蓝G-250染色液用量的影响。在不同的实验指导教材中,染料的用量也存在不同。有些是0.1mL样品液加5mL染料;有些是1.0mL样品液加4mL或5mL染料[2,11,12]。为使实验结果稳定,利于实验教学,我们对染料用量进行了考察。
由图2可知,在显色体系蛋白质浓度一定的情况下,考马斯亮蓝G250用量为4.0mL、4.5mL和4.8mL时的吸光度显著高于3.0mL时的吸光度,p<0.05;而考马斯亮蓝G250用量为4.0mL、4.5mL和4.8mL时,三者间无显著差异,p>0.05。这表明染料用量过少会影响体系的吸光度,需达到4.0mL以上。染料用量过少会影响实验的稳定性,用量过多在大规模的教学实验中又会增加成本和和废液的处理量,因此实验中选择4mL的染料比较合适。
3.线性范围。为考察吸光度与显色体系蛋白质浓度间的线性关系,我们在0.2~50μg/mL范围内设置了13个浓度,显色后测定吸光度值,将数据进行线性回归,回归方程和标准曲线见图3.由图3可知,在0.2~50.0μg/mL、5.0~50.0μg/mL和0.1~1.0μg/mL的浓度范围内,蛋白质浓度和吸光度不具有良好线性关系,相关系数均小于0.99;在1.0~30.0μg/mL范围内,蛋白质浓度和吸光度具有良好线性关系,相关系数大于0.999。表明,蛋白质浓度大于30.0μg/mL或小于1.0μg/mL,蛋白质与考马斯亮蓝G250的显色反应都不再遵循Lambert-Beer定律,即考马斯亮蓝G250法测定蛋白质含量的线性范围为1.0~30.0μg/mL。文献中关于该方法线性范围有着很大的差别,有0~1000g/mL的,也有10~100μg/mL的[1,13],这些表述都是基于蛋白质标准样品的浓度,而非显色反应体系中蛋白质的实际浓度。我们的实验指导也采用了相同表述,比如在1.1和1.2中0~100μg/mL标准曲线的制作。线性范围应以显色反应体系的蛋白质浓度范围表示较为规范,利于学生对实验原理,特别是Lambert-Beer定律的理解。
三、结语
在实验教学过程中发现了学生实验组间稳定性差和低浓度标准曲线线性相关系数低的问题。在对问题出现原因进行解析的基础上,对影响实验稳定性的因素和线性范围进行了研究,确定了显色剂用量、显色稳定时间和该方法的线性范围。
参考文献
[1]张蕾,刘昱,蒋达和,等.生物化学实验指导[M].武汉:武汉大学出版社,2011,99-101.
[2]裴秀英.生物化学实验教学指导[M].西安:第四军医大学出版社,2009,24-25.
[3]李宁.几种蛋白质测定方法的比较[J].山西农业大学学报,2006,26(2):132-134.
[4]Sedmak JJ,Grossberg SE.A rapid,sensitive,and versatile assay for protein using Coomassie brilliant blue G250[J].Anal Biochem,1977,79(1-2):544-552.
[5]冯昕,王吉中,尧俊英,等.考马斯亮蓝法测定乳与乳制品中蛋白质含量[J].粮食与食品工业,2010,17(3):57-59.
[6]罗群.考马斯亮蓝法快速测定菜籽粕中可溶性蛋白质的含量[J].成都大学学报自然科学版(自然科学版),2014,33(2):125-127.
[7]王艾平,周丽明.考马斯亮蓝法测定茶籽多糖中蛋白质含量条件的优化[J].河南农业科学,2014,43(3):150-153.
Teaching Practice and Methodological Investigation of Protein Content Determination Using Coomassie Brilliant Blue G250
ZHU Lian-cai,TANG Shi-jin,ZHOU Li
(Modern Experiment Teaching Center,Bioengineering College,Chongqing University,Chongqing 400030,China)
Abstract:The Coomassie Brilliant Blue Method is widely used for the determination of protein and is also one of the basic experiments of biochemistry experiment teaching.In order to carry out the experimental teaching effectively,we studied the factors affecting the stability of the experiment and the linear range.The results show that the chromogenic reaction reaches to stability after 60 min and the linear range of this method is 1.0-30.0μg/mL.The results of the study will be beneficial to understanding the experimental principle,eliminating the bewilderment of students on the large difference among difference groups,and improving the effect of experiment teaching.
Key words:protein content;Coomassie Brilliant Blue G250;chromogenic stability;Lambert Beer's law;linear range
