含有机膦金炔三氮唑配合物的合成表征及晶体结构
2020-07-15谢婷婷倪青玲
谢婷婷,谢 瑶,倪青玲
(广西师范大学 化学与药学学院, 广西 桂林 541004)
有机膦-金配合物作为催化剂在有机合成反应中的应用一直是催化研究领域的热点之一,许多金配合物被证实能有效地催化活化炔烃、烯烃,甚至芳香化合物。然而大部分有机膦-金配合物具有催化活性的中间体稳定性不好,导致其催化活性及应用受到诸多限制,因此合成新型的有机膦-Au配合物并研究其结构与性质具有重要的意义。同时有机膦-金配合物在材料、生物活性等方面具有重要的应用价值[1-3]。
1,2,3-三氮唑及其衍生物是一类在农业、工业、制药以及高分子材料等领域有着广泛应用的五元氮杂环化合物[4-5],通常是用金属炔配合物与叠氮化物[3+2]环加成而得。1,2,3-三氮唑的有效合成对实现1,2,3-三氮唑的广泛应用具有实际意义。金配合物是以Au(Ⅰ)或Au(Ⅲ)离子为中心与含氮、膦、碳等原子形成的配体结合而成的配合物,目前已经合成许多含Au-C[6-7]的配合物,其中合成含Au的1,2,3-三氮唑配合物[8-9]是研究的热点之一。Huisgen等[10]第一次报道了炔与叠氮化物的环加成反应,该反应需要在高温或者高压下进行,其选择性较差且得到的产物大多数是混合物。Croatt小组[11]在无金属催化的作用下,以叠氮和端炔为原料,在-78 ℃加入正丁基锂,可以合成1,2,3-三氮唑配合物,但低温反应条件苛刻。Meldal小组[12]报道Cu(I)为催化剂在常温下可以催化合成1,2,3-三氮唑配合物。Zhang等[13]用Ru成功催化炔与有机叠氮化物的反应,其优点是具有立体的选择性。Teets课题组[14-15]和DEL CASTILLO等[16]利用金属叠氮化物和金属乙炔化合物进行1,3偶极环加成,得到1,2,3-三氮唑配合物。选用不同的金属离子,或不同种类的金属炔配合物,为合成多种1,2,3-三氮唑配合物提供更多的可能。
本文采用新颖的有机膦-Au作为合成1,2,3-三氮唑的催化剂,常温反应,可以有效合成1,2,3-三氮唑配合物。通过具有一定空间限制的含富π电子的芳香环双膦配体合成金配合物,配体上吡啶环的空间位阻效应,促使富π电子芳香环与Au+形成Au…π弱作用稳定有机膦-Au配合物[17],从而稳定或提升配合物的催化活性,提高催化反应效果,实现有机炔和重氮盐的环加成反应生成三氮唑化合物。
1 实验部分
1.1 试剂与仪器
所有试剂均通过商业途径购买,用前未经进一步处理。[AuCl(THT)](THT = 四氢噻吩)、配体L1和L2参考文献[18]合成。
1.2 配合物晶体结构测定
选取合适的晶体置于X-射线单晶衍射仪上,用经石墨单色器单色化的MoKα-射线(λ=0.071 073 nm),在 293 K采用ω-2θ扫描方式进行数据收集,配合物的晶体结构用直接法解出,经过多轮 Fourier法合成获得全部非氢原子坐标,用差值 Fourier法合成产生氢原子。全部非氢原子坐标及各向异性热参数经全矩阵最小二乘法修正收敛,所有计算均用SHELXS-97和SHELXL-97[19-20]程序完成。
1.3 配合物的合成
配合物1—6的合成路线如图1所示。

图1 配合物1—6合成路线
1.3.1 Au2(L1)Cl2(1)配合物的合成
将12.0 mg AuCl(THT)( 37.5 μmol)溶于6 mL二氯甲烷和甲醇的混合溶液(体积比1∶1),加入11.0 mg L1配体(16 μmol),室温搅拌2 h,过滤,常温乙醚扩散,3 d后紫红色块状晶体析出,产率80%。
1H NMR(500 MHz, CDCl3): 8.45(s, 4H, 2PyH), 7.66(m, 8H, PhH), 7.52(t, 4H, PhH), 7.45(t, 8H, PhH), 7.08(s, 4H, 2PyH), 6.76(s, 4H, N-C6H4-N), 4.52(s, 4H, NCH2Py), 4.31(d,J=7.5 Hz, 4H, NCH2P)。IR(KBr, cm-1): 3 054(υAr-H), 1 668, 1 513(υC=C), 1 418(υC-H)。
1.3.2 Au2(L1)(C≡CPh)2(2)配合物的合成
称取12.0 mg AuCl(THT)( 37.5 μmol)溶于6 mL二氯甲烷和甲醇的混合溶液(体积比1∶1),加11.0 mg L1配体(16.0 μmol),室温搅拌2 h,在溶液中加10 μL苯乙炔(91.1 μmol)、三乙胺10 μL,继续搅拌2 h,溶液由紫色变为黄色,常温下无水乙醚扩散,3 d后析出黄色的块状晶体,产率75%。
1.6 统计分析 数据由双人录入,建立数据库,采用SPSS 16.0统计软件进行数据处理,计数资料采用百分比描述,计量资料采用均数±标准差描述,构成比的比较采用卡方检验。
1H NMR(500 MHz, CDCl3): 8.43(d, 4H, 2PyH), 7.68~7.59(m, 8H, PhH), 7.55~7.36(m, 18H, PhH), 7.21(d, 4H, PhH), 7.12(d, 4H, 2PyH), 6.72(s, 4H, N—C6H4—N), 4.44(s, 4H, NCH2Py), 4.40(d,J=5.9 Hz, 4H, NCH2P)。IR(KBr, cm-1): 2 978, 2 903(υAr-H), 2 114(υC≡C),1 595(υC=C), 1 418(υC-H)。
1.3.3 Au2(L1)(phenyltriazole)2(3)配合物的合成
称取12.0 mg AuCl(THT)( 37.5 μmol)溶于6 mL甲苯和四氢呋喃的混合溶液(体积比1∶1),加11.0 mg L1配体(16 μmol)搅拌4 h,再加10 μL苯乙炔(91.1 μmol)、10 μL三乙胺,继续搅拌12 h,再加入10 μL叠氮基三甲基硅烷(75.5 μmol)和甲醇0.5 mL,搅拌8 h,过滤,用正戊烷扩散,3 d后产生黄色块状晶体,产率72%。
1H NMR(500 MHz, MeOD): 8.07(m, 6H, PyH和PhH), 7.81(m, 8H, 2PyH), 7.53(d, 16H, PhH), 7.22(m, 8H, PhH), 6.81(d, 4H, N—C6H4—N), 4.50(s, 4H, NCH2Py), 4.04(d,J=6.0 Hz, 4H, NCH2P)。IR(KBr, cm-1): 3 052, 2 935(υAr-H), 1 600(υC=C), 1 419(υC-H)。
1.3.4 Au2(L2)Cl2(4)配合物的合成
称取13.0 mg AuCl(THT)(40.6 μmol)溶于6 mL二氯甲烷和甲醇的混合溶液(体积比1∶1),加12.0 mg L2配体(13 μmol)搅拌2 h,将溶液过滤,无水乙醚扩散,3 d后紫红色的块状晶体析出,产率80%。
1H NMR(500 MHz, CDCl3): 8.61(d, 2H, 2PyH), 7.94(d, 2H, N—C10H6—N), 7.62(s, 12H, PhH), 7.45(d, 6H, 2PyH), 7.39(m, 10H, PhH), 7.32(t, 4H, N—C10H6—N), 4.57(m,J=8.1 Hz,8H, NCH2Py和NCH2P)。IR(KBr, cm-1): 3 053(υAr-H), 1 585(υC=C), 1 427(υC-H)。
1.3.5 Au2(L2)(C≡CPh)2(5)配合物的合成
称取13.0 mg AuCl(THT)( 40.6 μmol)溶于7 mL二氯甲烷和甲醇的混合溶液(体积比5∶2),加12.0 mg L2配体(13.0 μmol)搅拌2 h,加10 μL苯乙炔(91.1 μmol)、10 μL三乙胺,继续搅拌4 h,室温下用无水乙醚扩散,3 d后无色块状晶体析出,产率75%。
1H NMR(500 MHz, CDCl3): 8.44(d, 2H, 2PyH), 7.87(d, 2H, N—C10H6—N), 7.50(m, 10H, PhH), 7.38(m, 8H, PhH), 7.30(m, 8H, N—C10H6—N和PyH), 7.23(d, 4H, PyH), 7.09~7.18(m, 10H, PhH), 4.67(s, 4H, NCH2Py), 4.55(d,J=11.5 Hz, 4H, NCH2P)。IR(KBr, cm-1): 3 051(υAr-H), 2 109(υC≡C), 1 586(υC=C), 1 431(υC-H)。
1.3.6 Au2(L2)(phenyltriazole)2(6)配合物的合成
称取13.0 mg AuCl(THT)( 40.6 μmol)溶于三氯甲烷中,加12.0 mg L2配体(13 μmol)搅拌4 h,再加10 μL苯乙炔(91.1 μmol)、10 μL三乙胺,继续搅拌12 h,加10 μL叠氮基三甲基硅烷(75.5 μmol)和甲醇0.5 mL,搅拌8 h,过滤,用无水乙醚扩散,4 d后得到无色块状晶体,产率58%。
1H NMR(500 MHz, d6-DMSO): 14.20(s, 2H, 2NHN), 8.46(s, 2H, 2PyH), 8.00(d, 4H, 2PyH), 7.62(d, 12H, PhH), 7.34(d, 14H, PhH), 7.21(s, 8H, PyH和PhH), 7.04(s, 4H, PhH), 4.78(s, 4H, NCH2Py), 4.57(d,J=12.7 Hz, 4H, NCH2P)。IR(KBr, cm-1): 3 058(υAr-H), 1 593(υC=C), 1 429(υC-H)。
2 结果与讨论
所有配合物通过红外和核磁进行表征,并通过X-射线单晶衍射确定了配合物1、3、5和6的晶体结构,它们的晶体学数据和部分键角和键长分别见表1和表2,分子结构如图2~5。这些金配合物的合成反应条件温和,产率较高。配合物的晶体结构显示这些配合物中有机双膦配体均采取反式构型与一个Au原子配位。从晶体结构可以看出Au原子与含富π电子芳香胺环形成弱的Au…Carene作用[21-22],这些弱作用和配体空间限域作用的协同效应导致了配体采取反式构型配位。4个配合物中Au…Carene作用在图2~5显示,其参数列于表2,通常认为Au…Carene距离在0.295~0.338 nm是非配体配位的Au…π作用。配合物1和6中可认为是Au与芳香环采取的η1-C…Au作用,而配合物3和5中认为是Au与芳香环采取的η2-C…Au作用。由于配体L1中苯胺环的电子密度大于L2中萘胺的电子密度,使得配合物3中Au…Carene作用相对强些,这也可从配合物3中Au…Carene距离比配合物5和6中的Au…Carene距离略短得到佐证。然而配合物1中的Au…Carene距离相对于配合物3中的Au…Carene距离长主要源于配合物1中Cl-较强的吸电子能力使得Au…π作用减弱。这些配合物中Au—P、Au—Cl和Au—C键长与文献报道的该类配合物[23-27]基本相符。相应配合物中P—Au—Cl和P—Au—C键角均接近180°说明Au原子采取线性配位模式。而与P原子相关的键角处于108°左右,说明P原子处于四面体几何构型。

表1 配合物1、3、5和6的晶体学参数

表2 配合物部分键长和键角
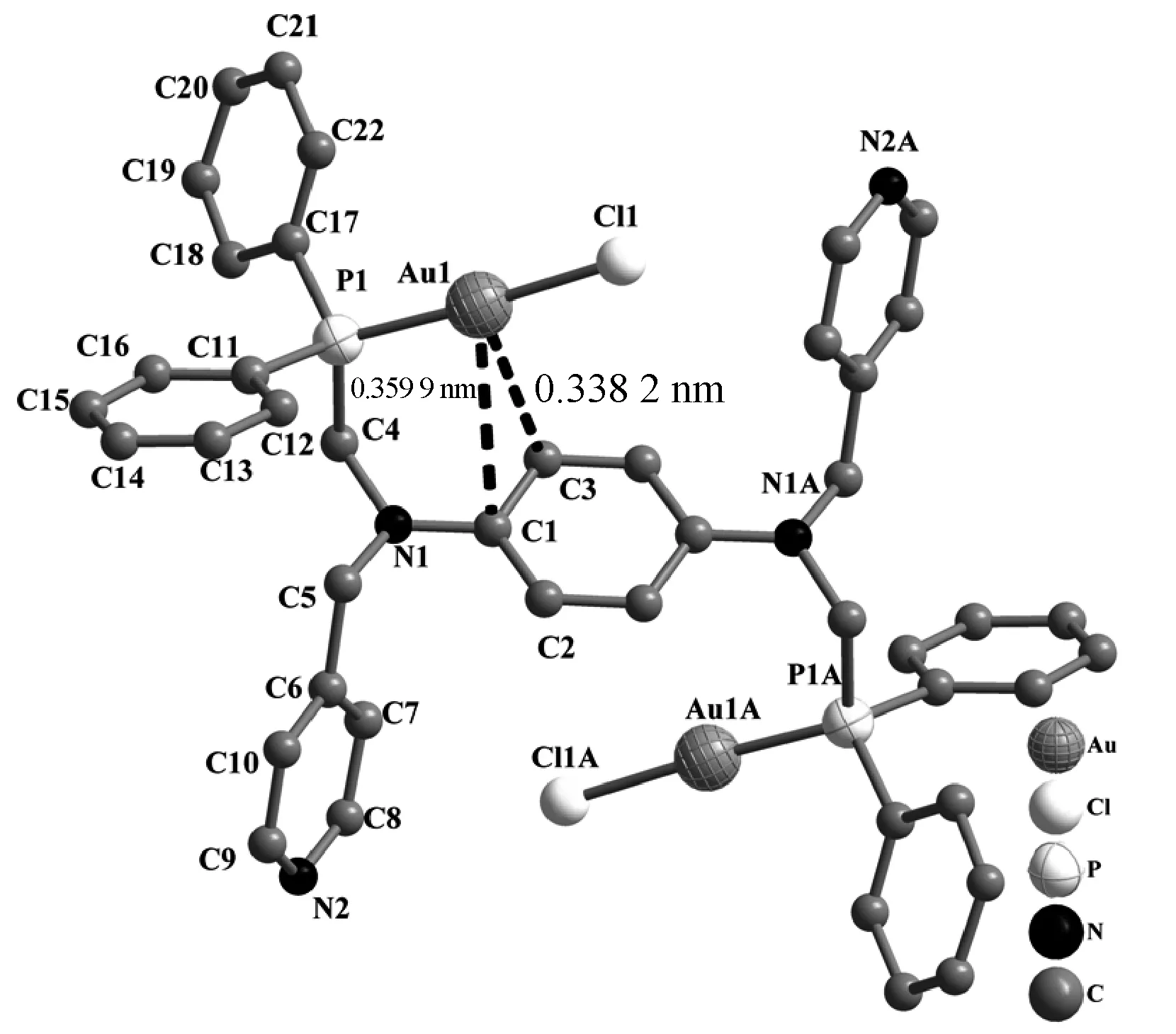
图2 配合物1的分子结构和弱的Au…π作用
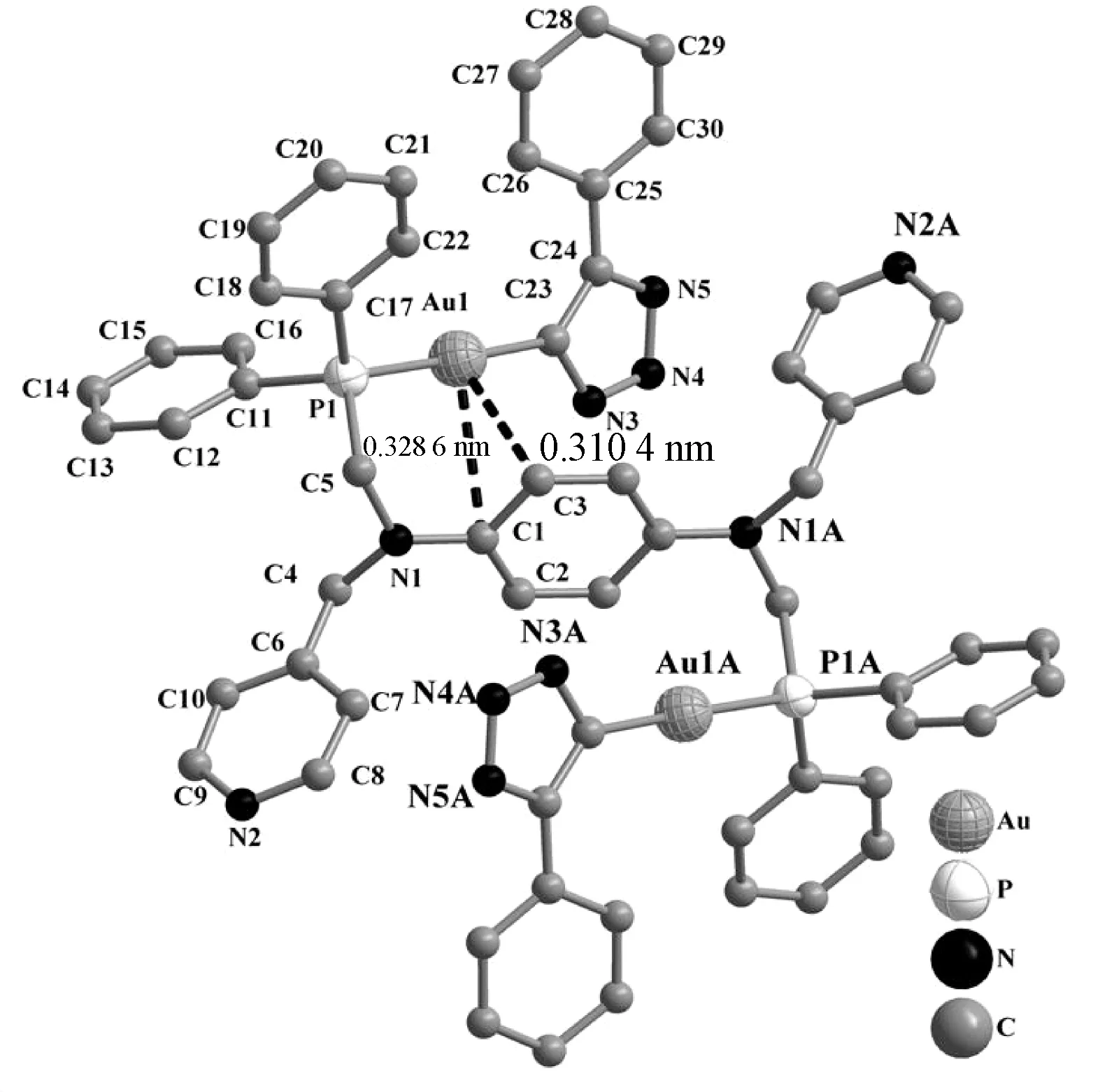
图3 配合物3的分子结构和弱Au…π的作用

图4 配合物5的分子结构和弱的Au…π作用

图5 配合物6的分子结构和弱的Au…π作用
3 结论
本文报道了配体N,N′-二[(二苯基膦)亚甲基]-N,N′-二(4-吡啶甲基)-对苯二胺(L1)和N,N′-二[(二苯基膦)亚甲基]-N,N′-二(2-吡啶甲基)-对萘二胺(L2)与金盐生成的膦-金配合物;膦-金配合物和苯乙炔生成金炔配合物;最后用金炔配合物与叠氮基三甲基硅烷合成三氮唑配合物,合成6个结构新颖的膦-金配合物,并通过红外、单晶结构、核磁等进行了表征。
