一种发酵罐喷雾补料装置的设计和验证方法
2020-07-15李国华熊海波梅漫莉徐庆阳
李国华,熊海波,梅漫莉,陈 宁,2,徐庆阳,2
(1.天津科技大学 生物工程学院,天津 300457;2.代谢控制发酵技术国家地方联合工程实验室,天津 300457)
现有氨基酸发酵过程中为了减少底物抑制,提高发酵生产效率和提高设备利用率,大多进行分批补料发酵,在发酵过程中及时的根据工艺需求向发酵罐内补充氨水、氢氧化钠、葡萄糖或其他营养物质[1-2]。重组大肠杆菌虽然作为重要的工业微生物被广泛应用于氨基酸发酵领域,但是大肠杆菌环境抗逆性差[3-4],对环境变化敏感。当前氨基酸发酵罐补料大多从发酵罐顶部单股注入(大型发酵罐罐从风管道流加液氨),在发酵罐(特别是大型发酵罐)中由于传质能力的限制[5-6],极易造成局部糖液浓度过大,引起局部糖浓度过高和局部供糖不足,引起乙酸等其他杂酸生成[7-8]。因为发酵罐传质能力限制[9-10],引起发酵培养基中的pH梯度或者底物浓度梯度现象,往往会引起工程师判断失误,严重的降低了发酵控制水平,造成生化反应速度变慢、发酵周期延长、糖酸转化率低和浪费严重等后果[11]。为解决上述问题,有必要研发一种新型的能够改善发酵补料过程传质效率的装置或设备。
1 材料与方法
1.1 材料与设备
1.1.1 菌 种
L-酪氨酸生产菌株大肠杆菌TYR-03,天津科技大学代谢工程实验室提供。
1.1.2 主要设备
2T机械搅拌通风发酵罐,无锡市宜欣制药设备厂;200 L二级种子罐,镇江东方生物设备技术有限公司;30 L一级种子罐,镇江东方生物设备技术有限公司;SBA-40ES生物传感分析仪,山东省科学院生物研究所;S-433D全自动氨基酸分析仪,赛卡姆(北京)科学仪器有限公司,ABER活细胞在线分析仪,艾利特国际贸易(香港)有限公司。
1.1.3 示 踪 剂
用质量分数为99.99%的高纯度氯化钾配置成1 mol/L的氯化钾溶液。
1.1.4 培 养 基
种子培养基(质量浓度):葡萄糖30 g/L,酵母粉5 g/L,硫酸铵4 g/L,磷酸二氢钾3 g/L,七水硫酸镁2 g/L,柠檬酸钠2 g/L,苯丙氨酸0.5 g/L,一水硫酸锰1.2 mg/L,七水硫酸亚铁5 mg/L,VH1 mg/L。
发酵培养基(质量浓度):葡萄糖18 g/L,酵母粉5 g/L,硫酸铵5 g/L,磷酸二氢钾4 g/L,七水硫酸镁2 g/L,谷氨酸0.1 g/L,一水柠檬酸2 g/L,甲硫氨酸1 g/L,苯丙氨酸0.5 g/L,一水硫酸锰10 mg/L,七水硫酸亚铁30 mg/L,VH1 mg/L。
另外,在种子培养基和发酵培养基中各添加VBX0.5 mL/L,发酵培养基中添加微量元素混合液1.5 mL/L。其中VBX为维生素B1,B3,B5,B7,B12等比例配制成10 mg/mL的混合液。
1.2 试验方法
1.2.1 混合效果的测定
采用1 mol/L的氯化钾溶液作为示踪剂,按照1%体积比加入装有去离子水中发酵罐中,控制发酵罐搅拌转数100 r/min,通风流量4 m3/h,温度36 ℃,装填系数60%,对照组从罐顶补料口加入发酵罐,实验组利用喷雾补料装置迅速加入发酵罐。活细胞在线分析仪[12]插入发酵罐中部的溶氧电极插口,用活细胞在线分析仪测量电导率的功能来获取发酵罐中电导率随时间的变化规律。
1.2.2 菌种活化
从-80 ℃冰箱取出保菌管,用接种环接种并均匀涂布在固体LB试管斜面培养基上,36 ℃培养12 h至斜面布满菌苔,然后把试管斜面菌苔用接种环接种并均匀在2个装有固体LB斜面培养基的500 mL茄形瓶中,36 ℃培养12 h。
1.2.3 种子扩培
用无菌水洗下茄形瓶中的菌苔,火焰接种于一级种子罐,36 ℃培养8 h左右至生物量OD60020,并按照10%的体积比压差接种于二级种子罐,36 ℃进行二级种子培养,种子培养过程中用质量分数为25%氨水调节pH 7.0,调节转速和通风流量控制溶氧20%以上。
1.2.4 发 酵
二级种子培养至生物量OD60020,压差接种于发酵罐,36 ℃开始分批补料发酵。发酵过程中用质量分数为25%氨水调节pH 7.0,调节转速和通风流量控制溶氧,流加质量体积分数60%的葡萄糖控制发酵液残糖0~5 g/分批补料发酵。
对照组:氨水和流加葡萄糖从发酵罐顶部补料口单股注入;实验组:使用喷雾补料装置注入发酵罐。
1.2.5 生物量的测定
采用比浊法估计生物量[13],即用分光光度计测量600 nm波长条件下检测发酵液吸光度,必要时发酵液适当稀释至0.2~0.8的范围,其生物量=吸光度×稀释倍数。
1.2.6 有机酸(杂酸)浓度的测定
采用氨基酸分析仪和示差液相分析仪进行测定[14-15]。
1.2.7 数据统计与分析
所有试验平均3次,采用Excel和OriginPro 2018c进行计算并绘图,显著性分析置信水平P=0.05;发酵罐结构图采用AutoCAD 2016进行绘制。
2 设计方案和工作过程
2.1 设计方案
一种发酵罐喷雾补料装置,包括第一管道、第二管道、第三管道、流量计、第一压力表、空气滤膜、第四管道、文丘里管[12]、无菌空气阀、高压蒸汽阀、补料阀、顶部进料阀和底部进料阀(图1)。如图1所示,第三管道左端经无菌空气阀与第一管道连通、经高压蒸汽阀与第二管道连通,右端经空气滤膜与文丘里管连通,文丘里管下部经补料阀与第四管道连通,文丘里管右端经三通后分为两管道分别经顶部进料阀和底部进料阀进入发酵罐,发酵罐内设的顶部分布器左端与顶部进料阀相连,发酵罐内设的底部分布器左端与底部进料阀相连。

1—第一管道;2—第二管道;3—第三管道;4—流量计;5—第一压力表;6—空气滤膜;7—第四管道;8—文丘里管;9—支撑架;10—第二压力表;11—第五管道;12—顶部分布器;13—喷头;14—底部分布器;K1—无菌空气阀;K2—高压蒸汽阀;K3—补料阀;K4—顶部进料阀;K5—底部进料阀;K6—尾气阀。图1 发酵罐喷雾补料装置结构示意图Fig.1 Fermenter structural diagram of a spray apparatus feeding
文丘里管左端经过空气滤膜接通无菌空气,下部经过补料阀接通补料罐、右端经分布器进入发酵罐,无菌空气经文丘里管流速变大、气压变小,待补加料液经文丘里管迅速稀释和雾化。
发酵罐的罐体内设有罐体搅拌器,发酵罐还包括支撑架、第二压力表、第五管道、顶部分布器、底部分布器和尾气阀,其中发酵罐的罐体外部顶端安装有第二压力表和第五管道,第五管道上设置有尾气阀。图1顶部分布器通过支撑架与罐体焊接固定悬挂于发酵罐内部顶端,底部分布器通过四根支撑架与罐体焊接固定,支撑架通过四根支撑架托举底部分布器于发酵罐内部的底部。
图2为沿图1中A-A线和B-B线的截面示意图。顶部分布器和底部分布器均为环形圆管,下部开孔接通多个喷头,可以使料液进一步分散和物化,以喷雾方式进入发酵罐。第一管道、第二管道和第四管道上分别接通无菌空气、高压蒸汽和补料瓶/罐。发酵罐喷雾补料装置,第三管道的管道上部分别接通流量计和第一压力表。
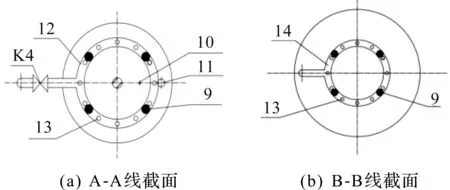
图2 截面示意图Fig.2 Schematic section
2.2 工作过程
2.2.1 灭菌过程
如图1,2所示,灭菌时应无菌空气阀K1、补料阀K3关闭,高压蒸汽阀K2、顶部进料阀K4和底部进料阀K5打开,高压蒸汽从第二管道2,对第三管道、空气滤膜6、文丘里管8、顶部进料阀K4、底部进料阀K5、顶部分布器12、底部分布器14、喷头13、发酵罐罐体、第五管道11、尾气阀K6及培养基进行灭菌,灭菌过程注意监控第一压力表与第二压力表示数,控制各阀开闭。
2.2.2 通风过程
如图1,2所示,通风时应高压蒸汽阀K2、补料阀K3关闭,无菌空气阀1、底部进料阀K5、顶部进料阀K4和尾气阀K6打开,无菌空气依次从第一管道1、无菌空气阀K1、第三管道3、空气滤膜6文丘里管8、顶部进料阀K4、底部进料阀K5、顶部分布器12、底部分布器14和喷头13,进入发酵罐用于雾化物料、保持正压和为发酵提供氧气,最后尾气经尾气阀K6从第五管道11排出。通气过程中观察压力表和流量计,调整各阀开闭程度。
2.2.3 补料过程
图3为分布器喷雾补料示意图。补料时应高压蒸汽阀K2关闭,无菌空气阀1、补料阀K3、顶部进料阀K4、底部进料阀K5和尾气阀K6打开,补加料液经补料阀进入文丘里管8被高速无菌空气初步雾化,可以经顶部或底部单独或同时经过顶部进料阀K4、底部进料阀K5进入分布器见图3(a),在经过喷头13二次雾化,喷入发酵罐见图3(b),进行补料。发酵尾气经第五管道和尾气阀K6排出,观察压力表和流量计,调整各阀开闭程度。
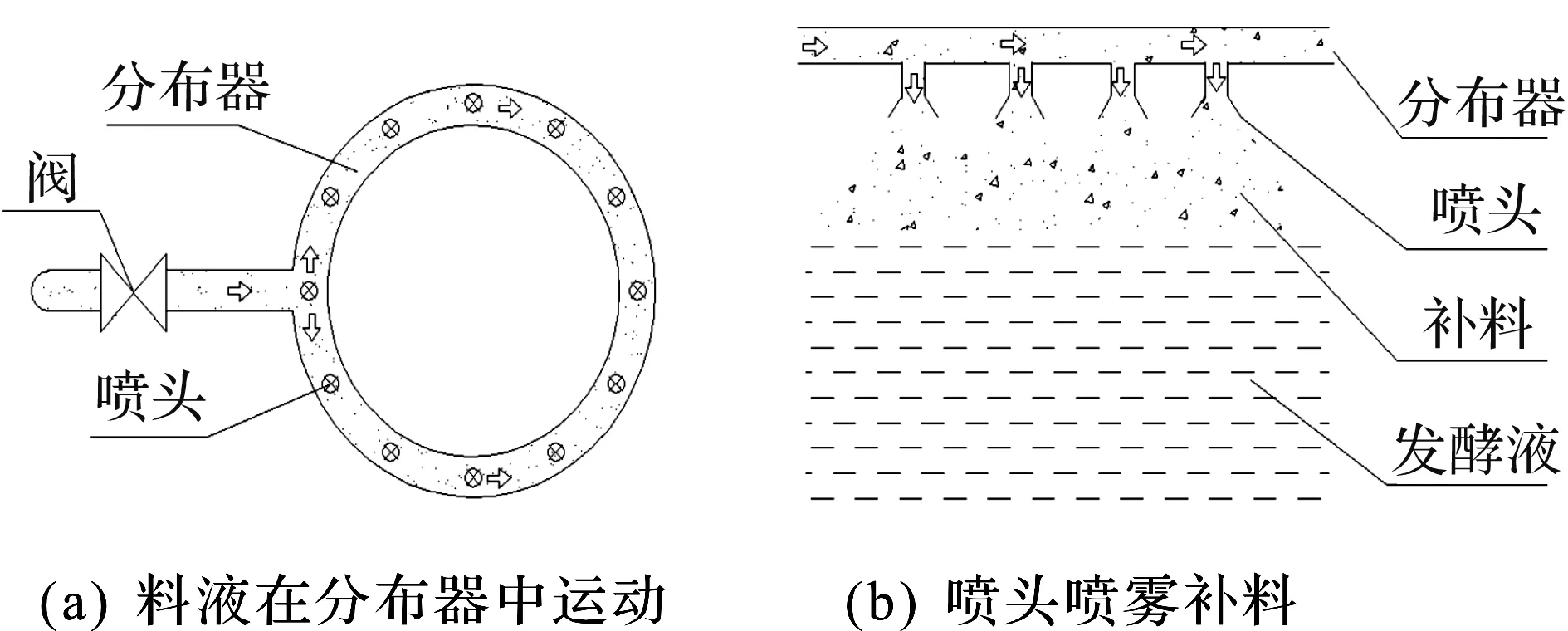
图3 分布器喷雾补料示意图Fig.3 Distributor spray repair material
3 实验验证
为验证该装置设计的可行性,对2T机械搅拌通风发酵罐进行适当改造,并通过测定混合效果和酪氨酸发酵实验进而验证喷雾补料装置强化传质的能力。
3.1 混合效果实验
一定量的电解质(氯化钾)溶液[14-16]加入到装有去离子水的发酵罐中,经过一定时间的扩散运动,氯化钾电离后以离子形态会从发酵罐溶液的局部逐渐分散混合到整个发酵罐,最终氯化钾的的均相溶液,发酵罐中溶液的电导率从低水平上升到高水平[17-18],记从0 mS/m到电导率最大值的90%所用的时间为混合时间。发酵罐的传质能力强弱与混合时间长短呈反相关,即混合时间越短,发酵罐混合效果越好、传质能力越强;混合时间越长,发酵罐混合效果越差、传质能力越弱。
图4为对照组和实验组以氯化钾为示踪剂注入发酵罐后电导率变化。由图4可知:对照组和实验组以不同方式在设定条件下加入氯化钾后电导率逐渐由0 mS/m(低水平)升高到13.23 mS/m(高水平14.7 mS/m的90%),实验组(A点)混合时间12 s,对照组(B点)混合时间14.8 s,实验组比对照组混合时间同比减少23.3%。这是因为采用喷雾补料装置的实验组在补加氯化钾溶液时从发酵罐顶端分布器和底部分布器2个部位补加氯化钾溶液,而且经过文丘里管和喷头对氯化钾溶液的多级雾化和分散,使进入发酵罐内能够在较短的混合时间迅速的扩散成均相溶液;而对照组采用从发酵罐顶部补料口单股注入氯化钾溶液的方式,氯化钾溶液局部质量浓度较大,分散成均相溶液的混合时间较长。因此,初步判定采用喷雾补料装置后能够提高发酵罐传质效果,且同比提高23.3%。
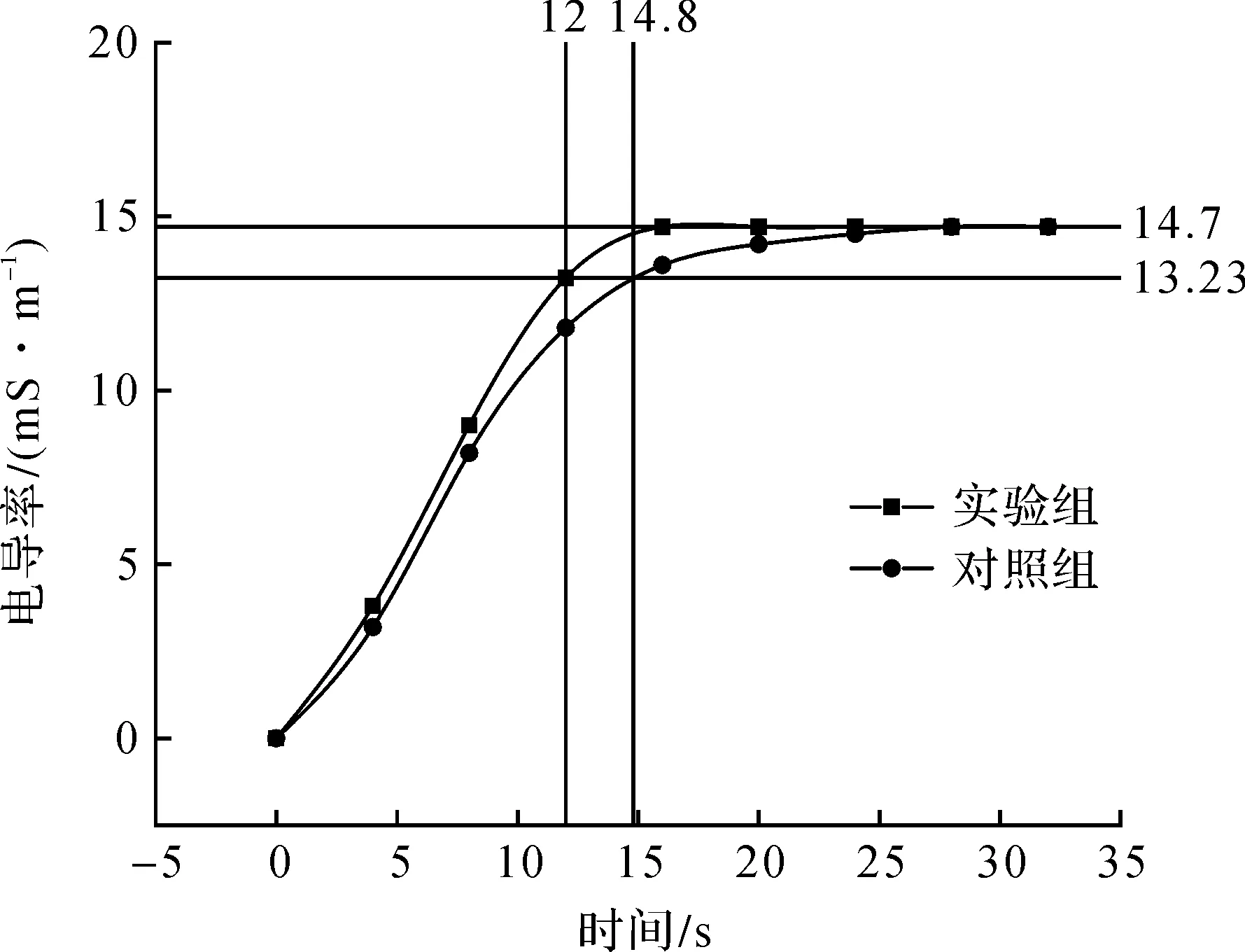
图4 发酵罐电导率变化Fig.4 Fermenter conductivity changes
3.2 酪氨酸发酵实验
以大肠杆菌发酵酪氨酸为例,比较发酵罐对照组和实验组的发酵参数,并以发酵强度为判断传质能力强弱的标准,从而验证该装置可以提高发酵罐的传质能力。图5,6为发酵罐改造前(对照组)后(实验组)酪氨酸质量浓度、生物量和副产物(杂酸)的变化趋势。
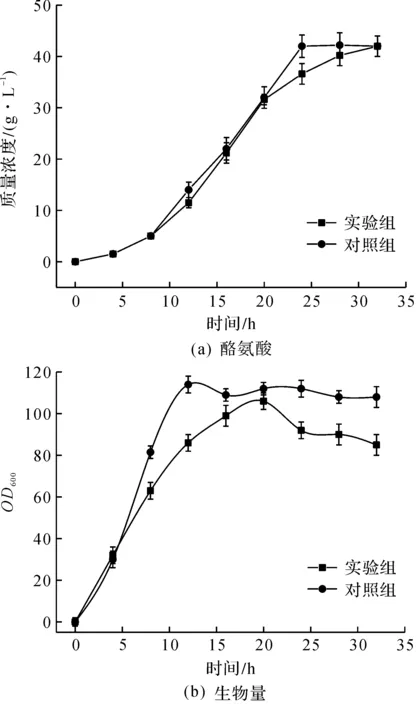
图5 对照组和实验组酪氨酸质量浓度和生物量变化趋势Fig.5 Tyrosine production and biomass trends before and after the transformation fermenter
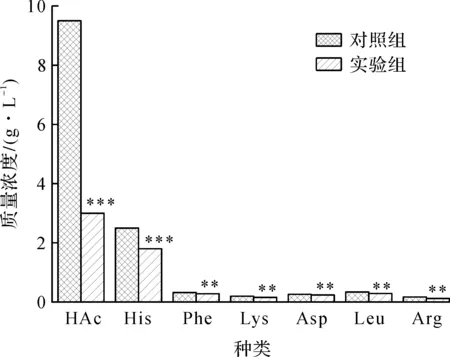
图6 对照组和实验组杂酸变化趋势Fig.6 Changes in trends before and after the organic acid content transformation fermenter
由图5,6可知:实验组采用喷雾补料装置发酵罐在进行酪氨酸发酵时,各项发酵指标均有改进;达到酪氨酸最高质量浓度42 g/L时实验组比对照组减少用时4 h,发酵强度由1.5 g/(L·h)提高至1.8 g/(L·h),同比提高20%;实验组生物量和生长速率明显低于对照组,在发酵进行到20 h后,对照组生物量开始大幅下降而对照组生物量基本不变,发酵结束时生物量同比提高27%。这是因为对照组发酵罐在进行酪氨酸发酵时由于传质效果不好,存在pH梯度和葡萄糖梯度,造成局部氨水和葡萄糖浓度过高或过低,容易损伤菌体细胞和导致杂酸生成,特别是乙酸的积累,对细胞产生毒害作用,造成发酵中后期细胞生长速率下降(图5中8 h后),甚至引起细胞早衰死亡,生物量过早下降(图5中20 h后),发酵产酸(L-酪氨酸)能力下降。同时,利用氨基酸分析仪和示差液相检测发酵液中的其他有机酸(杂酸)的种类和质量浓度,发现大于1 g/L的有机酸的种类没有变化,而实验组有机酸质量浓度较对照组均有下降,特别是乙酸质量浓度下降3.2倍,杂酸总质量浓度同比下降56%,糖酸转化率同比提高17%。这是由于实验组发酵罐传质效果的提高,对细胞的发酵生产酪氨酸目标代谢有积极的促进作用,减少了杂酸的生成,使得更多的底物转化为产物(L-酪氨酸),有利于减少浪费,提高经济性能。因此,以发酵强度为传质能力的标准,经过大肠杆菌发酵L-酪氨酸实验验证了发酵罐喷雾补料装置能够提高发酵罐的传质能力,并且传质能力同比提高20%。
4 结 论
设计了一种发酵罐喷雾补料装置,将待补加料液经过文丘里管雾化,初步分散成小液滴,通过发酵罐底部的空气分布器或发酵罐顶的分布器喷头进行二次雾化,喷雾进入发酵液,可以完成对发酵液的均匀补料;对2T机械搅拌通风发酵罐进行改造,经过氯化钾溶液混合实验和大肠杆菌发酵生产L-酪氨酸实验,证实该装置提高发酵罐传质能力20%~23.3%;发酵罐喷雾补料装置可以有效地克服由于传质性能差、物料混合效果差造成局部pH梯度和底物质量浓度梯度的缺陷,提高发酵罐传质能力,提高生化反应速率,减少杂酸产生,提高糖酸转化率,减少浪费。
