表达NADP+型甲酸脱氢酶重组大肠杆菌的高密度发酵研究
2020-07-15汤利文
赵 翔,钟 浩,孙 超,汤利文,许 岗
(湖南福来格生物技术有限公司,湖南 长沙 410100)
氧化还原酶虽然在催化制备手性化学物、药物中间体领域应用广泛,但是此类催化反应需要大量价格昂贵且稳定性差的辅酶NAD(P)H协助才能进行,从而推高了氧化还原酶的应用成本,构建低廉、高效的辅酶再生系统是解决此问题的关键[1-3]。甲酸脱氢酶(FDH)耦联的辅酶再生体系具有诸多优势,如反应不可逆,生成的副产物CO2易从反应体系中释放,甲酸或甲酸盐价格低廉且对酶无抑制作用[4],因此在需要辅酶再生的反应中,甲酸脱氢酶具有重要的产业化应用前景[5]。通过基因工程技术构建高产FDH的重组菌越来越受到青睐[6-7],但是对于NADP+依赖型的甲酸脱氢酶(PFDH)普遍存在表达水平低,蛋白可溶性不好,发酵成本高的问题,不利于后期工业化应用。
笔者以自行构建好的表达PFDH的大肠杆菌为出发菌株,对其产酶培养基和发酵条件进行研究,优化了各工艺参数并逐级放大,在发酵罐上获得高水平的酶活表达,为大规模产业化奠定了基础。
1 材料和方法
1.1 菌 种
大肠杆菌BL21(DE3)/pET30-PFDH由本实验室自行构建和保存。
1.2 培 养 基
种子培养基:10 g/L蛋白胨,5 g/L酵母提取物,10 g/L氯化钠,pH为7.0。
发酵培养基:5 g/L酵母粉,10 g/L蛋白胨,12 g/L磷酸氢二钾,3 g/L磷酸二氢钾,4 g/L硫酸铵,1 g/L七水硫酸镁,1 mL/L微量元素PTM1,10 g/L葡萄糖。
1.3 优化方法
1.3.1 发酵罐控制工艺
活化种子按1%的接种量接种于发酵罐培养基中,初始pH为7.0,培养温度37 ℃,空气流量200 L/h,转速200 r/min,罐压0.015 MPa,溶氧串级转速到800 r/min,提升空气至400 L/h,压力0.04 MPa。氨水控制pH,溶氧反弹补加70%的葡萄糖,使用DO-star补料方式,当OD600达到要求,缓慢降温诱导,比生长速率控制在0.1~0.2直至放罐。
1.3.2 发酵条件对PFDH表达的影响
接种培养后分别研究配方比例,诱导pH,诱导温度,溶氧控制,诱导剂种类、诱导时机、诱导剂浓度以及补料策略对PFDH表达的影响。以优化的条件为基础,采用200 L发酵罐上进行放大培养,验证发酵工艺的稳定性和重现性。
1.4 检测方法
1.4.1 粗酶液抽提
精确移取0.5 mL发酵液于1.5 mL规格的离心管中(离心管中预先加入一定量的玻璃珠,以离心管高度2/3处为宜),在MS3振荡器上振荡20 min(振荡器振荡频率设为1 500 r/min),将样品连同玻璃珠一起倒入烧杯中,离心取清液作为粗酶液。
1.4.2 酶活性测定
在反应体系中依次加入pH为7.5,0.2 mol/L的NH3-NH4Cl缓冲液3.2 mL和1 mol/L的甲酸铵溶液400 μL,再加入粗酶液100 μL,混合均匀后于波长340 nm处校零。加入10 mmol/L的NADP+溶液300 μL,快速混合后开始测定A340吸光值。根据NADPH的摩尔吸光系数计算单位时间浓度变化。PFDH活力定义为在一定反应条件下,单位酶量每分钟生成或消耗1 μmol的NADPH为一个单位,其计算公式为
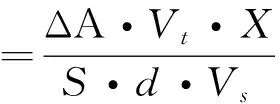
式中:ΔA为每分钟吸光度的变化值,即为斜率;S为NADPH的摩尔消光系数,通过标准曲线求得;d为比色皿的光径;Vt为反应液的总体积,mL;Vs为样品酶液的体积,mL;X为样品酶液的稀释倍数。
2 结果与分析
大肠杆菌菌株构建完成后,外源蛋白的表达量往往达不到工业化生产所要求的水平,因此需要对其发酵工艺进行优化[8]。微生物发酵过程的机理复杂,特别是利用基因工程菌进行高密度发酵,它的生长和外源蛋白的表达水平受到微生物内部代谢调控机制和外界环境(例如培养基组成与配比、发酵温度和pH)等诸多因素的影响[9],本实验室从影响菌株产酶的多个因素进行系统优化和整合。
2.1 培养基m(C)∶m(N)的影响
分批发酵一般使用的培养基为半合成培养基,培养基各组分的浓度和比例要合适,营养物质的比例不当会影响菌体的代谢生长。实验以TB培养基为基础,调整酵母浸粉和蛋白胨比例,设计出3种碳氮比例配方,如图1所示。
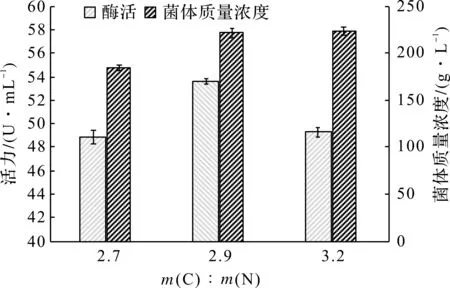
图1 m(C)∶m(N)对菌体生长和PFDH表达的影响Fig.1 Effect of m(C)∶m(N) ratio on cell growth and PFDH production
酶活表现中,m(C)∶m(N)=2.9活力最佳,达到53.6 U/mL。m(C)∶m(N)=3.2增加葡萄糖的摄入,提高菌体的前期生长速度,但活力相应的被抑制。碳氮比需遵循合适的比例才不会抑制大肠的生长和蛋白的表达。如碳源过多,特别是葡萄糖过量或者中间补糖过多,致使糖等物质的氧化不完全,发酵液中有机酸会大量积累。m(C)∶m(N)=2.9是PFDH菌种最合适碳源和氮源的比例,既能满足重组菌的生长需求,又能得到很高的PFDH蛋白表达量。
2.2 诱导pH的优化
pH值是微生物在一定环境条件下代谢活动的综合指标,是发酵过程中重要参数,对微生物的生长和目的产物的积累有很大的影响。发酵前期控制pH为7.0,诱导后pH分别控制为6.5,6.8,7.0,7.2,7.5,培养40 h,结果见图2。最适宜的诱导表达pH为7.2,PFDH发酵活力达到52.7 U/mL。
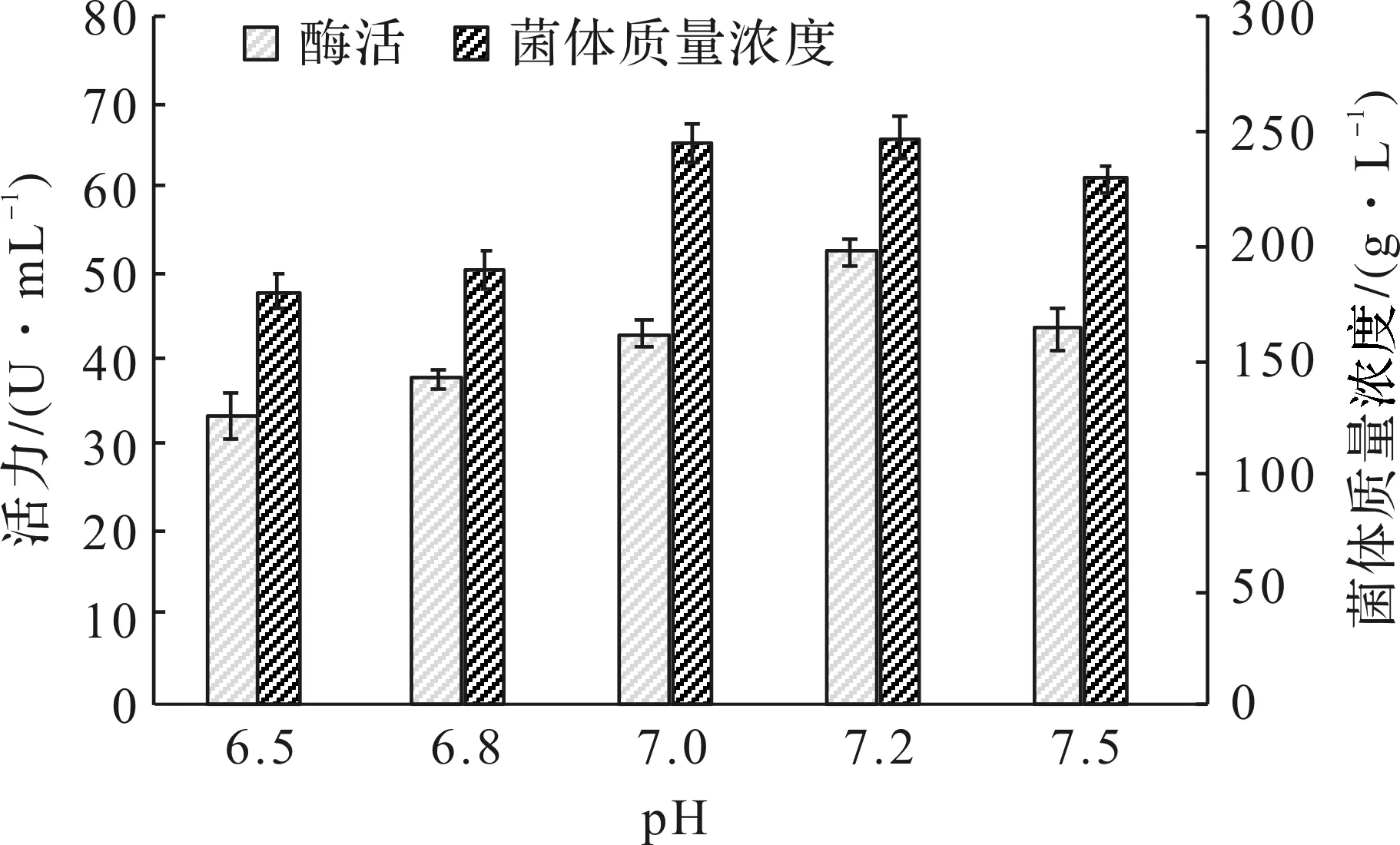
图2 诱导pH对菌体生长和PFDH表达的影响Fig.2 Effect of pH on cell growth and PFDH production
2.3 诱导温度的优化
诱导温度对菌体生长速率、质粒稳定性和产物蛋白的溶解性都有重要影响,是重组蛋白诱导表达过程的关键因素。实验分别选取诱导培养温度23,25,28,32,37 ℃共5个温度梯度,结果见图3。
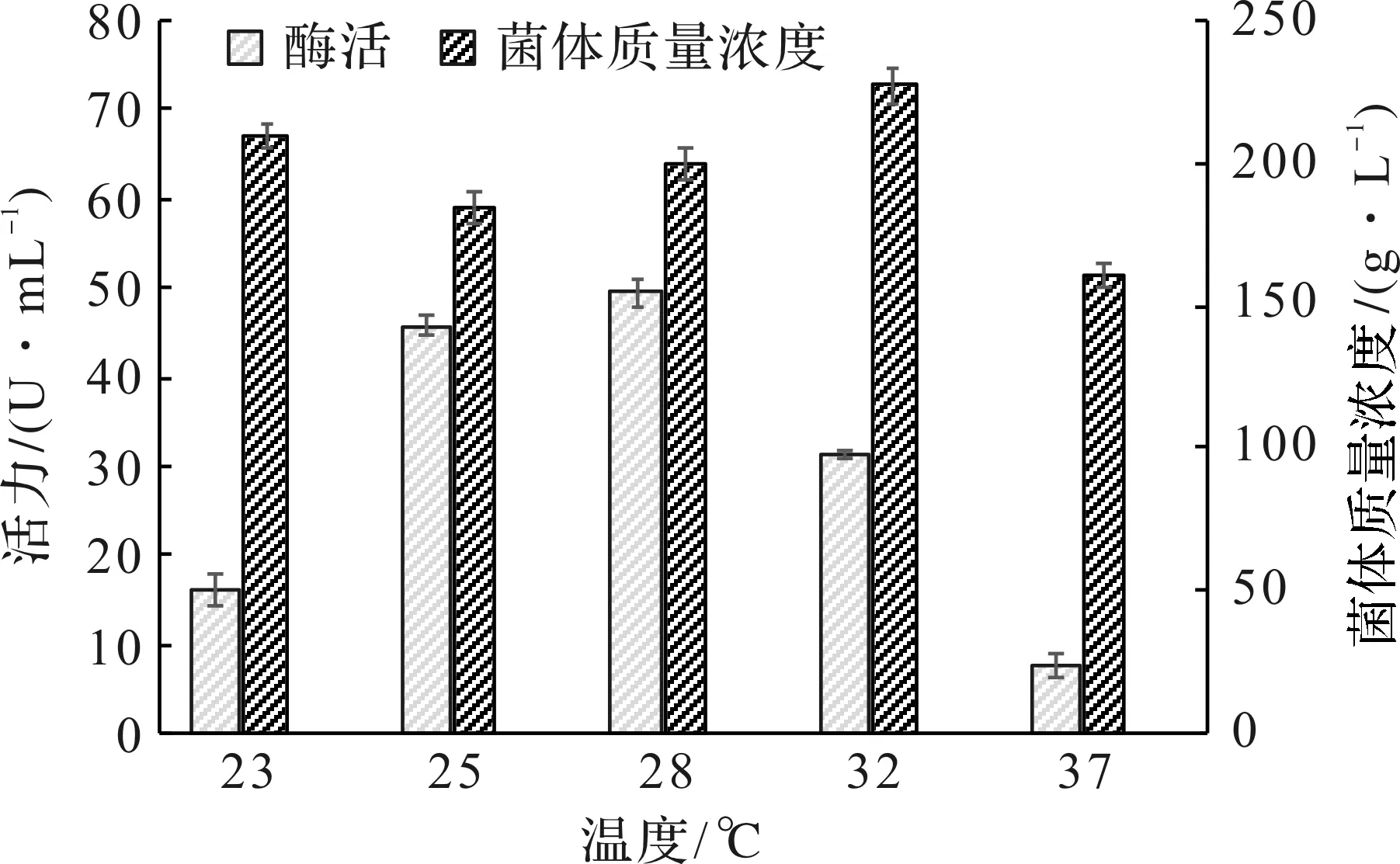
图3 诱导温度对菌体生长和PFDH表达的影响Fig.3 Effect of induced temperature on cell growth and PFDH production
在28 ℃诱导时,放罐的菌体质量浓度达到199.4 g/L,PFDH活力最佳为49.5 U/mL。发酵过程中不降温维持37 ℃诱导,PFDH表达明显被抑制,酶活只有7.6 U/mL。温度太高会造成大肠杆菌菌体的提早衰老,同时较高的温度也会影响到酶蛋白的折叠速度,从而使PFDH表达不佳。
2.4 溶氧控制的优化
溶解氧(DO)是耗氧微生物生长所必需,监控发酵液中的溶氧浓度的变化可以反映细胞的生理生长状况。控制溶氧来调节菌体生长代谢,是提高重组蛋白诱导表达的重要手段。采取DO-star分批补料方式,溶氧反弹后通过调控补料控制DO的范围,分别控制在10%~20%,30%~40%,50%~60%,70%~80%范围。OD600达到30,降温28 ℃加入12 g/L的乳糖,诱导培养40 h,结果见图4。实验发现最适宜的溶氧范围为50%~60%,放罐酶活最高。对于重组PFDH菌,适宜的控制DO范围,对酶蛋白表达的影响很大。溶氧过低,补料葡萄糖添加增多,副产物乙酸代谢增加,影响到大肠菌体自身生长,基本上不表达目的蛋白。
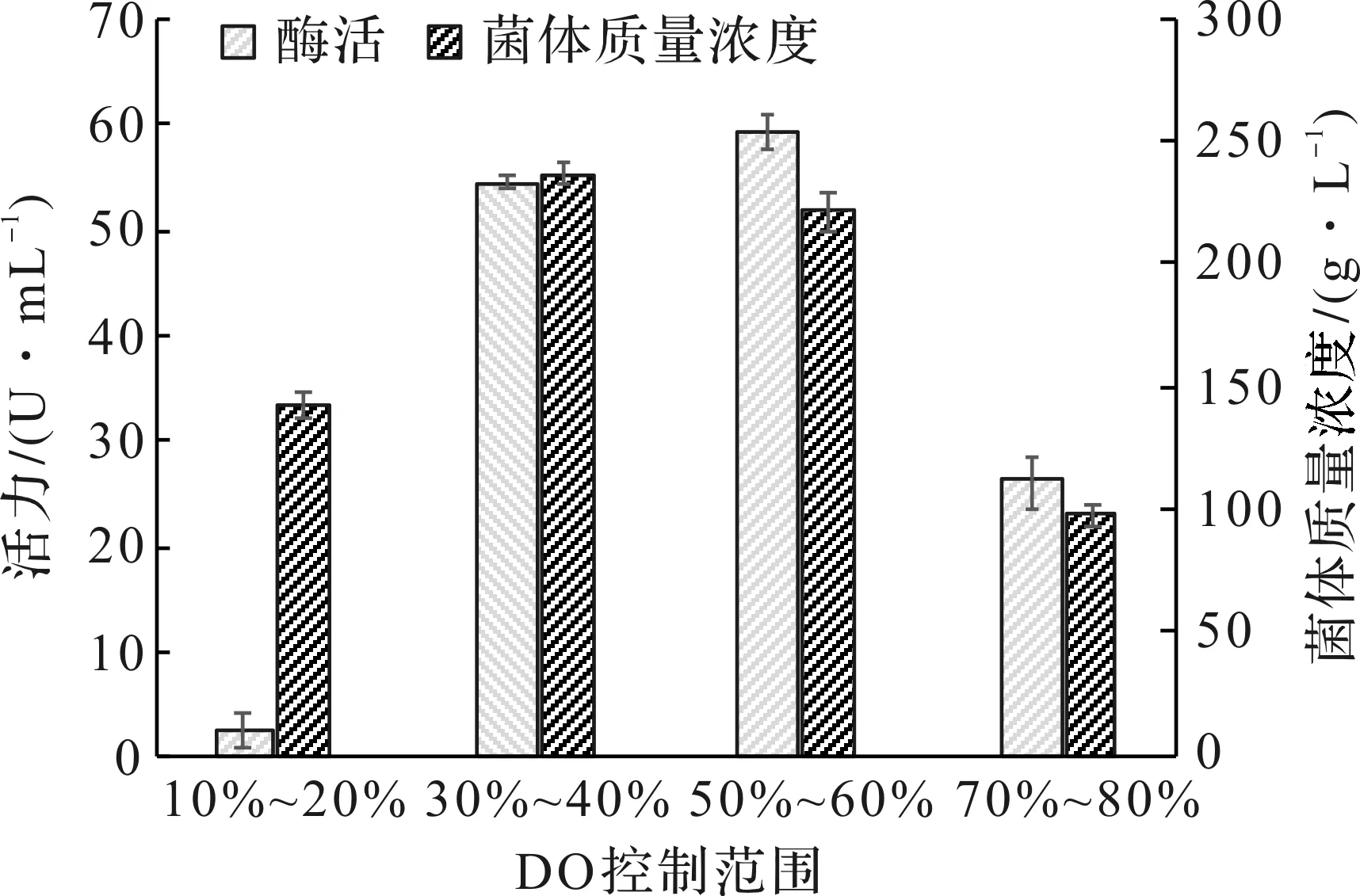
图4 溶氧对菌体生长和PFDH表达的影响Fig.4 Effect of dissolved oxygen on cell growth and PFDH production
2.5 诱导剂种类影响
诱导剂的选择往往会影响到外源蛋白的表达水平。实验分别选用0.3 mmol/L的IPTG,1.2%的半乳糖和1.2%的乳糖进行对比,在分批补料的控制下诱导培养40 h检测酶活,结果见图5。
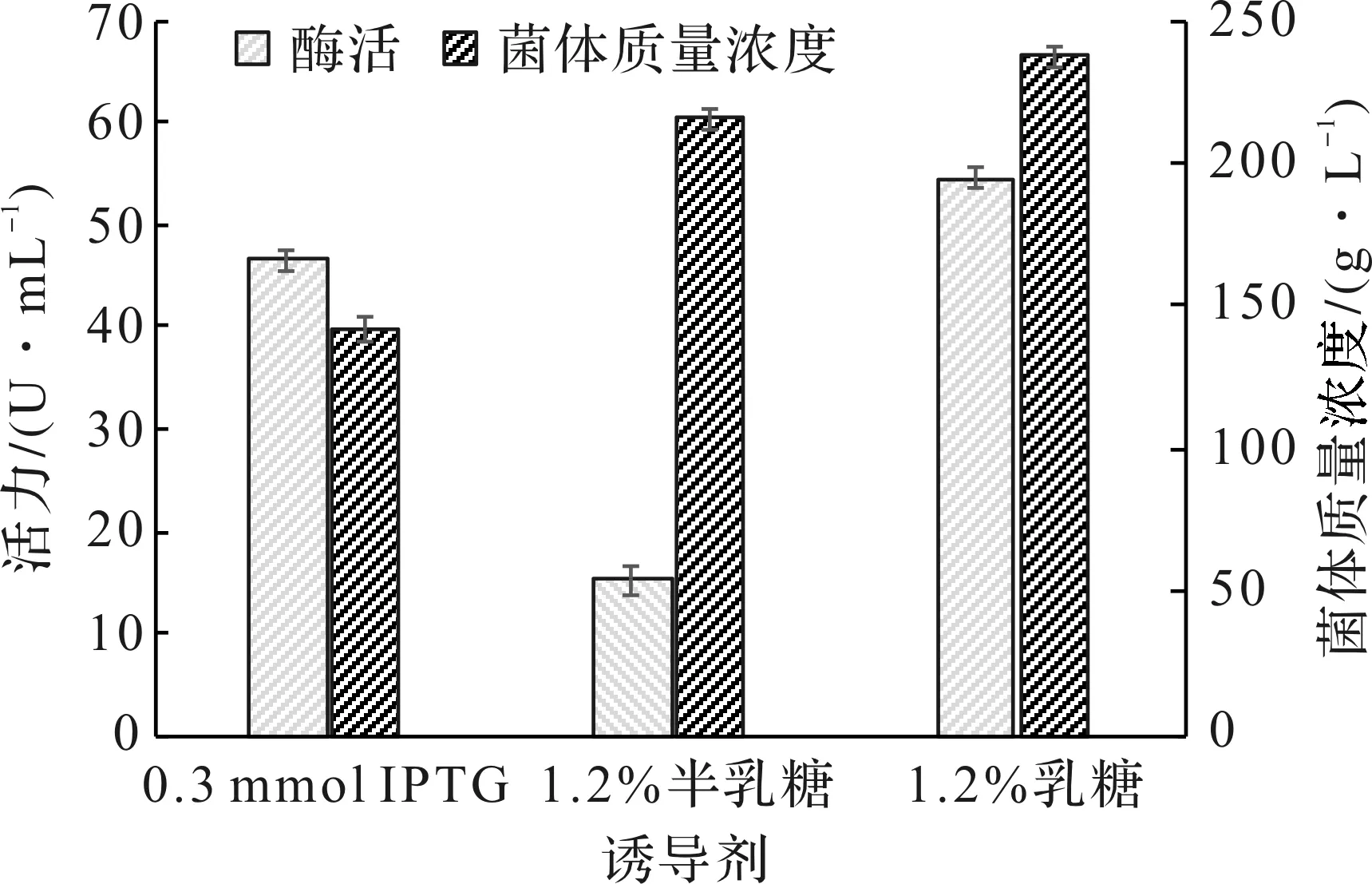
图5 诱导剂种类对菌体生长和PFDH表达的影响Fig.5 Effect of inducer species on cell growth and PFDH production
乳糖诱导活力高达54.5 U/mL,优于IPTG和半乳糖的诱导结果。另外乳糖相较于IPTG和半乳糖,灭菌处理更简单,价格更便宜,更适合工业化应用。
2.6 诱导时机的影响
实验选择OD600分别在20,25,30,35,40加入1.2%乳糖诱导,诱导表达时间均为40 h,PFDH表达结果见图6。结果显示对数生长中前期OD600=30进行诱导可获得最高的产酶量为56.9 U/mL,此时大肠杆菌的菌体生长很快。诱导时机偏晚(OD600=40),将诱导时机延迟至稳定期,会降低重组酶产量,这可能是由于诱导表达前,营养物质已经被大量消耗,相对地降低了用于合成PFDH的基质比例;相反,诱导时机过早(OD600=20),较低的温度会造成前期菌体质量浓度过低而降低重组酶的产量。因此最适宜的诱导时机为OD600=30,此时表达的酶活力最高。
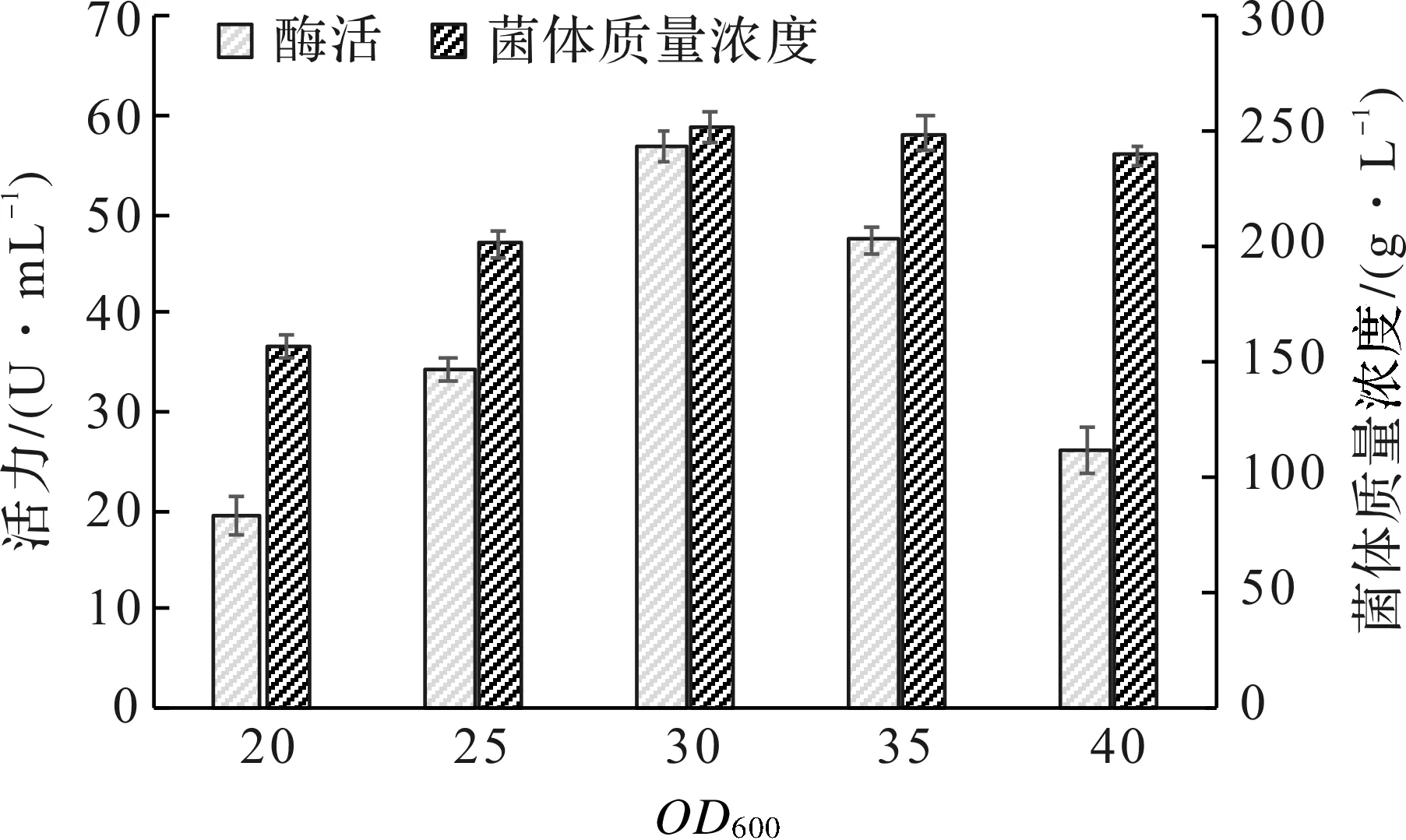
图6 诱导时机对菌体生长和PFDH表达的影响Fig.6 Effect of induction timing on cell growth and PFDH production
2.7 200 L中试发酵罐验证
发酵条件优化完成后需经得起放大验证,不然难以形成工艺推广[10-11]。以前面优化条件为基础,采取200 L发酵罐进行扩大培养,共重复6个批次见图7。
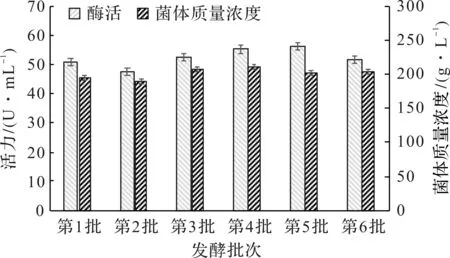
图7 优化工艺的放大和批次验证Fig.7 Results of scale-up and proven experiment under the optimal condition
6批次平行发酵验证,优化工艺下菌体生长和蛋白表达均稳定,结果偏差小,放罐时的平均菌体质量浓度和平均酶活达到201.1 g/L和52.3 U/mL。优化后的高密度发酵条件对提高重组菌中PFDH的表达有很高的重复性,适宜于大规模产业化推广。
3 结 论
甲酸脱氢酶在辅酶再生系统中起着关键的作用,由于其价格昂贵,大大限制了在工业化中的应用。笔者利用5 L发酵罐对重组PFDH大肠杆菌进行系统的高密度发酵优化,先后考察了培养基、培养条件和诱导条件等关键因素,确定了最优发酵工艺:基础培养基m(C)∶m(N)=2.9,DO-star反馈补料,OD600达到30降温至28 ℃,1.2%乳糖诱导,PFDH酶活力可以达到56.9 U/mL,相对于优化前的38.5 U/mL,提高了47.8%。在此基础上利用200 L罐进行多批次扩大培养,证实该高密度发酵工艺重复性好,具有较高的工业化应用价值。
