慢病毒载体介导的Nrf2表达下调对肝星状细胞生物学行为的影响
2020-07-14蔡陈效鉏莉王晓晗
蔡陈效 鉏莉 王晓晗


[摘要] 目的 觀察重组慢病毒载体介导Nrf2表达下调对肝星状细胞生物学行为的影响,同时探讨其可能的作用机制。 方法 利用重组DNA技术将特异性shRNA序列插入慢病毒表达载体pGLV3.GFP中,形成pGLV3.GFP.Nrf2.shRNA,将其转染至293T细胞中,随后进行病毒包装、滴度测定、转染率计算。采用实时荧光定量、Western blot测定转染肝星状细胞株(HSC-T6细胞)Nrt2 mRNA及蛋白的表达情况,利用Tunel染色法检测HSC-T6细胞的凋亡情况,同时对HSC-T6细胞中PI3K、Akt、p-Akt、p-Bad、Bcl-2、Bax蛋白水平进行测定。 结果 构建的重组病毒载体 LV3-H1-GFP-shRNA可有效感染293T细胞。激光共聚焦显示空白组细胞凋亡率低于A组和B组,与A组比较,B组的细胞凋亡率降低(P<0.05)。实时荧光定量PCR法结果显示空白组Nrf2 mRNA水平高于A组和B组(P<0.05),与A组比较,B组mRNA水平升高(P<0.05)。Western blot法显示空白组Nrf2蛋白水平高于A组和B组(P<0.05),与A组比较,B组蛋白水平升高(P<0.05)。与空白组相比,A组和B组PI3K、p-Akt、p-bad、Bcl-2的蛋白表达量增加(P<0.05),Bax蛋白减少(P<0.05),其中A组PI3K、p-Akt、p-Bad、Bcl-2的蛋白水平较B组增加(P<0.05),Bax蛋白水平低于B组(P<0.05)。 结论 Nrf2基因的shRNA慢病毒载体pGLV3.GFP.Nrf2.shRNA在体外可抑制肝星状细胞活化,其作用机制可能与通过抑制PI3K-Akt通路促肝星状细胞凋亡有关。
[关键词] 慢病毒载体;HSC-T6细胞;Nrf2;PI3K-Akt通路;凋亡
[中图分类号] R575.5 [文献标识码] A [文章编号] 1673-9701(2020)13-0015-04
[Abstract] Objective To observe the influence of down-regulated expression of Nrf2 mediated by recombinant lentiviral vectors on biological behaviors of hepatic stellate cells, and to explore the likely mechanism. Methods The specific shRNA sequence was inserted into the lentiviral vector pGLV3.GFP by the recombinant DNA technique to form pGLV3.GFP.Nrf2.shRNA, which was transfected to 293T cells. Then, virus packaging, titre determination and calculation of transfection efficiency were performed. The expression of Nrt2 mRNA and protein in transfected hepatic stellate cells(HSC-T6 cells) was determined by real time quantitative PCR and Western blot, the apoptosis of HSC-T6 cells was detected by the Tunel staining method, and the protein levels of PI3K, Akt, p-Akt, p-Bad, Bcl-2 and Bax in HSC-T6 cells were determined at the same time. Results The constructed recombinant virus vector LV3-H1-GFP-shRNA Can effectively infect 293T cells. It was found by laser confocal scanning that the apoptosis rate was lower in the blank group than in group A and group B, and the apoptosis rate was lower in group B than in group A(P<0.05). It was found by real time quantitative PCR that the Nrf2 mRNA level was higher in the blank group than in group A and group B(P<0.05), and the Nrf2 mRNA level was higher in group B than in group A(P<0.05). It was found by Western blot that the Nrf2 protein level was higher in the blank group than in group A and group B(P<0.05), and the Nrf2 protein level was higher in group B than in group A(P<0.05). The protein levels of PI3K, p-Akt, p-Bad, and Bcl-2 were lower in the blank group than in group A and group B(P<0.05), and the protein level of Bax was higher in the blank group than in group A and group B(P<0.05). The protein expression of PI3K, p-Akt, p-Bad, and Bcl-2 were higher in group A than in group B(P<0.05), and the protein expression of Bax was lower in group A than in group B(P<0.05). Conclusion The shRNA lentiviral vector pGLV3.GFP.Nrf2.shRNA of Nrf2 gene can inhibit the activation of hepatic stellate cells in vitro, and its mechanism may be related with promoting apoptosis of hepatic stellate cells by inhibiting the PI3K-Akt pathway.
[Key words] Lentiviral vector; HSC-T6 cell; Nrf2; PI3K-AKT pathway; Apoptosis
细胞外基质的过度沉积导致肝纤维化的出现,有研究[1,2]显示肝星状细胞(Hepatic stellatecells,HSCs)的激活是导致肝纤维化的重要环节,任何因素导致HSCs的生物行为学改变均可导致肝纤维化的发生发展。因此可以推测,各种干预措施(药物、各种刺激等)如果能够抑制HSCs的生物行为及功能,就可在一定程度上减轻甚至逆转肝纤维化。有研究[3]显示抑制转录因子NF-E2相关因子2(Nrf2)的表达可抑制HSC活化,从而减轻肝纤维化程度,但其是通过何种途径实现目前尚不可知。基于上述背景及研究基础,本实验构建针对大鼠Nrf2基因的慢病毒载体,进一步研究Nrf2影响HSCs的生物行为的可能机制,现报道如下。
1 材料与方法
1.1 试剂及仪器
DMEM培养基、胰蛋白酶及优质胎牛血清(Gibco公司);人肝星状细胞HSC-T6(中南大学湘雅医院细胞中心),Liprofectamine2000(美国Invitrogen公司),Annexin-FITC/PI细胞检测试剂盒(Invitrogen公司),PVDF膜(美国Millipore公司),二甲基亚砜(DMSO)(厦门鹭隆生物科技发展有限公司),细胞恒温培养箱(上海龙跃仪器设备有限公司),流式细胞仪(美国BD公司),倒置相差荧光显微镜(美国OLYMPUS公司),酶标自动分析仪(美国BIO-BAD公司)。
1.2 细胞培养方法
将HSC-T6复苏后常规置于DMEM高糖培养基中(10% 胎牛血清+1%卡那霉素和新霉素)培养,培养环境模拟细胞生物体内环境,条件如下:稳定的温度(37°C)、稳定的CO2水平(5%)、恒定的酸碱度(pH值:7.2~7.4)、较高的相对饱和湿度(95%),2 d换液1次,待细胞生长至80%左右,用胰酶消化,传代培养。将状态良好的目的细胞以5×104/mL密度接种于24孔板中,接种细胞数量因细胞生长速度略有不同,一般是保证次日进行病毒感染时细胞的汇合率在80%~90%。
1.3 慢病毒载体构建
此过程由中国丰晖生物技术有限公司完成,参照GenBank将大鼠Nfe2l2基因(NM 031789.2)的cDNA作为目标模板,遵循化学合成siRNA设计原则,选择RNAi靶序列,在完成Blast基因组同源性分析后合成相应的shRNA表达质粒,随后对慢病毒载体进行测序鉴定证明载体构建成功,随之进行慢病毒载体包装及测定滴度。
1.4 重组病毒感染靶细胞
将293T细胞置于培养瓶中培养至细胞的汇合率在80%~90%时摒弃细胞原有的培养基,随后加入2 mL灭菌的D-Hanks溶液洗涤细胞生长面,然后弃去该溶液,加入1 mL胰酶消化液,充分混匀后将混合液置于37℃消化约3~5 min,加入2 mL含10%FBS的DMEM培养液,用刻度吸管吹打数次后形成单细胞悬液,随后将细胞稀释至密度为3×105/mL后接种于96孔板中,充分混匀后在模拟细胞生物体内环境下(37℃、5%CO2、饱和湿度)培养24 h,仔细吸取96孔板中旧的培养基,每孔加入重组慢病毒(A组)和空载病毒(B组)5×107TU,设立未添加病毒的空白细胞对照组,每孔中加入终浓度为5 μg/mL的Polybrene,将细胞置于37℃、5%CO2、饱和湿度中转染12 h,PBS冲洗换液,加入150 μL 10%FBS的DMEM培养液,37℃、5%CO2、饱和湿度环境中继续培养48 h。利用荧光显微镜观察各组细胞的Nrf2表达水平变化及转染率的差异。
1.5 实时荧光定量PCR检测靶细胞中Nrf2 mRNA的表达
将细胞加入Trizol 提取液提取细胞总RNA,用TaKaRa逆转录酶进行逆转录合成cDNA。根据NCBI中Genebank基因库的设计引物序列得出:Mfn2的上游引物序列为5'-GATGACAGAG-GAAGTGGAAAGGC-3',下游引物序列为5'-ACAGACACAGGAAGA-AGGGGCT-3';反应体系為 20 μL,逆转录过程 :95℃(3 min)→95℃变性(20 s)→55℃退火(30 s)→72℃延伸(3 min),30个循环。Real-Time PCR操作方法按照试剂盒说明书,使用GAPDH作为内部参照,将GAPDH的拷贝数作为校正基数,GAPDH的上游引物序列为5'-ACAGCAACAGGGTGGTGGAC-3',下游引物序列为5'-TTTGAG-GGTGCAGCGAACTT-3'。通过ABI7500软件获得检测指标Ct(cycle threshold)值,与同样本中GAPDH的Ct值相减,即获得该样本中相应指标的ΔCt值。以空白组ΔCt值作为校正,软件根据2-ΔΔCt数值计算得出检测指标基因浓度水平。
1.6 Western blot检测靶细胞中Nrf2、PI3K、Akt、p-Akt、p-Bad、Bcl-2、Bax蛋白的表达
提取细胞总蛋白,BCA法测蛋白浓度,用凝胶加样缓冲液将各管蛋白浓度调为一致(2 mg/mL),取20 μL样品煮沸5 min。电泳(5%浓缩胶,12%分离胶,60 V,40 mA,2.5 h)结束后将凝胶取出,进行转膜,遵循胶在负极,膜在正极的原则,100 V,250 mA,时间依据各指标分子量大小而定,将硝酸纤维素膜取出,用丽春红对固定于硝酸纤维素滤膜上的蛋白质进行预染,看电泳带是否清晰,证实蛋白质确实转移到膜上。5%脱脂奶粉封闭2 h,TBST洗3次,每次5 min,分别加入抗Nrf2、PI3K、Akt、p-Akt、p-Bad、Bcl-2、Bax及β-actin一抗抗体孵育,4℃过夜TBST洗2次,每次5 min,加入辣根过氧化物酶标记与一抗相抗的二抗IgG(1:2000)室温50 min,TBST洗3次,每次5 min。将滤膜放人配好的显色液中反应1 min,计算机扫描图像,并由生物图像分析系统(Bio-Rad公司,Model Gel Doc 2000,美国)分析处理。
1.7 Tunel染色
采用Tunel试剂盒对各组生长处于对数的HSC-T6细胞凋亡情况进行检测,经DAPI染色后细胞核及凋亡神经元细胞分别呈现蓝色荧光及绿色荧光,采用激光共聚焦荧光显微镜进行观察,每个脑片随机选取5个视野,采用Image.ProPlus图像分析处理系统软件进行凋亡细胞数的计算。凋亡细胞率=(绿色荧光的凋亡细胞数/DAPI染色的总细胞数)×100%。
1.8 统计学方法
应用SPSS20.0统计学软件对结果进行处理,计量资料以均数±标准差(x±s)表示,计量资料两组比较采用t检验,多组间比较采用One-Way ANOVA单因素方差分析,Western Blott及Tunel染色图片利用oringe软件及Image J软件进行作图及图片处理,P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒感染靶细胞情况及转染效率评估
结果显示利用慢病毒载体成功感染了293T细胞,利用荧光显微镜观察各组293T细胞,结果证实构建的重组病毒载体LV3-H1-GFP-shRNA可有效感染293T细胞。经预实验,筛选出最适MOI为10,转染效率达75%。见封三图1。
2.2 各组HSC-T6细胞中Nrf2 mRNA的表达变化
利用实时荧光定量PCR法对HSC-T6细胞中Nrf2 mRNA表达进行测定,将空白组细胞的Nrf2 mRNA设置为1,结果显示LV3-H1-GFP-shRNA后A组细胞Nrf2 mRNA相对水平为(0.28±0.06),B组Nrf2 mRNA相对水平为(0.59±0.17),差异有统计学意义(t=4.39,P=0.01<0.05)。
2.3 各组HSC-T6细胞中Nrf2蛋白的表达变化
利用Western blot法对HSC-T6细胞中Nrf2蛋白表达进行测定,结果显示LV3-H1-GFP-shRNA后细胞Nrf2蛋白下降,A组Nrf2/β-actin比值为(0.32±0.01),B组Nrf2/β-actin比值为(0.71±0.02),空白组Nrf2/β-actin比值为(1.15±0.04),差异有统计学意义(t=4.32,P=0.01<0.05)。见图1、2。
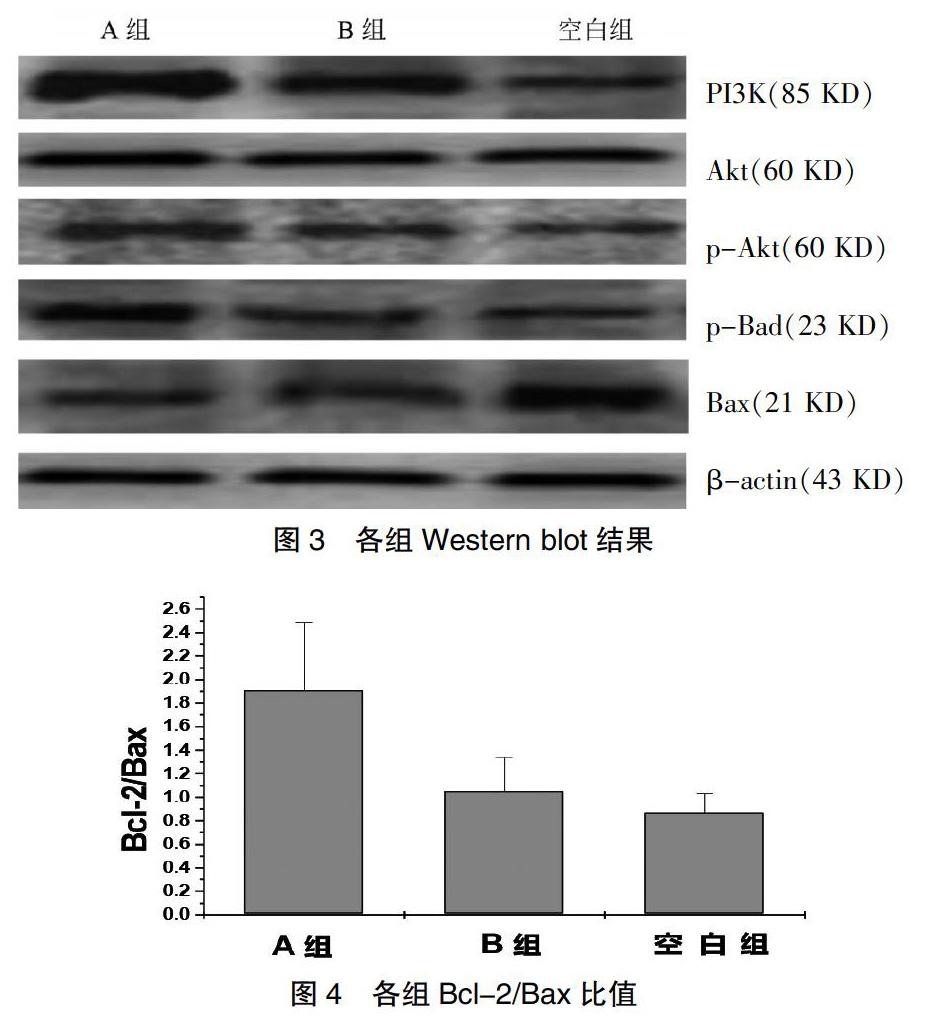
2.4 各组HSC-T6细胞中PI3K、Akt、p-Akt、p-Bad、Bcl-2、Bax表达情况
采用Western blot对各组HSC-T6细胞中PI3K、Akt、p-Akt、p-Bad、Bcl-2、Bax蛋白水平进行测定。与其他两组相比,A组PI3K、p-Akt、p-Bad、Bcl-2的蛋白表达量增加,Bax蛋白减少,差异有统计学意义(P<0.05)。见图3、4及表1。
2.5 各组HSC-T6细胞凋亡情况
经过激光共聚焦观察可知,空白组几乎未见绿色荧光,细胞凋亡率为(0.51±0.14)%,慢性病毒载体转染的细胞被绿色荧光标记的细胞均较空白组多,A组细胞凋亡率为(2.15±0.17)%,B组细胞凋亡率为(1.63±0.31)%,三组差异有统计学意义(F=6.41,P=0.00<0.05),A组绿色荧光标记的细胞数目较B组多。见封三图2。
3 讨论
细胞脂滴在肝脏受到内源性或外源性刺激时消失,处于静态的HSCs可转变为肌成纤维样细胞,这一过程亦称之为“活化”[4],HSCs生物学行为表现是影响肝纤维化进程的核心环节[5],如若治疗不及时或不恰当,肝纤维化则可进一步发展成肝硬化甚至肝癌[6]。近年来不少研究[7-9]证实肝纤维化程度的减弱与HSC活化程度减少有关,而HSCs表型的转化并非HSCs活化的关键,凋亡才是影响HSCs活化的中心环节。HSCs凋亡不破坏HSCs细胞器的结构完整性,亦不会影响HSCs微环境,仅削减HSCs的活化细胞数量。Nrf2是CNC 转率因子家族的重要因子之一,大量分布于组织器官中,对其发挥保护效应[10]。当机体接受氧化应激信号时,Nrf2会产生核移位进入细胞核内结合ARE,随之激活其下游的大量活性因子,從而调节细胞的氧化还原状态,实现抵御氧化应激损伤。有数据[11-13]显示,当肝星状细胞处于氧化应激环境中时可被活化,而Nrf2是肝星状细胞中与氧化应激反应调节密切相关的中枢调节因子[14],Nrf2与抗氧化反应元件相互作用后调节细胞介导细胞氧化平衡及对凋亡信号的敏感度[15,16],Nrf2的减少或缺失可导致肝星状细胞功能障碍,减少活化状态,加速凋亡,从而改善肝脏纤维化程度[17]。本研究成功构建针对大鼠Nrf2基因有效的shRNA慢病毒载体,通过荧光显微镜证实重组病毒有效感染了靶细胞,并经过PCR和Western blot检测证实了慢病毒载体有效抑制了Nrf2的基因和蛋白的表达,与此同时利用Tunel染色发现随着Nrf2表达水平的下降,肝星状细胞的凋亡明显增加,进一步证实了抑制Nrf2的表达可抑制HSC的活化。
PI3K/Akt信号通路是与细胞凋亡关系密切的膜受体信号转导[18],PI3K依赖性的Akt激活可以使促进细胞凋亡的蛋白Bax(BCL-2-associated X protein)的Ser136位点磷酸化而失活,从而诱发细胞产生凋亡,与此同时对Bcl-2的抗凋亡效应亦产生了抑制作用[19]。此外,被活化的Akt亦可直接作用于线粒体的细胞色素C及凋亡诱导因子,抑制其分泌,从而实现抑制细胞凋亡的目的[20]。Akt磷酸化后使得其下游关键蛋白分子Bad磷酸化,Bad蛋白与伴侣蛋白结合,从而使Bcl-2蛋白表达量上升,而Bax的蛋白表达量下降,从而达到抑制细胞凋亡的作用[21]。本研究通过Western blot显示转染慢病毒过表达载体pGLV3.GFP.Nrf2.shRNA可导致PI3K、p-Akt、p-Bad、Bcl-2的蛋白表达量减少,Bax蛋白及凋亡率增加,说明慢病毒介导的RNAi能有效抑制靶细胞中Nrf2基因和蛋白表达的同时可促进肝星状细胞的凋亡,抑制其活化,减少肝纤维化程度。
[参考文献]
[1] 黄珍,王小花,刘海峰. 肝纤维化治疗的研究进展[J]. 牡丹江医学院学报,2019,40(4):98-100.
[2] 严何. 肝纖维化的机制及研究进展[J]. 基层医学论坛,2019,23(16):2357-2358.
[3] 刘学,刘骅漫,张伟. 核转录因子Nrf2与肺纤维化相关研究进展[J]. 湖南中医杂志,2018,34(4):160-164.
[4] Jiang Rui,Zhou Yujia,Wang Sufan,et al. Nicotinamide riboside protects against liver fibrosis induced by CCl4via regulating the acetylation of Smads signaling pathway[J]. Life Sciences,2019.
[5] He Shuying,Tang Jing,Diao Na,et al. Parathyroid hormone-related protein activates HSCs via hedgehog signalling during liver fibrosis development[J]. Artificial cells,Nanomedicine,and Biotechnology,2019,47(1):1984-1994.
[6] 胡潇,胡光荣,刘思达,等. 肝纤维化治疗进展[J]. 肝脏,2018,23(10):931-933.
[7] Huang Y,Deng X,Liang J,et al. Modulation of hepatic stellate cells and reversibility of hepatic fibrosis[J]. ExpCell Res,2017,352(2):420-426.
[8] 刘幸,田甜,余蕾,等. 辛二酰苯胺异羟肟酸诱导大鼠原代肝星状细胞凋亡[J]. 中国病理生理杂志,2017,33(5):913-918.
[9] 薛谦. 肝星状细胞中Hic-5对肝细胞性肝癌生物学行为影响的研究[D]. 泸州:西南医科大学,2018.
[10] 侯磊,赵永丽,何莉,等. Nrf2表达与顺铂诱导食管癌细胞凋亡关系的实验研究[J]. 临床肿瘤学杂志,2018, 23(2):106-110.
[11] 张孝盈,宓余强. 肝纤维化影响因素的研究进展[J]. 医学综述,2018,24(6):1062-1066.
[12] 张忠佩,秦元华,任一鑫,等. 氧化应激反应对肝纤维化形成研究的进展[J]. 中国病原生物学杂志,2017,12(11):1130-1133.
[13] 李涛,牛丽娟,刘文宣,等. 沉默KLF4表达对人肝星状细胞HSC-LX2生物学行为的影响[J]. 河北医药,2017, 39(7):981-984.
[14] 李桃,王汉东,丁宇,等. Nrf2基因敲除对小鼠蛛网膜下腔出血后小胶质细胞/巨噬细胞活化的影响[J]. 医学研究生学报,2015,28(1):11-15.
[15] 李菁华,刘震雄,赵曙光,等. 靶向Nrf2基因shRNA慢病毒载体的构建及其对肝星状细胞Nrf2基因表达的沉默[J]. 山西医科大学学报,2014,45(12):1119-1123, 1231.
[16] 贺国娜. 肝纤维化形成过程中肝组织Nrf2、NOX4mRNA及血清ROS的变化[D]. 太原:山西医科大学,2019.
[17] 孙静. 转录因子Nrf2在小鼠酒精暴露引发的肝脏及胰腺损伤中的作用及其机制研究[D].沈阳:中国医科大学,2018.
[18] 方惠娴,王剑锋,朱向东. 中医药干预PI3K/AKT信号通路抗肝纤维的研究进展[J]. 中医临床研究,2018,10(8):146-148.
[19] 杨洋. 复方半枝莲颗粒对肝纤维化中MAPK/ERK-PI3K/Akt信号转导通路的影响[D].南宁:广西中医药大学,2016.
[20] 罗晓旭. PI3K/Akt信号通路与肝星状细胞活化的关系及其在放射性肝纤维化中的作用[D]. 乌鲁木齐:新疆医科大学,2016.
[21] 吴长会,沈敏,李龙,等. PI3K/Akt/mTOR/p70~(S6K)信号通路在肝纤维化发生发展中的作用[J]. 临床肝胆病杂志,2015,31(11):1928-1932.
[21] 张可星,张学荣,侯瑞雪,等. 眼镜蛇毒NGF通过PI3K/AKT信号通路对肝星状细胞的影响[J]. 基因组学与应用生物学,2016,35(5):1031-1035.
(收稿日期:2019-09-26)
