基于GEO数据库分析RACK1在糖尿病肾小管病中的表达
2020-07-14孔冉冉解立怡余晓洋
冯 婕,孔冉冉,解立怡,余晓洋,刘 超
(1西安交通大学第一附属医院肾内科,西安 710061;2西安交通大学医学院第二附属医院胸外科;*通讯作者,E-mail:619386343@qq.com)
糖尿病肾病是糖尿病严重的并发症之一,是导致终末期肾衰竭的首要原因,但其发病机制目前仍不清楚。近年来许多新的证据提示糖尿病肾小管病是糖尿病肾病的启动者,参与糖尿病肾病的发生发展[1,2]。RACK1(GNB2L1)是WD40重复蛋白家族中一员,被报道参与数种疾病的进展,其在糖尿病肾小管病中的作用却少有人研究。本文拟以GEO(Gene Expression Omnibus)数据库为基础,探讨活化的蛋白激酶C受体1(receptor for activated C kinase 1,RACK1)在糖尿病肾小管病中的表达及可能的作用机制。
1 材料与方法
1.1 基于GEO数据库分析糖尿病肾病肾小管中RACK1的表达水平
在GEO(https://www.ncbi.nlm.nih.gov/geo/)数据库中搜索糖尿病肾病,得到数据系列(GSE30528),该数据来自于人类的糖尿病肾病和正常的肾脏组织(手术切除肾脏后,取正常肾组织),利用纤维微切割技术获取肾小管,基于Affymetrix Human Genome U133A 2.0 Array,得到基因表达数据。在此数据系列中,分析RACK1在糖尿病肾小管及正常对照组的肾小管中的表达情况。
1.2 KEGG中搜索RACK1参与的信号通路
从KEGG(http://www.genome.jp/kegg)中寻找RACK1参与的可能通路,以及与糖尿病肾小管病的可能关系。
1.3 细胞培养、处理和靶基因的测定
HK-2购自于美国American Type Cell Collection(ATCC,Manassas,VA)。HK-2细胞被置于加有5%胎牛血清、100 U/ml青霉素、100 mg/ml链霉素的低糖DMEM培养基中,其中糖浓度为5.5 mmol/L,放置在含有5% CO2的培养箱中培养,将其分为对照组、甘露醇组及高糖组。HK-2细胞被接种于6孔板中,24 h后约70%融合,用无血清的培养基培养24 h,无刺激HK-2细胞作为对照组,甘露醇组加入甘露醇30 mmol/L,高糖组加入D-glucose 30 mmol/L,共刺激48 h。
Trizol提取HK-2细胞总的RNA。SuperScript Ⅱ反转录试剂盒将总RNA反转录为cDNA。再利用ABI-Prism 7500行实时定量PCR检测。人的RACK1下游通路相关基因引物见表1。循环条件如下:预变性95 ℃ 15 min,59 ℃ 30 min,35个循环,延伸温度72 ℃ 10 min。β-actin为内参,2-ΔΔCt方法计算相关基因的表达。
表1 qRT-PCR的引物序列
Table 1 The primer sequences of qRT-PCR

基因上游引物(5′-3′) 下游引物(5′-3′) RACK1TTC TCC TCT GAC AAC CGG CAGCC ATC CTT GCC TCC AGA ASTAT1CAC AAG GTG GCA GGA TGT CTTCC CCG ACT GAG CCT GAT TASTAT3CTG CCC CAT ACC TGA AGA CCTCC TCA CAT GGG GGA GGT AGβ-actinGGC AAA TTC AAC GGC ACA GTCGCT GAC AAT CTT GAG TGA GTT
1.4 糖尿病肾病动物模型构建、相关指标测定和组织学变化
1.4.1 实验动物及药品 SPF级雄性FVB/N小鼠12只,8周龄,25-30 g购自上海斯莱克实验动物有限公司,饲养于西安交通大学医学院动物中心。链脲佐菌素(streptozotocin,STZ),购自于美国Sigma公司。
1.4.2 糖尿病动物模型的建立 12只雄性FVB/N随机分为2组:糖尿病肾病组和对照组,每组6只,称重,测基础血糖。糖尿病肾病组小鼠禁食4-6 h后,给予0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH 4.5)+STZ(50 mg/kg),腹腔注射,连续5 d;对照组给予同等剂量柠檬酸-柠檬酸钠缓冲液。2周后取尾静脉血测血糖,血糖>16.67 mmol/L,糖尿病造模成功。
1.4.3 标本收集 每2周测体质量、血糖,留取尿液,ELSIA法测尿白蛋白/肌酐比(ACR)。12周后将老鼠放入代谢笼,收集24 h尿液测24 h尿蛋白定量。而后处死小鼠,一侧肾脏-80 ℃冻存备用,切取部分组织提取RNA,行实时定量PCR;一侧肾脏4%多聚甲醛固定,其中一半石蜡包埋,连续切片,行PAS染色,一半OCT包埋,-80 ℃保存,行免疫荧光染色。兔抗phospho-STAT1(p-STAT1)和兔抗phospho-STAT3(p-STAT3)购买于Cell Signaling公司;羊抗兔荧光二抗Alexa FluorTM488购买于Invitrogen公司;DAPI购买于Invitrogen公司。
1.4.4 肾组织RNA的提取及测定 Trizol提取肾组织块中的总RNA SuperScript Ⅱ反转录试剂盒将总RNA反转录为cDNA。再利用ABI-Prism 7500行实时定量PCR检测。鼠的相关基因引物见表2。循环条件如下:预变性95 ℃ 15 min,59 ℃ 30 min,35个循环,延伸72 ℃ 10 min。GAPDH为内参,2-ΔΔCt方法计算相关基因的表达。
表2 qRT-PCR的引物序列
Table 2 The primer sequences of qRT-PCR
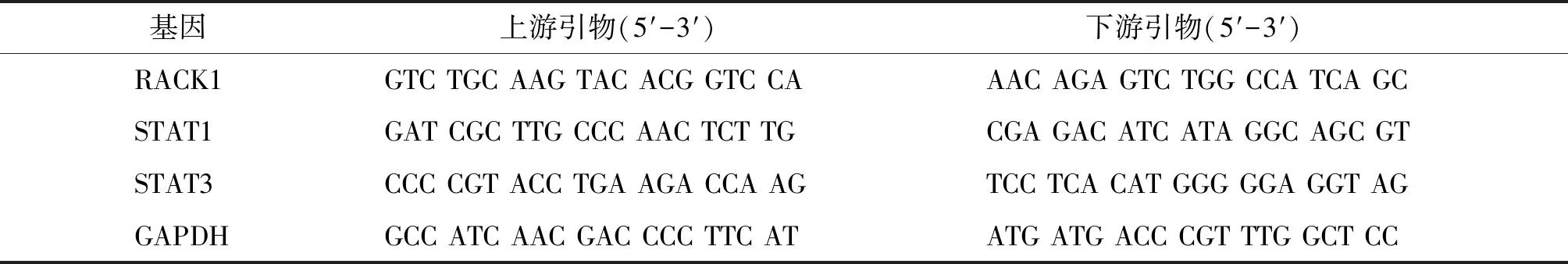
基因上游引物(5′-3′) 下游引物(5′-3′) RACK1GTC TGC AAG TAC ACG GTC CAAAC AGA GTC TGG CCA TCA GCSTAT1GAT CGC TTG CCC AAC TCT TGCGA GAC ATC ATA GGC AGC GTSTAT3CCC CGT ACC TGA AGA CCA AGTCC TCA CAT GGG GGA GGT AGGAPDHGCC ATC AAC GAC CCC TTC ATATG ATG ACC CGT TTG GCT CC
1.5 统计学方法
2 结果
2.1 基于GEO数据库糖尿病肾病中RACK1(GNB2L1)的表达
GEO数据分析示与对照组比较,糖尿病肾病组肾小管中RACK1(GNB2L1)表达明显上调,差异有统计学意义(P<0.05,见图1)。
2.2 RACK1参与的信号通路
利用KEGG,搜索RACK1参与的信号通路,可见其通过磷酸化STAT1,激活Jak-STAT通路,进一步作用于DNA,引起损伤(见图2)。
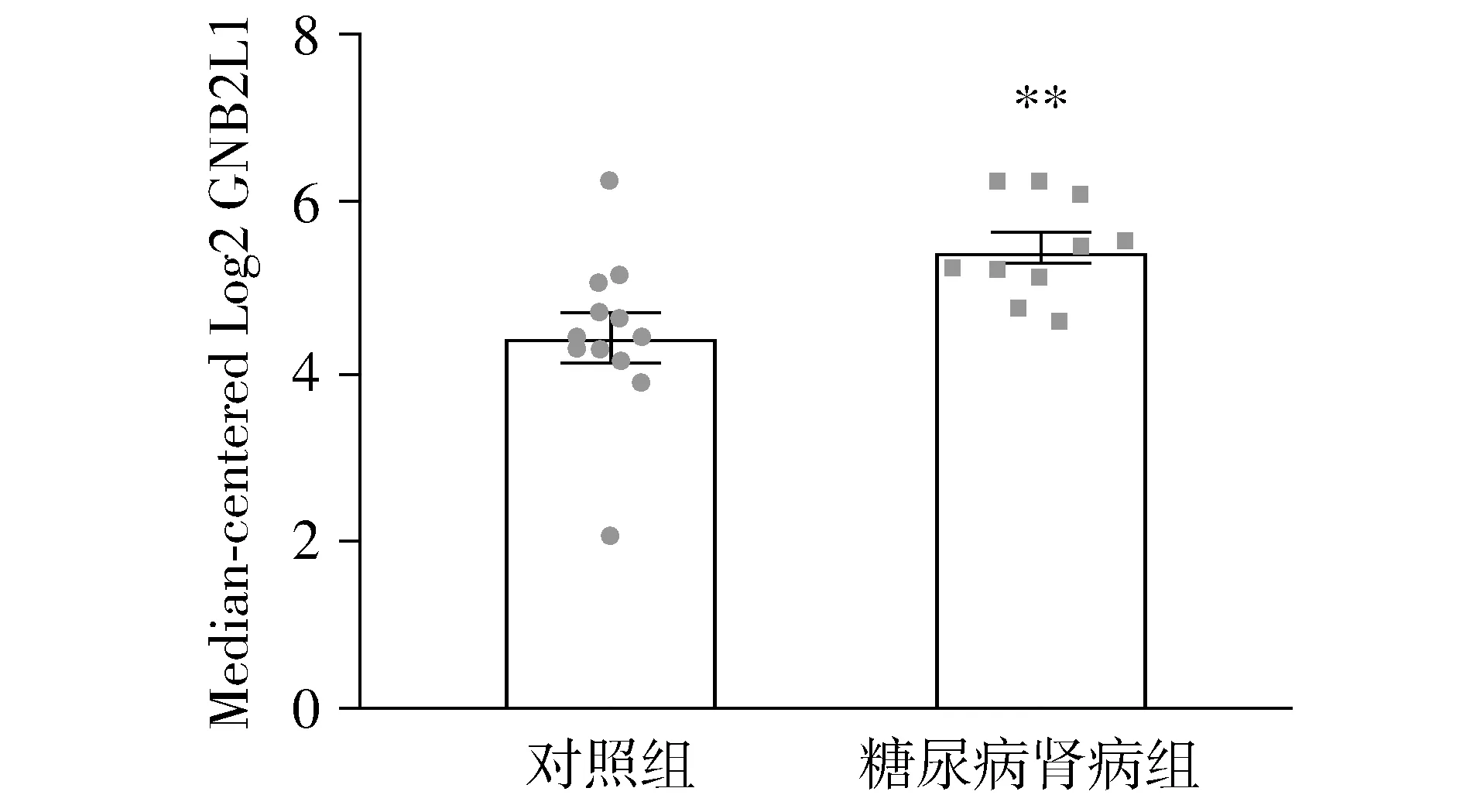
与对照组相比,**P<0.01图1 人的糖尿病肾病和正常肾脏组织的肾小管中RACK1(GNB2L1)的表达Figure 1 Expression of RAC1 in diabetic nephropathy group and healthy control group
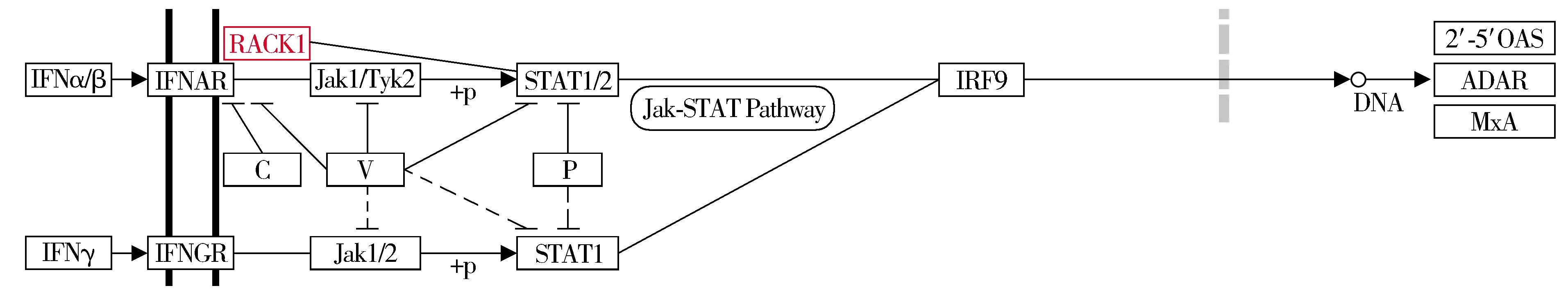
图2 通过KEGG搜索RACK1参与的信号通路Figure 2 Pathway of RACK1 by KEGG
2.3 HK-2细胞中RACK1、STAT1和STAT3的mRNA水平的表达
real-time PCR示高糖组RACK1、STAT1和STAT3的mRNA水平均较对照组和甘露醇组均明显升高,差异有统计学意义(P<0.001,见图3)。
2.4 糖尿病肾病动物模型中蛋白尿变化
与对照组相比,糖尿病肾病组小鼠体质量无明显变化。糖尿病肾病组血糖水平从STZ注射2周后开始升高,一直维持在较高水平,糖尿病肾病组肾质量/体质量(KW/BW)、尿白蛋白肌酐比(ACR)和24 h尿蛋白定量(UAE)均明显高于对照组,差异有统计学意义(P<0.05,见图4)。

与对照组和甘露醇组相比,***P<0.001图3 高糖刺激的HK-2细胞中RACK1、STAT1和STAT3的表达Figure 3 Expression of RACK1,STAT1and STAT3 in HK-2 cells with high glucose
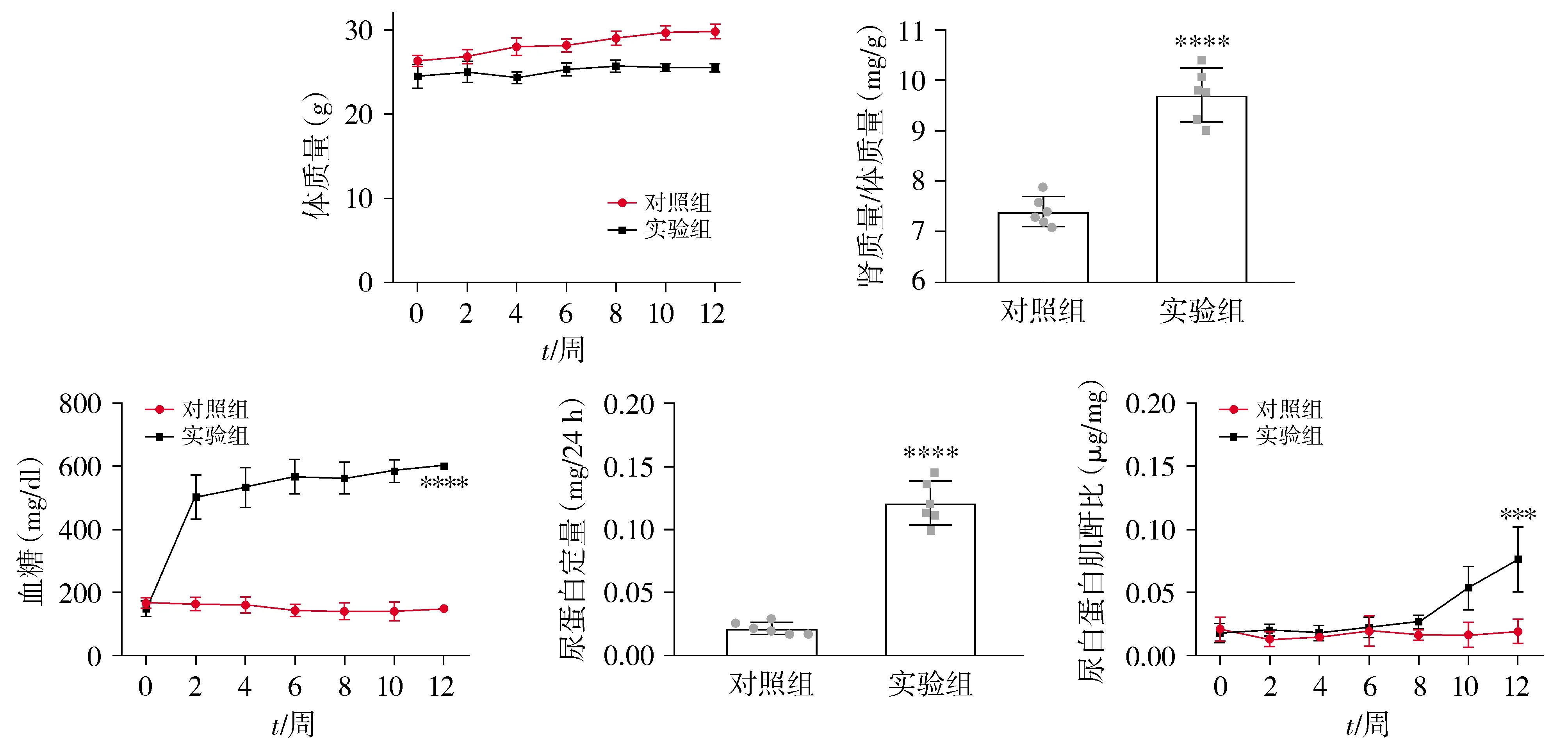
与对照组比较,***P<0.001,****P<0.000 1图4 糖尿病肾病小鼠体质量、血糖及蛋白尿变化Figure 4 Changes of body weight,kidney weight/ body weight,blood glucose,ACR and UAE in diabetic nephropathy animal model
2.5 糖尿病肾病动物模型中RACK1、STAT1和STAT3的mRNA水平的表达
real-time PCR示糖尿病肾病组中RACK1、STAT1和STAT3的mRNA水平较正常组明显升高,差异有统计学意义(P<0.05,见图5)。
2.6 糖尿病肾病动物模型的组织学变化
PAS染色示糖尿病肾病组中肾小球体积增大,系膜增生,肾小管扩张;免疫荧光示p-STAT1染色阳性,主要位于肾小管上皮细胞(见图6);p-STAT3染色阴性。
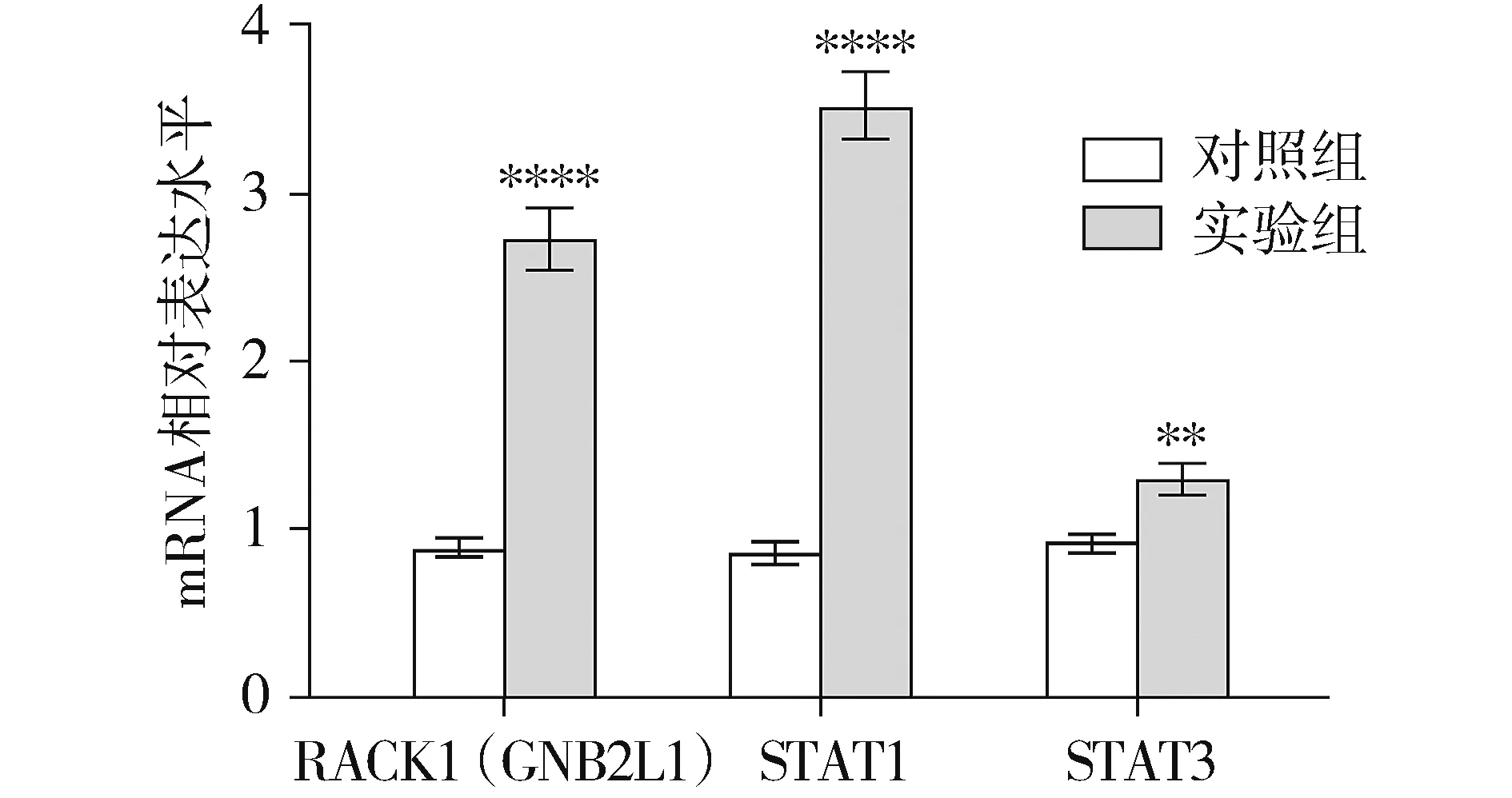
与对照组相比,**P<0.01,****P<0.000 1图5 糖尿病动物模型中RACK1、STAT1和STAT3的表达Figure 5 Expression of RACK1,STAT1 and STAT3 in diabetic nephropathy animal model
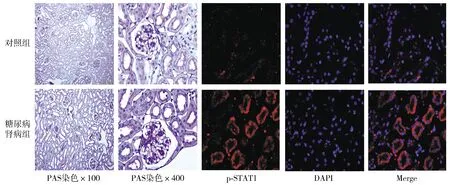
图6 糖尿病肾病动物模型肾小管的组织学变化Figure 6 PAS and immunofluoresence staining of tubule tissues in diabetic nephropathy animal model
3 讨论
糖尿病肾病是糖尿病严重的并发症之一,约50%患者存在糖尿病肾病,是导致终末期肾衰竭的首要原因,但其发病机制目前仍不清楚。糖尿病肾病存在明显的肾小球病变,文献报道[3]的关于发病机制的研究多集中于肾小球。Bonventre[1]报道,肾小管病变也是不可或缺的,甚至早于肾小球病变,而且肾小管的病变为主动过程,并不是继发于肾小球病变,且肾功能的异常与肾小管损害密切相关,Tang等[2]甚至提出了糖尿病肾小管病(diabetic tubulopathy)的概念。近年来许多新的证据提示肾小管,尤其是近端小管,是糖尿病肾病的启动者,参与糖尿病肾病的发生发展[4]。
RACK1是WD40重复蛋白家族中一员,被报道参与数种疾病的进展[5-7]。有研究表明RACK1过表达抑制成年鼠心肌缺血再灌注的心肌细胞凋亡[8];RACK1下调可抑制食管鳞状细胞癌体外和体内实验中细胞增生、侵袭及转移[9];RACK1能促进TGF-β1调节前纤维通路的激活和肝星状细胞(HSCs)的转分化、增生和迁移,RACK1敲除后抑制硫代乙酰胺诱导的肝纤维化[10];本课题组前期试验第一次证明RACK1在肾纤维化中的作用,说明其可能参与终末期肾脏病的发生发展[11]。但其在糖尿病肾小管病中的作用及机制却未见报道。故本实验利用GEO数据库,初步探讨及分析其在糖尿病肾小管病中表达,发现RACK1在人的糖尿病肾病的肾小管中表达升高。
Tang等[12]报道糖化白蛋白可引起近端肾小管细胞中STAT-1升高,可被罗格列酮抑制,降低糖尿病肾病中的促炎症因子,如ICAM-1、IL-6。Berthier等[13]报道在人糖尿病肾病的肾活检标本中,STAT-1和STAT-3在肾小管间质中明显升高。通过KEGG搜索,发现RACK1参与Jak-STAT信号通路发挥作用。故推测RACK1可能是通过Jak-STAT信号通路参与糖尿病肾病的发生发展。
首先本研究证实在高糖刺激HK-2细胞中,RACK1、STAT1和STAT3均明显升高。结合文献报道[2]推测糖尿病肾小管病可能是糖尿病肾病的启动者,推动糖尿病肾病的发生发展。为了进一步验证其在早期糖尿病肾小管病中的表达及可能的机制,利用链脲佐菌素建立糖尿病肾病的模型,我们发现链脲佐菌素注射后8周小鼠尿白蛋白肌酐比(ACR)逐渐开始升高,12周ACR小于0.1 μg/mg,糖尿病肾病组肾质量/体质量升高,光镜下肾小球轻度增大,无系膜增宽等改变,提示处于早期肾小球高滤过状态,早期糖尿病肾病模型建立成功。real-time PCR提示糖尿病肾病组中RACK1、STAT1和STAT3均明显升高,由此可见,早期糖尿病肾病中,RACK1明显升高,组织学免疫荧光染色示肾小管中p-STAT1阳性,但p-STAT3阴性,推测RACK1可能主要是通过磷酸化STAT1而激活下游靶基因来发挥作用的。但要阐明RACK1与p-STAT1的关系,以及在糖尿病肾小管病中的机制,仍需进一步实验研究。
文献报道糖尿病肾小管病可能为糖尿病肾病的启动者,与糖尿病肾病的发生、发展密切相关。本实验首次发现RACK1在糖尿病肾小管病中的作用,可能通过磷酸化STAT1进而激活Jak-STAT信号通路调节下游靶基因来发挥作用,若可通过干预RACK1及其信号通路,早期阻断糖尿病肾病的启动因素——糖尿病肾小管病,将为避免糖尿病肾病的发生发展做出巨大贡献,为上亿糖尿病患者带来福音。
