Cajal间质细胞在慢传输型便秘中的作用及番泻苷A的治疗作用
2020-07-14张静瑜秦小金王景杰
林 强,张静瑜,秦小金,王景杰*,李 冀
(1空军军医大学唐都医院消化内科,西安 710038;2西安市第六医院消化内科;*通讯作者,E-mail:jingjie@fmmu.edu.cn;#共同通讯作者,E-mail:827537844@qq.com)
慢传输型便秘(slow transit constipation,STC)是由于结肠功能紊乱、传导功能失常造成的排便困难、排便时间延长,常见症状以大便干燥、排便次数减少、腹胀等。STC患者就诊人数逐渐增多,发病率逐年上升,严重影响人们生活质量[1]。目前治疗慢传输型便秘经常使用的药物为促胃肠动力药物,中药在慢传输型便秘的治疗作用和药理机制是临床和基础研究的一个重要的方向。番泻叶是尖叶番泻或狭叶番泻的干燥小叶[2],其性味甘、苦、寒,归大肠经,具有泻热行滞,利肠腑,通大便之功效[3],有明确的促胃肠动力作用,是临床应用最广泛的导泻药之一。大量的临床实践发现,番泻叶可促胃肠蠕动,对胃肠道动力障碍性疾病的治疗效果显著[4-6]。番泻苷A是番泻叶的有效成分之一[6-8],但是关于番泻苷A在STC中的作用及其机制目前研究尚不明确。
目前研究认为,STC的病因及发病机制与肠道动力异常密切相关[9]。在胃肠道中,广泛分布Cajal间质细胞(ICC),它是胃肠道平滑肌慢波的发起者和传播者,被视为胃肠动力的起搏细胞[10]。我们前期研究结果表明,ICC表面的超极化激活环核苷酸门控阳离子通道(hyperpolarization-activated cyclic nucleotide-gated channels 1,HCN1)是其节律电活动的始发离子通道[11,12],目前尚不清楚ICC以及HCN1蛋白在慢传输型便秘形成中的作用。
我们课题组根据目前国内外研究基础,提出如下假说:Cajal间质细胞数目减少以及功能蛋白HCN1异常在慢传输型便秘发生发展中具有重要作用,而番泻苷很有用可能通过激活ICC细胞膜上的HCN1通道蛋白促进肠动力,进而改善慢传输型便秘的临床症状。针对以上的假说,本研究拟在成功制作STC动物模型基础上,采用免疫组织化学、药理学等方法研究ICC及其功能蛋白HCN1在慢传输型便秘形成过程中的作用及其机制,同时研究番泻苷A在慢传输型便秘中的药理作用以及药理机制,为进一步阐明慢传输型便秘发病机制以及后续研究番泻叶治疗STC奠定理论基础。
1 材料与方法
1.1 实验动物
7周龄SD大鼠30只,SPF级,雌雄各半,体质量(220±30)g,由空军军医大学动物实验中心提供(生产许可证号:SYXK(军)-2012-0023,动物合格证号SCXK(军)-2012-0007)。将SD大鼠30只随机分为正常组、模型组、ZD7288+番泻苷A组、番泻苷A组和莫沙必利组,每组6只;除正常组外,其余各组采用冰水灌胃法,灌胃给予大鼠0-4 ℃生理盐水2 ml/只,1次/d,14 d,建立慢传输型便秘大鼠模型。
1.2 主要试剂、仪器
番泻苷A由陕西中医药大学药物研究所提供,根据《中华人民共和国药典》(一部)[3]计算番泻苷A大鼠与人体等效剂量。ZD7288(HCN1阻断剂)为美国Abcam公司产品;山羊抗兔FITCt购自美国Sigma公司;驴抗鼠Texas-red购自美国Molecular Probes公司;兔抗c-kit多克隆抗体购自美国Sigma公司;鼠抗HCN1单克隆抗体购自美国Sigma公司。FV1000激光共聚焦显微镜(日本Olympus公司);恒冷箱切片机(德国Leica公司);多导生理记录仪RM6280B(成都仪器厂)。
1.3 胃肠道组织标本制备
腹腔注射戊巴比妥钠(40 mg/kg)麻醉大鼠,先给予静滴生理盐水100 ml。随后用温度为4 ℃、浓度为40 g/L多聚甲醛磷酸盐(0.1 mol/L)缓冲液500 ml(PB,pH7.4),经静脉先快后慢灌流约2 h,将固定好的结肠组织置于25%蔗糖溶液,4 ℃浸泡过夜,待组织沉底后,恒冷箱切片机上连续切片,切片厚12 μm,风干,-20 ℃保存备用。
1.4 免疫荧光双标染色检测结肠c-kit阳性细胞数目和HCN1蛋白表达情况
将制备好的肠道组织冰冻切片或者全层铺片用含1% BSA+0.3%Triton的PBS液封闭1 h,入一抗(HCN1抗体按1 ∶500稀释,c-kit按1 ∶1 000稀释,GFAP抗体按1 ∶500稀释)。一抗孵育12 h(4 ℃)。经PBS漂洗后入二抗(羊抗兔FITC二抗,驴抗鼠Texas-red二抗均按1 ∶500稀释)室温孵育2 h,DAPI衬核。PBS漂洗,50%缓冲甘油封片,镜下观察组织。
1.5 大鼠结肠推进速度测定
实验前30 min,正常组和模型组均给予生理盐水灌胃,番泻苷A组给予1.0 mg/ml番泻苷A灌胃,ZD7288+番泻苷A组大鼠尾静脉给予0.5 ml HCN1的特异性阻断剂ZD7288(0.5 mmol/L)同时灌胃给予1.0 mg/ml番泻苷A干预,莫沙比利组给予灌胃给予0.05 mg/ml莫沙比利;以上各组均灌服同体积液体(0.1 ml/100 g)。各组大鼠用30%水合氯醛麻醉,待麻醉成功后,将直径3 mm玻璃小球用细的塑料软管推入距肛门3 cm直肠处。笼内垫清洁滤纸,待大鼠苏醒后迅速移至笼内喂食饮水,并开始计时,记录直肠内玻璃小球排出的时间。
1.6 结肠离体肌条制备
将20只SD大鼠在室温(20±2)℃的环境中饲养,其中15只SD大鼠给予0-4 ℃生理盐水2 ml灌胃,每日1次,共14 d,建立慢传输型便秘大鼠模型,随机分成正常组、模型组、番泻苷A组、ZD7288+番泻苷A组,每组各5只。将大鼠脱颈椎处死,从腹部正中剖开腹腔,取结肠,在距离肛门约5 cm处截取一段结肠,长4-5 cm,放入盛有4 ℃ Krebs液的培养皿中,持续通入5%二氧化碳和95%氧气的混合气体,保持标本活性;用湿棉签擦破结肠系膜,用眼科镊剔除浆膜,沿结肠系膜纵行剪开肠腔,用Krebs液洗净结肠内容物,将肠管黏膜层朝上铺平固定在硅胶板上,用眼科镊和玻棒剥除黏膜层及黏膜下层组织,观察结肠环行肌走行,将两个刀片固定刀片架上,刀片之间距离设定为3 mm,沿结肠环行肌走行方向切取3 mm×8 mm的肌条,再沿着纵行平滑肌纤维的方向切取3 mm×8 mm的肌条。
1.7 离体结肠肌条收缩频率和幅度测定
将制备好的环行肌肌条、纵行肌肌条标本移入持续通以95%氧气和5%二氧化碳混合气体,盛有37 ℃ Krebs液中的恒温肌槽中,含钙Krebs液:NaCl 6.75 g/L,CaCl20.28 g/L,KCl 0.344 g/L,NaHCO31.84 g/L,MgSO47 g/L,NaPO40.18 g/L,H2O 0.28 g/L,葡萄糖2.0 g/L,维持pH值于7.3-7.5;在肌条两端分别用医用丝线扎牢,一端固定在平滑肌槽下端的弯钩,另一端固定于张力换能器,在前负荷为1.0 g状态下,孵育肌条1 h,每15 min更换新鲜Krebs液1次,待肌条自发收缩活动平稳后,通过多导生理记录仪,记录纵行肌肌条和环行肌肌条的收缩振幅和频率,描记活动曲线3-5 min。番泻苷A组给药的方法,先给予番泻苷A(1.0 mg/ml)0.5 ml,观察肌条收缩振幅和频率,描记给药后肌条活动曲线3-5 min;ZD7288+番泻苷A组给药的方法,加入HCN1阻断剂ZD7288(0.5 mmol/L)0.5 ml,观察肌条收缩和频率,同时记录给药后肌条活动曲线3-5 min,5 min后加入番泻苷A(1.0 mg/ml)0.5 ml,再次观察肌条收缩和频率,并描记给药后肌条活动曲线。
1.8 统计学分析
2 结果
2.1 慢传输型便秘大鼠胃肠道c-kit阳性细胞ICC数目和HCN1蛋白表达的变化
免疫组织化学荧光双标染色结果显示,在慢传输型便秘大鼠胃肠道中,c-kit免疫荧光强度及光密度值与对照组相比均显著下降,即c-kit阳性ICC细胞数目显著减少(P<0.05,见图1,2);同样,在慢传输型便秘大鼠胃肠道中HCN1免疫荧光密度值和对照组相比亦均显著下降,即HCN1蛋白表达水平显著下降(P<0.05,见图1,2)。
2.2 在体阻断离子通道HCN1对番泻苷A促结肠蠕动作用的影响
特异性阻断HCN1通道蛋白,观察HCN1被阻断剂阻断后番泻苷A对结肠蠕动的影响。实验结果显示:模型组结肠推进速率低于正常组(P<0.05);番泻苷A组和莫沙比利组结肠推进速率明显高于模型组(P<0.05),而ZD7288+番泻苷A组结肠推进率和模型组相比较无统计学差异(P>0.05,见图3)。同时,番泻苷A组结肠推进速率略高于莫沙必利组(P<0.05),即番泻苷A促结肠动力效果优于莫沙必利;而ZD7288+番泻苷A组结肠推进率显著低于番泻苷A组(P<0.05,见图3)。
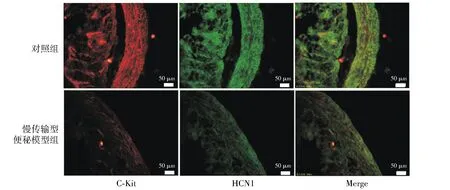
图1 大鼠近端结肠c-kit阳性细胞数目和HCN1蛋白表达变化情况Figure 1 The number of c-kit positive ICC and the expression of HCN1 in the proximal colon of rats
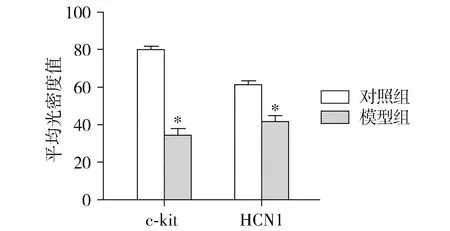
与正常组比较,*P<0.05图2 两组大鼠近端结肠c-kit阳性细胞密度和HCN1蛋白表达水平比较Figure 2 Comparison of the density of c-kit positive ICC and expression of HCN1 in the proximal colon of rats between normal group and model group
2.3 番泻苷A和ZD7288干预对结肠纵行平滑肌肌条收缩情况的影响
模型组慢传输型便秘模型大鼠结肠纵行肌收缩幅度和频率明显小于正常组大鼠结肠纵行肌收缩幅度和频率(P<0.05);番泻苷A组与模型组相比,大鼠纵行肌收缩频率和收缩幅度均明显升高(P<0.05)。但是ZD7288+番泻苷A组大鼠结肠纵行肌收缩频率和收缩幅度与模型组比较差异均无统计学意义(P>0.05,见图4),即番泻苷A组促结肠纵形肌收缩作用可以被HCN1阻断剂所阻断。
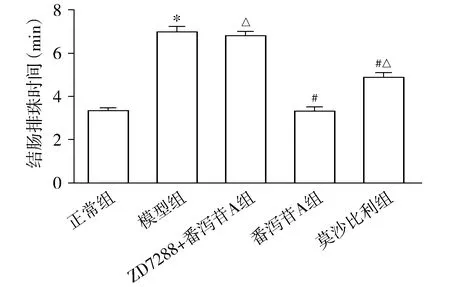
与正常组比较,*P<0.05;与模型组比较,#P<0.05;与番泻苷A组比较,△P<0.05图3 在体阻断HCN1对番泻苷A促结肠蠕动作用的影响Figure 3 Effect of blocking HCN1 in vivo on the role of sennoside A in promoting colon peristalsis
2.4 番泻苷A和ZD7288干预结肠环行平滑肌肌条收缩情况的影响
模型组慢传输型便秘模型大鼠结肠环行肌收缩幅度和频率明显小于正常组大鼠结肠环行肌收缩幅度和频率(P<0.05)。给予番泻苷A干预的慢传输型便秘模型大鼠环行肌收缩频率和收缩幅度与模型组大鼠环行肌收缩频率和收缩幅度相比,两个指标均明显升高(P<0.05)。但是ZD7288+番泻苷A组大鼠结肠环行肌收缩频率和收缩幅度与模型组大鼠结肠环行肌收缩频率和收缩幅度差异均无统计学意义(P>0.05,见图5),即番泻苷A组促结肠环形肌收缩作用可以被HCN1阻断剂所阻断。
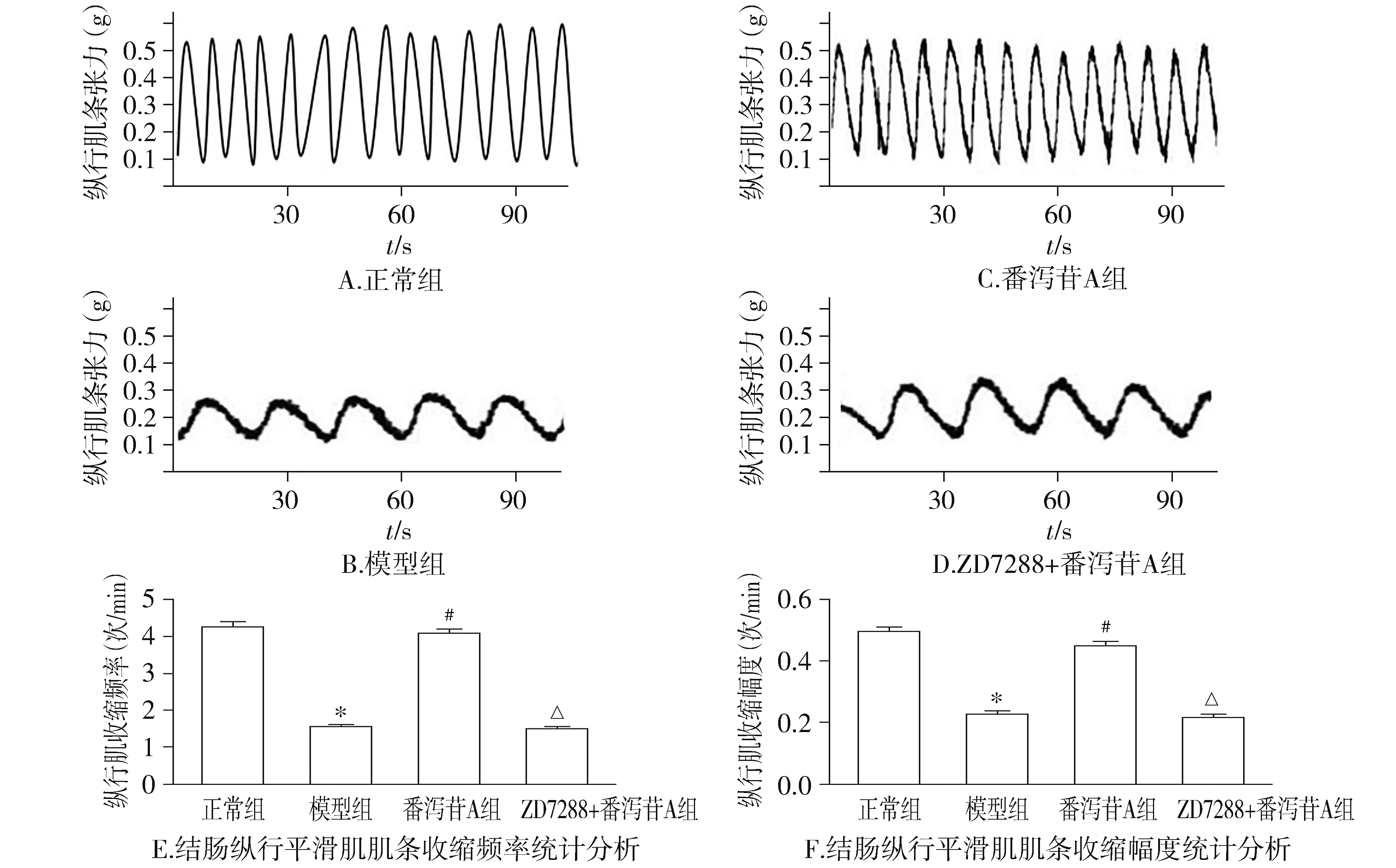
与正常组比较,*P<0.05;与模型组比较,#P<0.05;与番泻苷A组比较,△P<0.05图4 番泻苷A和ZD7288对大鼠结肠纵行平滑肌肌条收缩的影响Figure 4 Effect of Sennoside A or ZD7288 on the e spontaneous contractile activity of the longitudinal muscle strip isolated from the colon of the adult rat
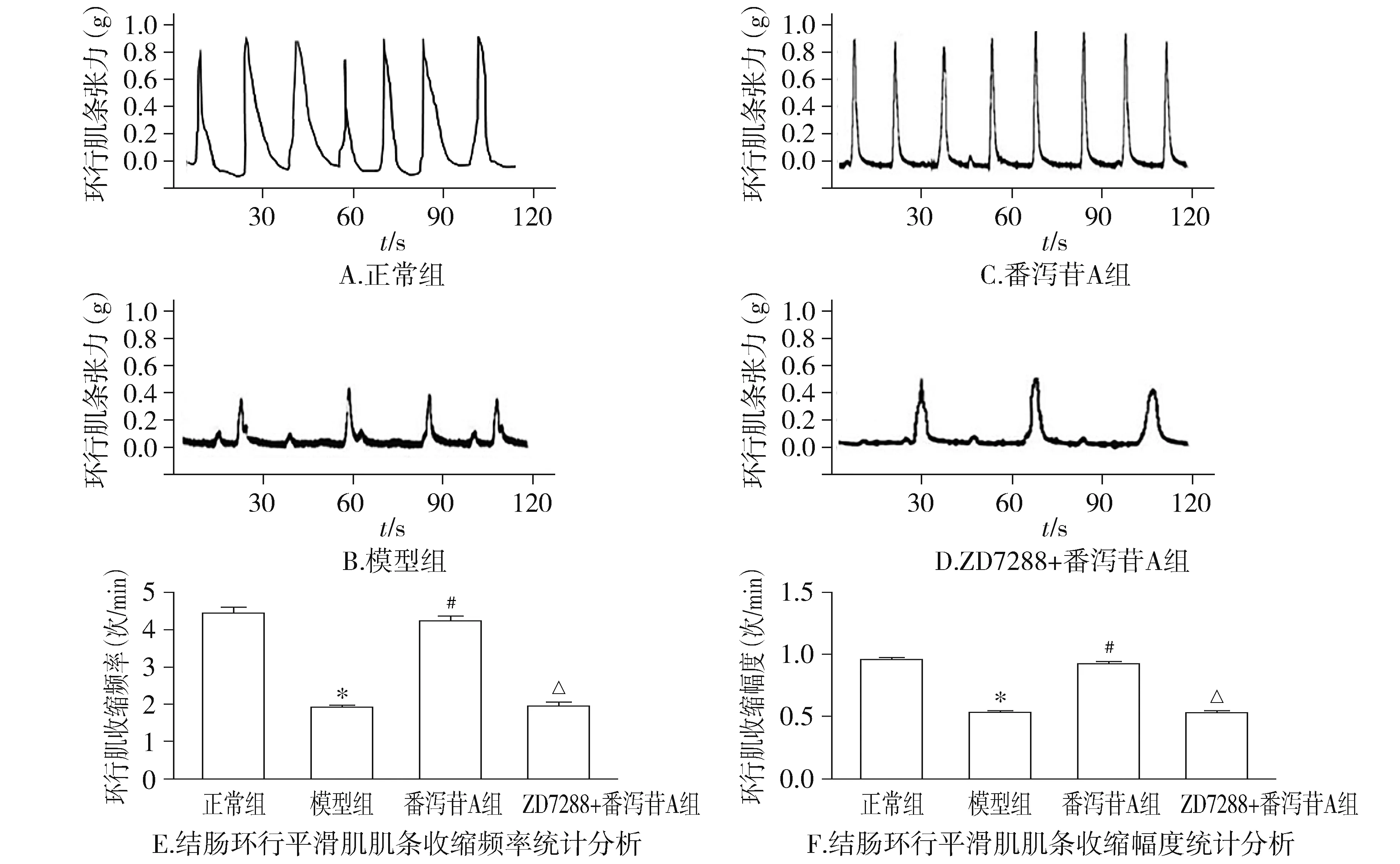
与正常组比较,*P<0.05;与模型组比较,#P<0.05;与番泻苷A组比较,△P<0.05图5 番泻苷A和ZD7288对大鼠结肠环行平滑肌肌条收缩的影响Figure 5 Effect of sennoside A or ZD7288 on the spontaneous contractile activity of the circular muscle strip isolated from the colon of the adult rats
3 讨论
慢性特发性便秘(chronic idiopathic constipation,CIC)已经成为最常见的胃肠道疾病之一,全球发病率为14%[13]。其中慢传输型便秘(STC)是慢性特发性便秘最为常见的一种亚型,约占慢性特发性便秘患者42%[14]。北京地区在2001年及2010年两次对慢性便秘流行病学的调查结果显示,发病率分别为6.07%和4.1%,女性多于男性[15,16]。还有广州、西安、天津、杭州等地也曾进行便秘流行病学调查,各地的发病率有很大差异,在3%-17%之间[17-21]。便秘不仅对患者的身心健康造成长期的不良影响,同时也造成了巨大的经济负担。最近的一项研究表明,平均每年为每位便秘患者提供的医疗费用为7 522美元[22]。因此,针对慢性特发性便秘尤其是慢传输型便秘的发病机制和诊疗策略的研究具有重要的临床意义。
已经有许多研究表明,结肠动力障碍在慢传输型便秘的发生发展过程中发挥着重要作用[14,23]。在胃肠道平滑肌层中,环行肌和纵行肌协调舒缩是胃肠动力产生的重要基础。因此,对STC疾病模型结肠环、纵行肌运动特征的研究,将有助于我们进一步深入理解STC的发病机制。本次实验在体检测结肠排珠时间,结果显示,与正常大鼠相比,慢传输型便秘模型大鼠结肠传输速率均显著下降;在此基础上,通过离体肌条实验探究结肠环纵行肌运动特点,结果显示,与正常大鼠相比,慢传输型便秘模型大鼠结肠肠道平滑肌收缩幅度和频率显著下降。以上研究结果提示,慢传输型便秘之所以发生,不但其结肠的舒缩功能下降(主要是环形肌的作用),而且其推进功能也降低(主要是纵行肌的作用),二者的功能改变,进而导致其协同性的下降,进一步导致结肠舒缩和推进的下降,使得结肠处于一种“无力”的状态,结肠运动障碍,水分过度吸收,进而使得大便性状及在结肠中被推进的速率均产生了变化,患者表现为排便费力和大便干结的情况。
不同于骨骼肌,胃肠道平滑肌存在自发性、节律性收缩运动,即慢波节律;慢波是胃肠运动的基本节律,在胃肠动力形成过程中发挥至关重要的作用[24]。本次离体肌条实验结果显示,STC模型大鼠结肠慢波频率和幅度均下降,这提示慢波节律的异常是STC形成的重要病理生理机制。但是,导致STC结肠慢波节律异常的潜在细胞与分子基础研究尚不明确。大量研究表明,Cajal间质细胞(interstitial cells of Cajal,ICC)作为胃肠道起搏细胞,是胃肠道慢波的发起与传播者,它在胃肠道平滑肌收缩节律、幅度、方向的调节中发挥着重要作用[10,24]。Cajal间质细胞是广泛分布于胃肠道肌层一种间质细胞,可以被干细胞因子受体c-kit特异性标记[25]。研究表明,化学性损害Cajal间质细胞可以导致胃肠慢波节律明显异常甚至消失[26]。随后通过膜片钳技术发现,ICC确实具有自发性电节律特点[27]。而且,也有研究报道运用中和性抗体阻断ICC膜上标记分子c-kit或者基因敲除c-kit,可以导致ICC发育缺陷,同时导致胃肠道慢波形成障碍[28]。Cajal间质细胞在胃食管反流病、胃轻瘫等胃肠动力障碍性疾病中均具有重要作用[29,30],但是ICC在慢传输型便秘中的作用研究尚不是很明确。为了进一步研究Cajal间质细胞在慢传输型便秘发生发展过程中的作用及其机制,我们采用免疫荧光染色观察胃肠道ICC形态变化。实验结果显示,慢传输型便秘模型大鼠结肠c-kit阳性的ICC数目显著减少,同时HCN1蛋白表达也下调。HCN1通道蛋白在具有自发性电节律的心肌细胞、神经元上有分布,并介导这些细胞的起搏电流Ih(hyperpolarization-activated current)的形成,该电流又被称为If(funny current),因此HCN1在这些细胞的起搏电活动中发挥至关重要的作用[31,32]。而我们课题组前期研究结果表明,离子通道HCN1是特异性分布于ICC上的离子通道蛋白,在ICC起搏节律形成中作为始发离子通道而发挥着重要作用[11]。因此,胃肠道ICC数目降低、功能蛋白HCN1表达下调可能是慢传输型便秘形成的细胞和分子基础。
番泻叶主要成分为尖叶番泻叶含有的番泻苷A、B、C及芦荟大黄素-8-葡萄糖苷、大黄酸-1-葡萄糖苷、大黄酸-8-葡萄糖苷、芦荟大黄素、大黄酸糖等。番泻叶主要导泻成分为番泻苷A、B、C、D,其中番泻苷A和B互为同分异构体,且番泻苷A的含量较多,相对易于提取[7-9]。番泻叶具有泻下通便作用,因此被广泛应用于便秘患者的治疗中,番泻苷是番泻叶导泻促蠕动的有效成分,但是具体的机制尚不明确。本次在体实验结果表明,番泻苷A对慢传输型便秘模型大鼠结肠促蠕动作用优于传统促动力药莫沙比利,而离体肌条实验也发现番泻苷A可以显著提高胃肠道离体肌条收缩频率和幅度。但是如果选择性阻断HCN1可以明显削弱番泻苷A在慢传输型便秘模型大鼠中的促结肠动力作用。同时离体肌条实验也表明选择性阻断HCN1确实可以显著削弱番泻苷A促结肠肌条收缩作用。以上实验结果表明,番泻苷A促进慢传输型便秘模型大鼠结肠蠕动的作用有赖于HCN1通道蛋白的存在,但是番泻苷A是否通过激活HCN1通道蛋白来起促结肠动力作用还需进一步深入研究。
本次实验结果显示,慢传输型便秘模型大鼠结肠Cajal间质细胞数目减少、HCN1通道蛋白表达减少,这构成STC形成的细胞和分子基础;同时在体和离体实验结果表明番泻苷A可以通过促进慢传输型便秘模型大鼠结肠蠕动来发挥对STC的治疗作用,且这种作用有赖于HCN1通道蛋白的存在。但是进一步探究番泻苷A是通过激活HCN1通道蛋白来发挥药理作用,还需要开展细胞膜片钳实验才能直接验证。
