切应力对脑血管内皮细胞Notch通路表达的影响
2020-07-14古冬金苏小康郑贤美李黎明
古冬金,苏小康,王 帅,郑贤美,李黎明
(东北大学生命科学与健康学院生物技术研究所,沈阳 110819;*通讯作者,E-mail:liming-li2000@163.com)
脑动静脉畸形(brain arteriovenous malformation,BAVM)是一种动脉与静脉之间不经过毛细血管而直接相连产生的血管畸形[1]。其临床症状为疼痛、出血、静脉高压或缺血,但也可能没有临床表现[2]。流体切应力是通过血液流动在血管壁上产生的摩擦力,对血管的发育有着重要的作用。管腔内的循环血液和管壁内层的内皮细胞单层不断受到由血液流动引起的切应力[3]。这种机械刺激引起各种细胞反应,包括决定细胞活性的基因表达变化和蛋白质改变[4]。BAVM病灶的不断发展与其畸形血管中异常的血流动力学环境有关[5]。Notch信号通路包括Notch受体(Notch1-4)、Notch配体(Delta-like 1, 3, 4和Jagged1, 2)以及下游基因(Hes和Hey)。Notch信号通路表达异常可导致BAVM发生,有研究表明在人BAVM病变组织中血管内皮生长因子(vascular endothelial growth factor,VEGF)表达明显升高,并且抑制VEGF传导可以延缓BAVM形成。此外,也有研究表明切应力的作用可以激活内皮细胞Notch通路,切应力通过调控Notch通路来调节动静脉分化过程[6]。因此,我们推测血管微环境的变化可以影响血管的新生发育,切应力可以激活VEGF,进而上调Notch信号通路。
本研究选取脑血管内皮细胞(brain microvascular endothelial cells,MECs)为研究对象,利用平行平板流动腔,通过改变切应力作用大小和作用时间,探究切应力对Notch 通路的影响,进而分析切应力与Notch 信号通路在BAVM的发展过程中所起的作用,为BAVM 致病机制及治疗手段的进一步研究提供思路。
1 材料与方法
1.1 实验材料和试剂
本实验采用的MEC细胞系,购自北京中科质检生物技术有限公司;平行平板流动腔,购自上海泉众机电科技有限公司。DMEM培养基(美国Hyclone公司),胎牛血清(美国Invitrogen公司),胰蛋白酶(美国Gibco公司),Notch1 抗体(Abcam公司,美国),Hes1抗体(Abclonal公司,美国),VEGF抗体(Abclonal公司,美国),Dll4抗体(Abclonal公司,美国),GAPDH抗体(Abclonal公司,美国)。
1.2 细胞培养
血管MEC细胞用DMEM培养基培养、添加10%标准胎牛血清、1%的青链霉素,置于37 ℃,5% CO2培养箱中培养。
1.3 流体切应力加载
平行平板流动腔系统用于流体切应力加载。该系统包括蠕动泵、储液瓶、管道及流室。流室流道高度0.03 cm、细胞沿中轴方向种植于7.5 cm×2.4 cm×0.01 cm(长×宽×高)、经过0.1 g/L多聚赖氨酸包被的玻璃载玻片上。通过此装置,细胞可接受到稳定的层切应力刺激。采用τ=6μQ/WH2计算切应力强度。其中μ为培养基表观黏度,Q为流量,W为流槽宽度,H为流槽高度。本实验通过调节恒流泵转速改变Q值,达到实验所需切应力大小。
1.4 实验分组
本实验切应力大小为5,10,15 dyn/cm2层流切应力,加载时间为3,6,12 h。实验分静止对照组(0 dyn/cm2组)和切应力5 dyn/cm2组、10 dyn/cm2组和15 dyn/cm2组,各组分别在作用3,6,12 h后检测蛋白表达。
1.5 Western blot检测VEGF、Notch1、Dll4和Hes1的表达
将蠕动泵中载玻片置于干净培养皿中,提取蛋白,采用BCA 法测定蛋白浓度。样品中加入上样缓冲液煮沸10 min,然后行SDS-PAGE电泳,湿转法转膜90 min,于室温下5%(质量分数)脱脂牛奶中封闭1 h,将膜置入一抗(VEGF 1 ∶1 000,Notch1 1 ∶1 000, Dll4 1 ∶1 000,Hes1 1 ∶1 000,GAPDH 1 ∶1 000),于4 ℃孵育过夜,经PBST 清洗3 次,于室温下HRP标记的二抗中孵育1 h,经PBST 清洗3次后,加入ECL化学发光液显色,于化学发光系统检测。
1.6 统计学分析
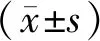
2 结果
2.1 切应力作用3 h对Notch通路的影响
对MEC施加5,10,15 dyn/cm2层流切应力处理3 h后提取细胞蛋白,通过Western blot检测Notch 通路相关蛋白的表达。结果显示VEGF、Notch1、Dll4 和Hes1蛋白表达量在切应力大小为10 dyn/cm2时最高(P<0.05,见图1)。
2.2 切应力作用6 h对Notch通路的影响
对MEC经5,10,15 dyn/cm2切应力处理6 h后,通过Western blot检测VEGF和Notch通路相关蛋白的表达,结果显示VEGF、Notch1、Dll4 和Hes1在切应力强度为15 dyn/cm2时表达量最高(P<0.05,见图2)。
2.3 切应力作用12 h对Notch通路的影响
在MEC 经5,10,15 dyn/cm2切应力处理12 h后提取细胞蛋白,通过Western blot检测Notch通路相关蛋白的表达,结果显示VEGF、Notch1、Dll4 和Hes1的表达量最高时为切应力大小为15 dyn/cm2时(P<0.05,见图3)。
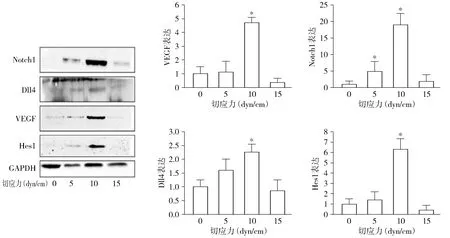
与静止对照组(0 dyn/cm2)比较,*P<0.05图1 切应力作用3 h后对Notch通路相关蛋白表达的影响Figure 1 Effect of shear stress on the expression of Notch signaling pathway-related proteins after MECs being cultured for 3 h
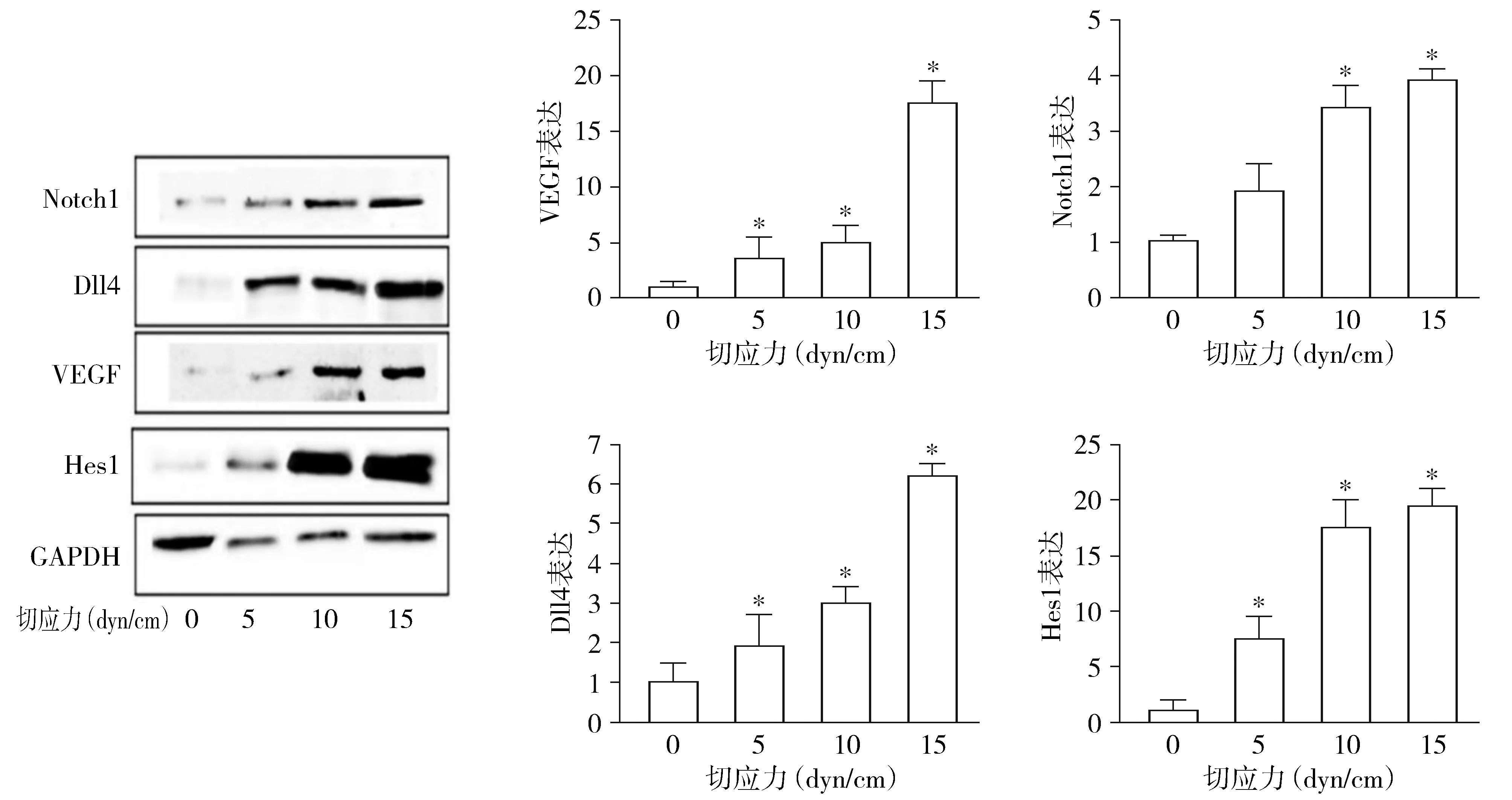
与静止对照组(0 dyn/cm2)比较,*P<0.05图2 切应力作用6 h后对Notch通路相关蛋白表达的影响Figure 2 Effect of shear stress on the expression of Notch signaling pathway-related proteins after MECs being cultured for 6 h

与静止对照组(0 dyn/cm2)比较,*P<0.05图3 切应力作用12 h后对Notch通路相关蛋白表达的影响Figure 3 Effect of shear stress on the expression of Notch signaling pathway-related proteins after MECs being cultured for 12 h
3 讨论
近年来有关生物组织应力-生长关系研究表明,从器官、组织到细胞、亚细胞等各个层次上的生命运动都需要一定力学环境作为基础。细胞与组织的结构、活动及其功能与其所处的力学环境密切相关。脑血管内皮细胞与血流直接接触,血流对血管内皮细胞的作用除了供应营养外,其作为流体对血管内皮细胞也有着多种机械力作用,而在这其中,作为血管内皮细胞所处力学环境的一个重要组成部分,切应力的作用至关重要。
研究发现切应力作用可激活血管内皮细胞Notch信号通路,在切应力环境中培养血管内皮细胞30 min后即可在其细胞核检测到NICD段[7],表明切应力作用下细胞Notch 通路被激活。
在BAVM的畸形血管中常存在异常升高的血流切应力作用。我们通过改变切应力的作用大小和作用时间,观察切应力对Notch通路相关蛋白的表达。结果表明,切应力可以显著上调 Notch通路相关蛋白的表达。本次实验中,在切应力作用下,VEGF的表达上升,且在切应力作用时间相对较短(≤3 h),切应力大小为10 dyn/cm2时达到最大,而后随着作用时间(≥6 h)的延长,VEGF的表达量随着作用力强度的增加而增加。有研究发现相较于血流正常的低切应力血管,在高血流切应力血管中,血管内皮细胞VEGF表达量显著增高[8]。这与本实验的研究结果相一致,随着切应力作用时间的延长,在10 dyn/cm2和15 dyn/cm2作用强度下,VEGF表达量显著增高。同样,随着切应力作用时间的延长(≥6 h),作用强度的增加(≥10 dyn/cm2),Notch1蛋白的表达量较对照组也显著增高。实验结果表明,10 dyn/cm2以上切应力的作用会导致细胞中Notch1 蛋白表达量显著增加,且这种作用是呈切应力剂量依赖性。这说明切应力作用对脑血管内皮细胞Notch1 蛋白表达有促进作用,在长时间的高切应力作用下,脑血管内皮细胞Notch1蛋白表达量增加,血管内皮Notch 通路变得更易被活化,这可能是造成BAVM畸形血管中静脉发生动脉化的原因之一。
Dll4是Notch蛋白的配体,有研究发现在BAVM畸形血管内皮细胞中Notch 配体表达量显著高于正常组织[9]。本次实验中,Notch蛋白的配体Dll4蛋白随着切应力强度和作用时间的增加而表达量增加,说明高切应力作用可能会通过提高血管内皮细胞表面Notch配体数量,来激活其Notch信号通路。Notch蛋白发生剪切后,Notch胞内段(Notch intracellular domain,NICD)转运进入细胞核后组装形成转录激活物,进而激活Hes1的转录,起始Notch通路下游基因的表达[10]。而此次实验中Hes1蛋白的表达水平随着切应力和作用时间的增加而增高,一定程度上也反映了Notch通路的激活情况。
总之,BAVM由于动静脉短路而产生高血流切应力,同时,短路动静脉畸形中高血流带来高静脉压,其中静脉部分不断扩张并发生纤维化,一方面增加血管破裂风险,另一方面又进一步降低了血管中的阻力,形成负反馈过程不断加重畸形血管中的高血流状态。而切应力作用后Notch1蛋白被激活。同时,细胞在切应力作用下培养一段时间后,其Notch1、Dll4以及Hes1蛋白的表达量均相对于静止培养时(对照组)的表达量明显上调。血管内皮细胞受到持续高切应力刺激上调VEGF,诱导Notch1与Dll4表达上调,Dll4激活相邻细胞的Notch通路,导致BAVM不断发展并产生畸形的动脉化静脉血管。因此,我们的研究结果为预防和治疗脑动静脉畸形提供了新的目标和思路。
