基于光谱学的溶解性有机物与重金属作用机理研究
2020-07-13
(成都理工大学 a. 地质灾害防治与地质环境保护国家重点实验室,b. 环境与土木工程学院,四川 成都 610059)
目前,养殖业的快速发展造成大量水产动物排泄物和过剩饵料排入水体中,导致受纳水体水质显著恶化、生态水环境问题突出。常见的养殖业污染物包括溶解性有机物(DOM)、氮和磷等[1]。其中,DOM是一类具有不同分子大小、结构和化学性质的复杂有机化合物,对环境污染物的形态、迁移、转化、毒性及生物效应等均具有重要的影响[2]。现阶段研究表明,DOM极易与重金属离子发生相互作用,进而影响重金属离子在水生环境中的形态分布、溶解、流动和毒性等,因此,研究DOM和重金属的相互作用机理,对探明重金属污染物的生物、地球化学循环具有重要的意义。
目前,采用光谱学技术来评估DOM与重金属之间的相互作用机理得到了广泛研究,最常用的有紫外-可见光谱、高效液相色谱(HPLC)、分子量分布和荧光光谱等[3-4]。其中,荧光光谱具有灵敏度高、选择性强等优点,已成为一种评估DOM与重金属相互作用的重要手段[5]。与传统扫描模式相比,三维荧光光谱(3D-EEM)技术通过同时改变激发波长和发射波长,可以提供更多关于荧光强度和位置的有用信息。结合化学计量学工具平行因子分析(PARAFAC)技术,可以进一步识别重叠荧光组分种类,已被成功地用于研究环境领域中各种荧光物质与重金属之间的相互作用机理[6]。然而,DOM中的主要成分(蛋白质、腐殖酸等)均存在与重金属离子反应的配位位点,对重金属离子具有不同的络合能力。二维相关光谱(2D-COS),将光谱信号扩展到第2维度上以提高光谱分辨率,可以观察到各吸收峰随外部扰动的变化关系以及对外部扰动的敏感程度[7-9]。结合2D-COS可以进一步揭示DOM与重金属之间的结合顺序,然而,目前相关报道较少。
本文中采用光谱学耦合化学计量学的手段研究DOM与重金属的相互作用及其机理。以Cu(Ⅱ)作为与DOM反应的典型重金属离子,采用3D-EEM、PARAFAC、同步荧光和2D-COS相结合的方法,对DOM与重金属反应过程和机理进行研究。
1 材料与方法
1.1 养殖废水及DOM样品来源
水产养殖废水取自某小型养鱼厂,取样时间为7月份,该时间段生物活性较大,DOM浓度相对较高。取样时,在厂区的4个角落分别采样,然后进行充分混合。混合废水DOM初始pH约为7.7。DOM样品通过孔径为0.45 nm的滤膜过滤,然后在温度为4 ℃的冰箱中储存备用。
1.2 DOM-重金属混合液荧光猝灭滴定
在50 mL容量瓶中加入25 mL DOM溶液和一系列不同体积的Cu(Ⅱ)溶液(质量浓度为100 mg/L),通过调控使得混合液中最终Cu(Ⅱ)的质量浓度保持在0~20 mg/L。采用HCl或NaOH,将初始pH调节至6.0,以避免重金属沉淀。随后,将该溶液在振荡摇床中摇晃混合12 h,确保反应达到平衡。
1.3 分析方法
通过使用总有机碳(TOC)分析仪(Vario TOC Select型,德国艾力蒙塔公司)分析DOM样品中的碳含量。以葡萄糖为标准,采用苯酚-硫酸法测定多糖(PS)含量,以牛血清白蛋白(BSA)为标准,采用改良Lowry法测定蛋白质(PN)含量。采用荧光光谱仪(LS-55型,美国珀金埃尔默公司)测量DOM与重金属离子反应前、后的3D-EEM光谱。测试条件如下,激发波长为200~400 nm,发射波长为250~580 nm,狭缝为10 nm。使用MATLAB 7.0和N-way工具箱对反应的3D-EEM图谱进行PARAFAC分析,得到相关组分和得分。同步荧光光谱波长为250~550 nm,Δλ为60 nm。参考Noda等[10]报道的方法,获得同步荧光光谱的同步和异步2D光谱。
2 结果与讨论
2.1 DOM中关键组分定量分析
表1所示为添加不同剂量Cu(Ⅱ)前、后DOM样品中主要组分TOC、PS和PN的变化情况。从表中可知,Cu(Ⅱ)的质量浓度从0增大到15 mg/L,DOM中的TOC的质量浓度逐渐从16.0 mg/L减小到6.56 mg/L,同时,PS、PN的质量浓度也分别从24.1、19.2 mg/L减小至17.5、2.35 mg/L,表明DOM中2种主要组分在与Cu(Ⅱ)相互作用中均发挥作用。此外,PN与PS质量浓度的比值从0.797减小至0.134,表明PN类物质对Cu(Ⅱ)络合的敏感性高于PS类物质。为了深入研究DOM和重金属之间的作用机理,以下主要采用3D-EEM、PARAFAC、同步荧光和2D-COS分别对蛋白质进行分析。
2.2 3D-EEM光谱表征
图1所示为DOM样品与不同剂量的Cu(Ⅱ)污染物反应前、后的3D-EEM光谱。从图中观察到DOM和Cu(Ⅱ)之间的相互作用不仅影响EEM光谱位置,也会影响峰值强度。如图1(a)所示,从原始DOM样品的EEM中鉴定出3个主要荧光峰:A峰出现在激发波长、发射波长分别为240、380.5 nm处,代表芳香族蛋白质类物质[11-12];B峰出现在激发波长、发射波长分别为330、424 nm处,代表腐殖酸类物质;C峰出现在激发波长、发射波长分别为260.0、443.5 nm处,代表富里酸类物质。一般而言,DOM中上述3个峰的荧光强度在与Cu(Ⅱ)结合后都有不同程度的降低。另外,随着不同剂量Cu(Ⅱ)的加入,A峰降低程度最为明显,表明DOM中的芳香族蛋白质类物质在Cu(Ⅱ)存在下具有较大的猝灭效应。

表1 添加不同剂量Cu(Ⅱ)前、后溶解性有机物样品中主要组分的变化情况
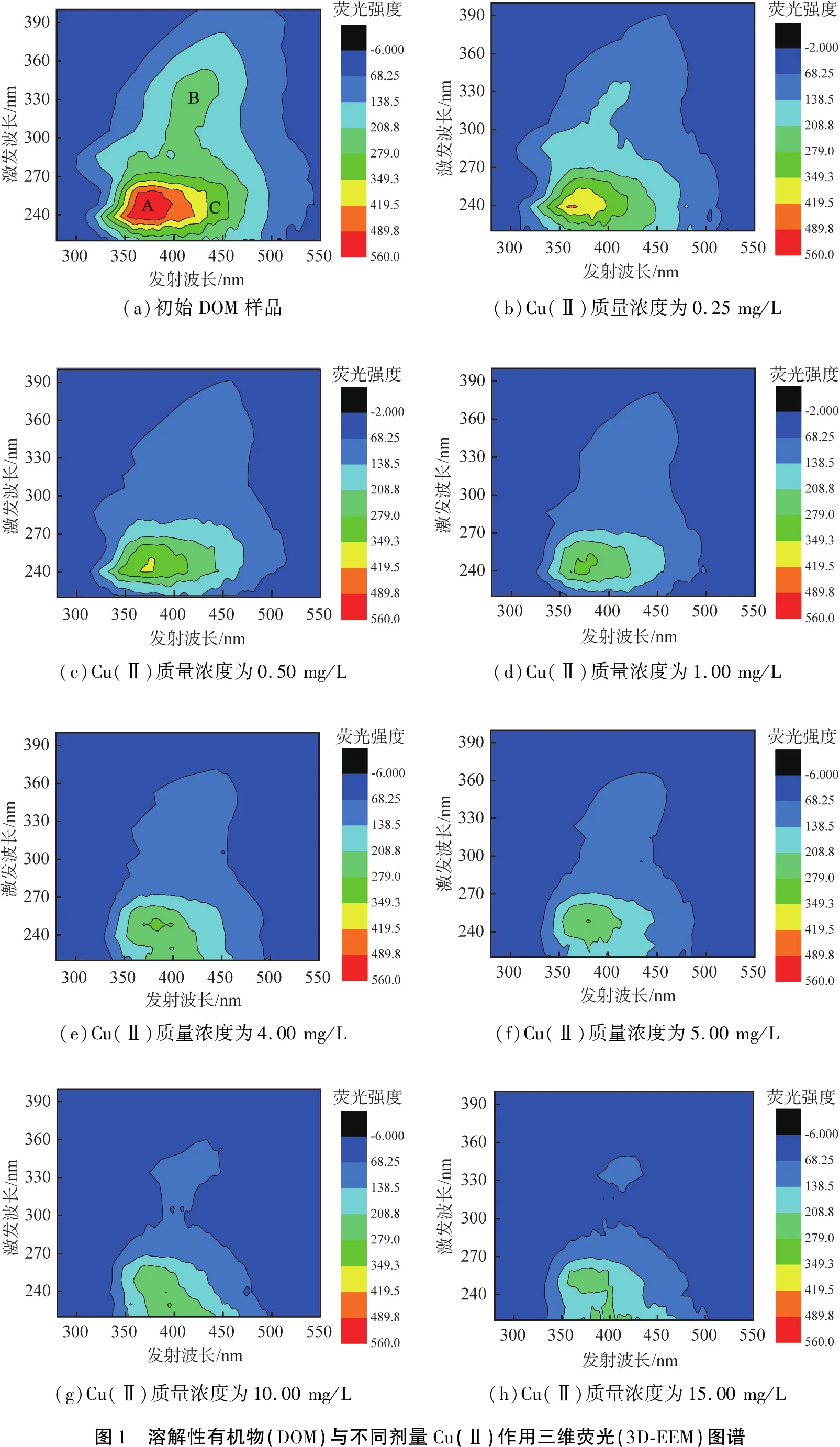
(a)初始DOM样品(b)Cu(Ⅱ)质量浓度为0.25mg/L(c)Cu(Ⅱ)质量浓度为0.50mg/L(d)Cu(Ⅱ)质量浓度为1.00mg/L(e)Cu(Ⅱ)质量浓度为4.00mg/L(f)Cu(Ⅱ)质量浓度为5.00mg/L(g)Cu(Ⅱ)质量浓度为10.00mg/L(h)Cu(Ⅱ)质量浓度为15.00mg/L图1 溶解性有机物(DOM)与不同剂量Cu(Ⅱ)作用三维荧光(3D-EEM)图谱
2.3 PARAFAC分析
采用PARAFAC技术将重叠的3D-EEM光谱分解成独立的荧光组分,结果如图2所示。PARAFAC模型鉴定DOM出现2个组分。对于组分1,在激发波长、发射波长分别为230、376.5 nm处鉴定出一个明显的荧光峰,属于芳香族蛋白质类物质。
组分2在激发波长、发射波长分别为350、438 nm处有一个主峰,在260、438 nm处有一个次峰,分别代表腐殖酸类物质和富里酸类物质。PARAFAC模型还提供了这2种荧光组分的相对分数,如图3所示。由图可以看出,2种荧光组分的相对分数均随着Cu(Ⅱ)的加入而减小,进一步说明它们之间存在的相互作用。

(a)蛋白质类物质

(b)腐殖酸和富里酸类物质图2 平行因子分析(PARAFAC)图谱识别的2个荧光组分
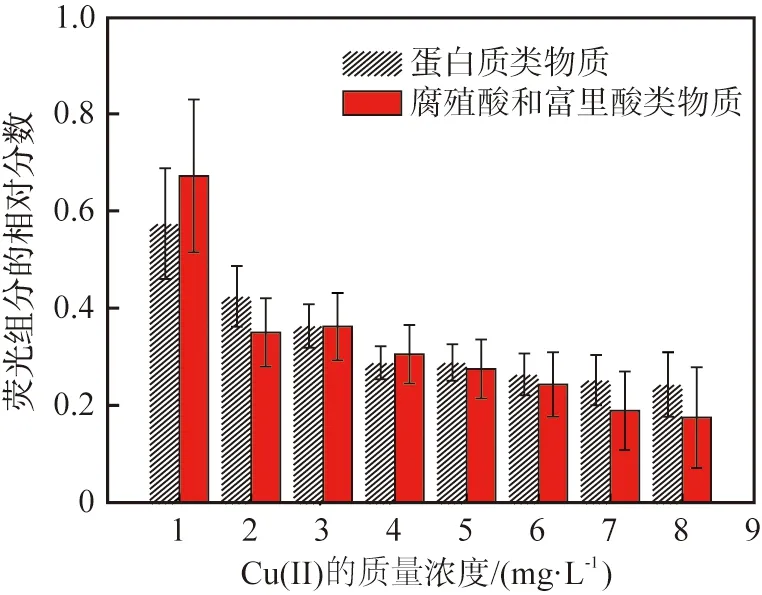
图3 基于平行因子分析(PARAFAC)的不同物质在不同溶解性有机物(DOM)样品中荧光组分的相对分数
2.4 同步荧光分析
图4所示为DOM样品随着Cu(Ⅱ)浓度变化的同步荧光光谱。根据之前文献报道,可以将同步荧光划分为3个不同区域,分别为蛋白质类、富里酸类和腐殖质类荧光区域,每个区域对应波长分别为250~300、300~380、380~550 nm[13]。初始DOM样品的同步荧光光谱中出现了2个明显的特征峰和一个小峰,分别位于284、343.5、380 nm处。与不同浓度的Cu(Ⅱ)反应后,3个峰值分别降低至DOM初始荧光强度的13.0%、27.2%、31.7%。结果表明,蛋白质类物质与Cu(Ⅱ)结合的程度降低幅度最大,这与EEM分析结果一致;但是,在一维同步荧光中,由于DOM与Cu(Ⅱ)具有很强的重叠吸收特性,因此很难提供关于DOM与Cu(Ⅱ)进一步结合特征的详细信息。

图4 Cu(Ⅱ)浓度不同时溶解性有机物(DOM)的同步荧光光谱
2.5 2D-COS分析
图5为DOM与Cu(Ⅱ)反应后的2D-COS谱图。在同步谱图(图5(a))中,沿对角线方向在发射波长、激发波长分别为284、332.5 nm处发现2个主峰,前者强度大于后者,表明蛋白质类物质可能比富里酸类物质更容易受Cu(Ⅱ)浓度的影响。相比之下,在异步谱图(图5(b))中,对角线上方有一个明显的负面区域。区域交叉峰值位于发射波长、激发波长分别为278、328.5 nm处。基于Noda规则,荧光猝灭顺序依次为328.5、278 nm,表明随着Cu(Ⅱ)浓度的增加,DOM猝灭可能优先按富里酸类物质、蛋白质类物质的顺序发生。

(a)同步图谱

(b)异步图谱图5 溶解性有机物(DOM)与Cu(Ⅱ)反应的二维相关光谱
3 结论
本文中采用荧光光谱耦合化学计量学的手段研究了DOM与重金属离子的相互作用机制。3D-EEM表明,DOM中的蛋白质类、腐殖酸类、富里酸类物质均与Cu(Ⅱ)具有结合的能力,并且蛋白质类物质猝灭最为明显。进一步分析同步荧光耦合2D-COS可以揭示,随着Cu(Ⅱ)浓度的增加,DOM猝灭的先后顺序为富里酸与腐殖酸类物质、蛋白质类浓度。
