SOX2在胰腺癌干细胞干性维持及对化疗敏感性的作用及机制研究
2020-07-13吴福道张小静
陶 洪 吴福道 张小静 胡 芳
(四川省达州市中心医院肿瘤科,达州 635000)
胰腺癌是恶性程度最高的肿瘤之一,目前临床治疗手段有限,转移快,死亡率高,对人类健康造成巨大威胁[1]。目前,早期胰腺癌患者主要采取手术治疗,预后相对较好,然而绝大部分患者发现时已是中晚期,治疗只能以放化疗为主,控制率低,复发转移率高,预后极差,此外,化疗耐药是导致胰腺癌治疗效果不理想的重要原因[2-4]。近年来,医学研究越来越精准化,越来越多的证据表明肿瘤干细胞的存在是肿瘤复发转移及耐药的主要原因,然而肿瘤干细胞在肿瘤发病中的具体机制尚未完全阐明[5,6]。因此,进一步探讨胰腺癌干细胞在干性维持及耐药性中的作用机制,对于改善中晚期患者的预后极为重要。转录因子SOX2(sex determining region Y-box2)是SOX区域Y相关的HMG(high mobility group)蛋白家族成员之一,在哺乳动物的生长发育中起重要作用[7]。研究发现SOX2是干细胞自我更新维持多项分化潜能的重要因子,在乳腺癌、肝癌以及非小细胞肺癌等肿瘤中均出现差异表达,且通过调控肿瘤细胞增殖、侵袭转移等过程促进肿瘤细胞恶性进展,在肿瘤干细胞的干性维持中亦起着关键调控作用[8-13]。本研究以上述背景为基础,以PCSC及胰腺癌细胞株PACN-1为研究对象,通过多种实验验证SOX2在胰腺癌干细胞干性维持以及化疗耐药中的作用机制。
1 材料与方法
1.1材料
1.1.1试剂 胰腺癌细胞株PACN-1(上海生命科学院细胞和生物化学研究所);碱性成纤维细胞生长因子、表皮生长因子均购自(美国Gibco公司);MTT增殖检测、细胞凋亡检测试剂盒(南京凯基生物技术有限公司);RIPA组织裂解液(北京索莱宝科技有限公司);蛋白浓度检测试剂BCA液(美国Thermo公司);Sh-SOX2 慢病毒(上海吉凯基因公司);SOX2引物(广州锐博生物科技有限公司);兔抗人SOX2抗体(ab97959)、兔抗人Oct4抗体(ab181557)、兔抗人Nanog抗体(ab109250)、cyclinD1(ab16663)、兔抗人Caspase-3抗体(ab32351)、兔抗人Caspase-9抗体(ab32539)(abcam公司);鼠抗人GAPDH抗体(60004-1-Ig,proteintech公司);吉西他滨(江苏倍达医药科技有限公司)。
1.1.2仪器 倒置显微镜(日本Olympus公司);流式细胞仪(美国BD 公司);高速离心机(德国Beckman公司);恒温摇床(上海世平实验设备有限公司);凝胶电泳仪(美国Bio-Rad公司);酶标仪(美国Thermo公司)。
1.2方法
1.2.1PACN-1细胞分离和PCSC的培养 将液氮中取出的PACN-1置于37℃恒温水浴锅内,使细胞快速复温,待完全溶解后800 r/min离心3 min,弃上清,取1 ml含10%FBS的DMEM培养基重悬后移至25 cm的小瓶中培养,以上操作均在超净工作台内完成,待细胞长满后转移至无血清培养基中培养(含有表皮生长因子和碱性成纤维细胞生长因子)。显微镜下观察发现,2周左右时悬浮细胞肿瘤球开始形成,流式细胞仪分选CD133+的PCSC,无血清培养基中扩大培养。
1.2.2Sh-SOX2病毒转染及稳转株筛选 取对数生长期的PCSC细胞接种至6孔板中,将包装质粒以及目的质粒转入293T中,48 h后收集病毒,按说明书将慢病毒转染试剂polybrene与Sh-SOX2、Sh-NC转染至细胞中,37℃细胞培养箱中培养。8 h后更换新的培养基继续培养。2 μg/ml嘌呤霉素筛选出成功敲除SOX2的细胞株,扩大培养。此外,Rescue组先转染Sh-SOX2,并构建稳转株后,再转入SOX2过表达质粒(PcDNA3.1-SOX2)作为Rescue组。
1.2.3MTT检测细胞增殖能力 取Sh-SOX2慢病毒转染48 h后的各组细胞,0.25%胰酶消化后制成单细胞悬液,玻璃板计数后接种于96孔板(3000个/孔),每个转染组细胞设6个复孔,放至37℃细胞培养箱中培养,分别在铺板后第0、1、2、3、4、5天测定570 nm波长处各组细胞的吸光度 (OD值)。150 μl培养基中加入20 μl MTT工作液,培养箱中孵育6 h后待活细胞与MTT试剂完全结合后弃上清,DMSO溶解紫色结晶,测定OD值,重复3次。
1.2.4软琼脂克隆形成实验检测肿瘤细胞干性 取对数生长期的PCSC细胞,0.25%胰酶消化后离心,重悬,制成单细胞悬液。5%的琼脂糖高温灭菌后42℃水浴,加入9倍体积完全培养基混匀,使琼脂糖终浓度为0.5%,取0.8 ml上述液体浇注至24孔板,室温凝固。同时取0.6 ml 50℃的5%琼脂糖加入9.4 ml 500个细胞的培养基中,迅速混匀,取0.8 ml铺至底层凝脂,室温凝固后放置细胞培养箱中培养,每组设置2个复孔,在显微镜下观察并拍照,细胞培养箱培养14~16 d。
1.2.5流式细胞仪检测细胞凋亡 用无EDTA的胰酶消化转染SOX2沉默慢病毒载体72 h后的各组细胞,PBS洗3次后,收集转染组细胞,按照说明书分别加入Binding Buffer、7-ADD以及Annexin V-APC染液,混匀后室温避光孵育10~15 min。流式细胞仪检测细胞凋亡率。
1.2.6Western blot检测各组细胞CyclinD1、Caspase-3、Caspase-9蛋白的表达情况 收集各处理组(NC、Sh-SOX2及Rescue组)的PCSC细胞,加入120 μl 含有1%PMSF的RIPA细胞冰上裂解15 min后刮刀刮取细胞(超声破碎仪裂解10 min);离心(14 000 g,4℃,30 min),BCA 法测定细胞蛋白浓度,SDS-聚丙烯酰胺凝胶电泳、湿转、8%脱脂奶粉封闭3 h,一抗孵育过夜,二抗孵育2 h,TBST洗涤2次后,化学发光底物曝光条带。GAPDH 作为内参。
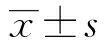
2 结果
2.1PCSC的筛选及鉴定 将PACN-1肿瘤球利用流式细胞仪筛选出CD133+细胞,并将CD133+细胞继续培养后收集足量细胞提取蛋白,结果显示CD133+细胞中干性相关基因Oct4、Nanog的表达显著高于CD133-细胞中的表达,表明筛选成功。此外SOX2蛋白在CD133+的细胞中的表达显著升高,见图1,提示CD133+细胞为PCSC细胞。
2.2MTT检测抑制PCSC中SOX2的表达对细胞增殖能力影响 与对照组相比,Sh-SOX2组细胞增殖能力显著降低,过表达SOX2后,增殖能力得到恢复,见图2,SOX2促进胰腺癌干细胞增殖。

图1 Western blot检测流式细胞筛选CD133+和CD133-细胞中干性相关基因(Oct4、Nanog)及SOX2蛋白的表达Fig.1 Expression of stemness related genes (Oct4,Nanog) and SOX2 protein in CD133+ and CD133- cells screened by flow cytometry detected by Western blot

图2 MTT检测SOX2对细胞增殖活性的影响Fig.2 Effect of Sox2 on cell proliferation by MTT Note: Compared with Sh-NC,*.P<0.05;compared with Sh-SOX2,#.P<0.05.

图3 软琼脂克隆实验检测SOX2表达对PCSC干性的影响Fig.3 Effect of SOX2 expression on stemness of PCSC detected by soft agar assay
2.3软琼脂克隆实验检测SOX2对PCSC干性的影响 软琼脂克隆实验显示Sh-SOX2组细胞的克隆形成能力显著降低(P<0.05),见图3。
2.4MTT检测各组对吉西他滨的耐药性 2 μg/ml吉西他滨处理48 h后,检测并统计各组细胞的IC50值,结果提示,与对照组相比,Sh-SOX2组细胞的IC50值明显降低,与Sh-SOX2组相比,Rescue组细胞的IC50值部分恢复(P<0.05),见图4。
2.5流式检测吉西他滨干预后各组细胞的凋亡比
例 2 μg/ml吉西他滨处理48 h后,流式细胞仪检测各组细胞的凋亡率,结果提示,与对照组相比,Sh-SOX2组细胞的凋亡率明显升高,与Sh-SOX2组相比,Rescue组细胞的凋亡率明显降低,见图5。

图4 MTT法检测SOX2对吉西他滨IC50值Fig.4 Detection of IC50 value of SOX2 to gemcitabine by MTTNote: Compared with Sh-NC,*.P<0.05.

图5 流式细胞术检测细胞凋亡Fig.5 Apoptosis was detected by flow cytometry

图6 Western blot检测各处理组Caspase-3及Caspase-9蛋白的表达水平Fig.6 Western blot was used to detect expression level of Caspase-3 and Caspase-9 in each treatment group
2.6Western blot检测SOX2对CSC凋亡蛋白Caspase-3、Caspase-9表达的影响 与对照组相比,Sh-SOX2组Caspase-3及Caspase-9表达水平显著升高,Rescue组较Sh-SOX2组Caspase-3及Caspase-9表达水平显著降低(P<0.05),见图6。
3 讨论
胰腺癌是死亡率最高的恶性肿瘤之一,患者5年生存率仅约8%,胰腺导管腺癌是其最常见的类型,且早期诊断率低、恶性程度高、易发生放化疗抵抗[14]。研究发现,吉西他滨耐药是导致胰腺癌化疗失败的主要原因。因此,进一步阐明胰腺癌患者吉西他滨耐药机制对于提高中晚期患者疗效,改善患者预后至关重要。干细胞是机体中存在的一群具有自我更新及多项分化潜能的细胞。近年来,多项研究提示肿瘤干细胞的存在是导致肿瘤复发及转移的主要原因,且与化疗耐药密切相关。有研究发现胰腺癌中也存在肿瘤干细胞,但其在胰腺癌中的作用机制尚未完全阐明。肿瘤干细胞的存在是导致肿瘤无法根治的主要原因[15,16]。因此,寻找肿瘤干细胞致癌及化疗耐药的具体机制将为肿瘤治疗提供新的策略。
SOX2是机体重要的转录因子,属于SOX基因家族的一员,在机体的生长发育、神经发育及血细胞形成等过程中均起重要作用[17]。研究发现SOX2是一个肿瘤细胞干性相关基因,在肿瘤细胞增殖以及侵袭转移中发挥重要调节作用。Yao等[18]发现SOX2可促进三阴乳腺癌的增殖及侵袭转移;Wei等[19]发现SOX2可通过调控PI3K/AKT通路促进胆管癌细胞的增殖及侵袭转移。研究发现SOX2与肝细胞癌干细胞干性相关,且与胃癌干细胞增殖相关[20,21]。SOX2可通过调控细胞周期相关蛋白CyclinD1、cmyc等加快细胞周期,可通过抑制凋亡相关蛋白的表达抑制细胞凋亡[22]。Caspase-3与Caspase-9为含半胱氨酸天冬氨酸蛋白水解酶家族成员[23]。因此,本研究假设在胰腺癌中,SOX2可能与胰腺癌干细胞干性及吉西他滨化疗耐药相关,且该功能的实现是通过调控细胞凋亡相关蛋白实现的。本研究通过悬浮肿瘤球形成实验从人胰腺癌细胞系PACN-1中分离出CD133+的PCSC,采用Western blot技术、软琼脂克隆实验、慢病毒沉默技术、MTT实验、流式细胞凋亡检测技术等来证明设想。结果提示:SOX2与胰腺癌干细胞干性维持以及吉西他滨化疗耐药显著相关。且SOX2通过调控Caspase-3及Caspase-9蛋白进而调控细胞凋亡、介导胰腺癌细胞吉西他滨耐药。
综上所述,SOX2在CD133+的胰腺癌干细胞中显著高表达,抑制其表达可以显著降低胰腺癌细胞干性,降低其对吉西他滨的耐药性,机制可能是通过作用于凋亡相关蛋白Caspase-3、Caspase-9的表达。本研究为治疗胰腺癌提供新的策略,SOX2可能成为胰腺癌治疗的潜在靶点。
