中药复方肠复康胶囊通过VEGF/VEGFR2信号通路干预结肠癌血管生成实验研究
2020-07-13孙名扬
夏 雨 李 涛 孙名扬
(北京大学人民医院,北京 100000)
结肠癌(colorectal carcinoma,CRC)是发病率、转移率、致死率较高的消化道恶性肿瘤之一[1]。近年来,随着人们生活习惯和饮食结构的改变,CRC的发病率逐年上升[2],由于CRC治疗的高额费用,以及预后癌细胞的高转移性,严重影响患者的生活质量[3]。研究表明,肿瘤血管新生与肿瘤的发生、发展以及肿瘤的侵袭转移关系密切[4,5],新生血管为肿瘤细胞提供营养支持和场所维系,是肿瘤细胞发生侵袭转移中不可或缺的环节[6]。肿瘤血管新生已成为药物治疗肿瘤的靶向位点。血管内皮生长因子(vascular endothelial growth factor,VEGF)是在生物形态学具有高度特异性的促血管内皮细胞生长的蛋白质分子,血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR2)则是在肿瘤血管内皮表面与VEGF特异性结合的高亲和力受体。VEGF/VEGFR2是调控肿瘤血管生成的关键信号通路[7]。肠复康(cerebiogen,CBG)胶囊是喜树果、薏苡仁、莪术、鸦胆、人参等5味中药组成的复方制剂,研究表明CBG在临床上治疗大肠癌疗效确切,但机制尚不清楚[8]。本研究通过体外和体内实验,探讨CBG对CRC肿瘤血管生成中VEGF/VEGFR2信号通路的作用机制,为日后的临床研究提供实验基础。
1 材料与方法
1.1材料
1.1.1实验细胞和动物 高分化性的人结肠癌HT29细胞系、人体脐静脉内皮HUVECs细胞来源于中科院细胞所。4~5周无特定病原体(specific pathogen free,SPF)级雄性BALB/c裸小鼠48只,体质量20~22 g,由北京大学实验动物中心提供(许可证号2019-0005A);室温下标准饲料、自由饮水、分笼(4笼)适应性饲养1周后用于试验,动物的使用及操作按照本院动物管理委员会的规定执行。
1.1.2实验材料 CBG胶囊(成都中医药大学附属医院药厂生产);DAB试剂盒(美国Amresco公司);Western blot试剂盒(Santa Cruz公司);ELISA试剂盒(美国CST公司);胎牛血清(fetal bovine serum,FBS)、胰蛋白酶、RPMI1640培养基、青霉素(penicillin,peillin G)和链霉素(streptomycin,STC)(美国Gibco公司);兔抗人VEGF/VEGFR2、辣根过氧化物标记的羊抗兔IgG(Abcam公司);MTT试剂盒(美国Sigma公司)。
1.1.3主要仪器 倒置显微镜(Thermofisher),E-Gel Imager凝胶成像仪(美国Beckma公司),生物显微镜(德国徕卡公司),Multiskan MK3酶标仪(美国Fermentas公司)。
1.2方法
1.2.1体外实验
1.2.1.1细胞培养与体外实验分组 从液氮中分别取出人结肠癌HT29和HUVECs细胞,37℃水浴溶解,加入含10%FBS、100 U/ml peillin G、100 μg/ml STC的RPIM1640培养基中,离心去上清,加入细胞培养液悬浮细胞,接种于培养瓶中,37℃,5%CO2培养,融合度达80%,采用0.25%的胰蛋白酶消化,采用完全培养基传代。取对数生长期细胞用于试验。将CBG溶解在标准PBS溶液里配置不同浓度的CBG溶液,用其处理人结肠癌HT29细胞并分为4组:对照组(细胞正常培养,添加标准PBS溶液)、CBG低剂量组(0.4 mmol/L)、CBG中剂量组(0.8 mmol/L)、CBG高剂量组(1.6 mmol/L)。
1.2.1.2显微镜下观察各组HT29细胞形态变化 调整各组细胞浓度至1×104个/ml,接种于6孔板,37℃,5%CO2生化培养箱中继续培养24 h后,置于生物显微镜下观察细胞形态的改变。
1.2.1.3MTT法检测细胞增殖能力 调整各组细胞浓度至3×104个/ml接种于96孔板中,37℃,5%CO2培养4 h,每孔加入MTT试剂10 μl,37℃孵育4 h,完全显色后,用酶标仪在490 nm处检测吸光值A值,细胞增殖率=(A阴性对照孔-A实验孔)/A阴性对照孔×100%。
1.2.1.4Transwell小室实验 实验前12 h将培养基更换为无血清培养基,将40 μl Matrigel基质胶铺于Transwell小室中,消化细胞并用1 μl PBS清洗 2遍,将500 μl 无血清培养基加入24孔板,取5×105个细胞重悬,向Transwell小室中加200~250 μl 细胞悬液,保证下层完全培养基与Transwell小室间无气泡。置于培养箱内正常培养 24 h,加用甲醇配制、PBS 稀释的0.1%结晶紫染液500 μl进行染色,室温避光 15 min,PBS 漂洗后用棉棒擦Transwell小室内部,倒置晾干,置于倒置荧光显微镜下观察穿过膜的细胞并拍照计数。
1.2.1.5小管形成实验检测各组HT29细胞的血管生成能力 将新鲜Matrigel溶胶平铺于96孔培养板上,然后迅速转移进37℃无菌培养箱,待Matrigel溶胶凝固后,将HUMCEs细胞以1×104个/ml接种于96孔板中,分组同1.2.1.1,分别加入含HT29细胞的培养上清液,继续培养48 h,倒置光学显微镜下观察HUMCEs的血管生成情况并拍照记录。
1.2.1.6ELISA检测各组HT29细胞VEGF、VEGFR2的表达 调整细胞浓度至1×104个/ml接种于24孔板中,分组同1.2.1.1,37℃,5%CO2生化培养箱中继续培养24 h,ELISA试剂盒检测各组细胞中VEGF和 VEGFR2的水平;每个样本独立重复测量3次。
1.2.2小鼠体内实验
1.2.2.1裸鼠人结肠癌移植瘤模型 调整对数期HT29细胞浓度,制成1×107个/ml的细胞悬液。将健康BALB/c裸小鼠用碘酒、75%酒精消毒皮肤后,皮下注射2 ml细胞悬液到小鼠前肢腋下。注射后按压数秒,3 d后,肉眼能观察到米粒样移植瘤证明模型构建成功。
1.2.2.2实验分组 造模成功后,将48只实验小鼠随机分为4组,每组12只:CBG低剂量组、CBG中剂量组和CBG高剂量组分别灌胃4.5、9、18 g/kg的CBG,灌胃剂量0.3 ml,模型组灌胃等量生理盐水,1次/d,所有小鼠均标准饲养。
1.2.2.3观察裸鼠移植瘤 实验28 d后,将各组小鼠脱颈椎处死,无菌解剖并剥离出完整肿瘤组织。称量肿瘤质量,并比较各组小鼠的瘤体平均质量。
1.2.2.4各组小鼠肿瘤组织血管密度(microvessel density,MVD)测定 将50%肿瘤组织分别用10%的多聚甲醛固定,石蜡包埋并切片,用二甲苯和梯度乙醇脱蜡后置于柠檬酸盐缓冲液中进行修复,以充分暴露抗原决定簇。然后用3%的双氧水浸泡,室温下孵育10 min,封闭,PBS冲洗3次,分别加稀释好的CD34蛋白4℃过夜孵育,次日冲洗干净,分别加入适量生物素标记的二抗室温孵育30 min,清洗。加适量DAB显色剂显色,作用2~5 min,在显微镜下观察到棕黄色颗粒后,用去离子水终止反应(注:DAB显色剂须现用现配,避光保存)。苏木素轻度复染2 min,清洗后于乙醇梯度脱水,二甲苯浸泡并干燥后用中性树胶封片,镜检观察并记录实验结果;用图像分析系统分析图像并计算微血管均数。
1.2.2.5蛋白免疫印迹Western blot法检测各组小鼠肿瘤组织中VEGF、VEGFR2蛋白的表达 按照常规提取目标蛋白样品,使用BCA定量法检测蛋白浓度,稀释样品,将待测样品和Loading buffer混合,200 r/min轻微晃动以保证均匀混合,100℃沸水煮2 min,使蛋白质变性,然后加入到制备好的SDS-PAGE凝胶(5%浓缩胶,10%分离胶)上样孔中,每孔25 μl,电泳条件:电泳开始时电压50 V 约15 min,分离胶100 V约2 h。结束后取出凝胶,4℃转膜1.5 h,采用5%脱脂奶粉封闭PVDF膜2 h,加入一抗,4℃过夜,TBST洗膜后加入辣根过氧化物标记的羊抗兔IgG,37℃孵育2 h。加入ECL显影,采用自动凝胶成像系统采集图像,以GAPDH作为内参,分析蛋白水平。
1.3统计学分析 数据统计采用SPSS16.0软件,作图工具采用Graphpad5.01,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1各组HT29细胞形态学变化 如图1示,溶剂对照组中HT29细胞贴壁细胞数量较多,生长旺盛,形状规整,排列均一,细胞核质间隙清楚,细胞内容物均匀透明,细胞多成团状生长,具有人结肠癌细胞HT29细胞的正常形态,培养液澄清;与溶剂对照组相比,CBG低、中、高剂量组细胞生长缓慢,视野内贴壁细胞数目明显减少,细胞贴壁不牢固,细胞形态不完整,培养液中有较多漂浮的死细胞,并且随CBG浓度的增加漂浮细胞数量明显增加,细胞胞体皱缩严重,核浓缩明显。
2.2CBG抑制HT29细胞的增殖 MTT检测结果如图2所示,与对照组比较,CBG低剂量组HT29细胞的增殖明显受到抑制;与CBG低剂量组相比,CBG中剂量组HT29细胞增殖的抑制作用明显增强;与CBG中剂量组比较,CBG高剂量组的HT29细胞增殖的抑制作用明显增强,差异有统计学意义(P<0.05),说明CBG抑制结肠癌HT29细胞的增殖随其剂量的增大而增强。
2.3CBG抑制HT29细胞的侵袭 Transwell小室
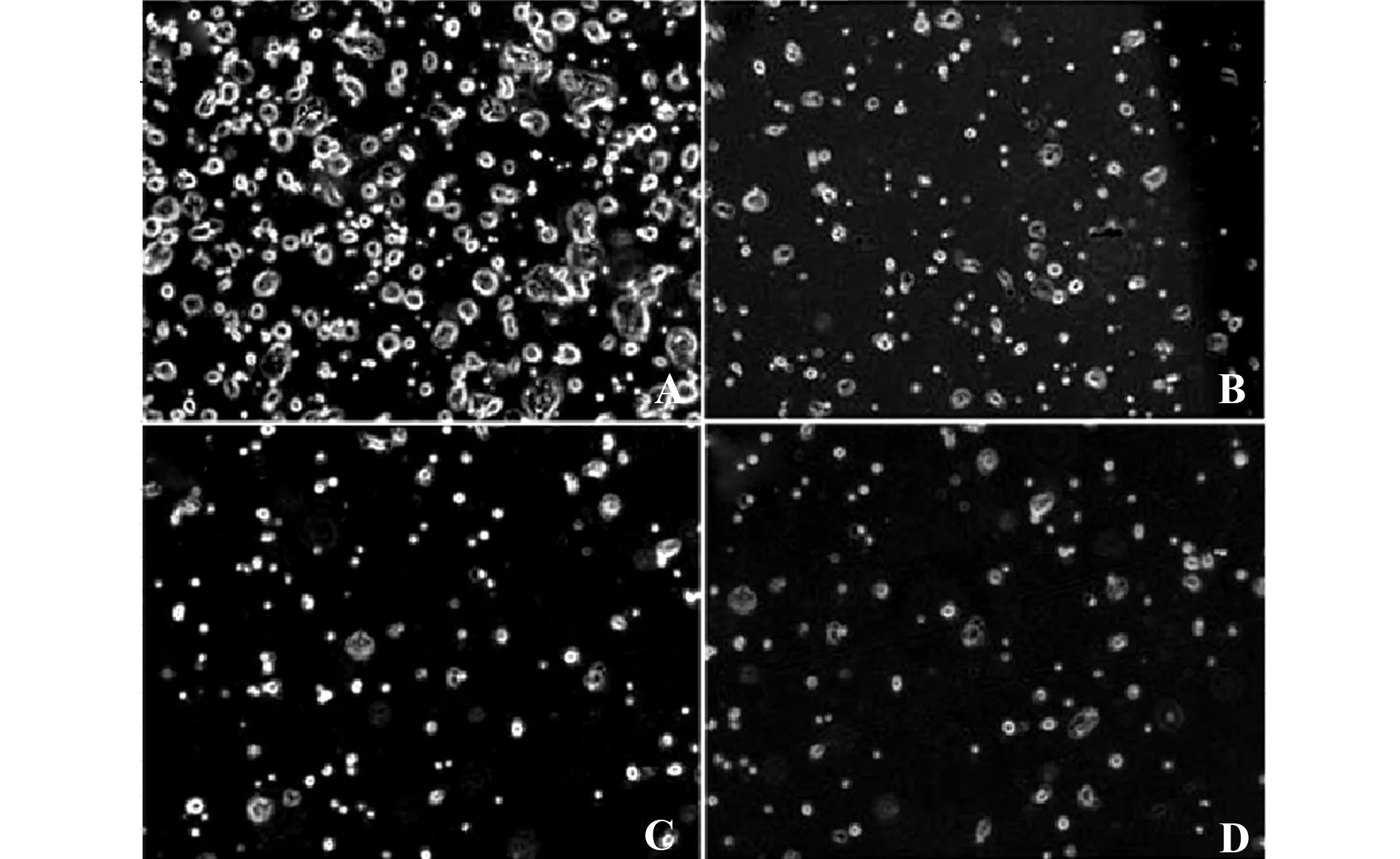
图1 显微镜观察HT29细胞形态学变化(SP,×400)Fig.1 Morphological changes of HT29 cells (SP,×400)Note: A.Control group;B.CBG low-dose group;C.CBG middle-dose group;D.CBG high-dose group.
检测结果如图3所示,与对照组比较,CBG低剂量组HT29细胞的侵袭能力明显受到抑制;与CBG低剂量组相比,CBG中剂量组HT29细胞侵袭能力的抑制作用明显增强;与CBG中剂量组比较,CBG高剂量组的HT29细胞侵袭能力的抑制作用明显增强,差异有统计学意义(P<0.05),说明CBG抑制结肠癌HT29细胞的侵袭随其剂量的增大而增强。
2.4小管形成实验检测各组HT29细胞的血管生成能力 小管形成实验结果如图4所示,与对照组比较,CBG低剂量组中HUVECs细胞生成管状结构数量明显下降;与CBG低剂量组相比,CBG中剂量组HUVECs细胞生成管状结构数量明显下降;与CBG中剂量组比较,CBG高剂量组HUVECs细胞生成管状结构数量明显下降,差异均具有统计学意义(P<0.05)。
2.5各组HT29细胞VEGF、VEGFR2的表达 ELISA检测结果如图5所示,与对照组相比,CBG低、中、高剂量组细胞中VEGF、VEGFR2的表达明显下降,差异均有统计学意义(P<0.05)。

图2 CBG抑制HT29细胞的增殖Fig.2 CBG inhibits proliferation of HT29 cellsNote: A.Control group;B.CBG low-dose group;C.CBG middle-dose group;D.CBG high-dose group.Compared with A,*.P<0.05;compared with B,#.P<0.05;compared with C,△.P<0.05.
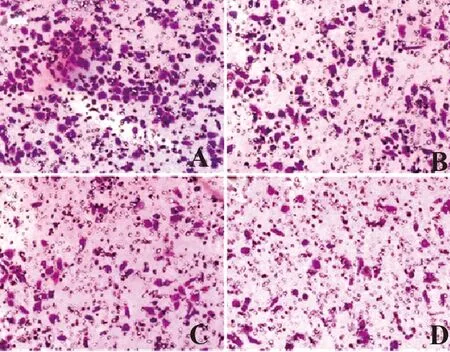

图3 CBG对HT29细胞的侵袭能力的影响(×200)
Fig.3 Effect of CBG on invasion ability of HT29 cells(×200)
Note: A.Control group;B.CBG low-dose group;C.CBG middle-dose group;D.CBG high-dose group.Compared with A,*.P<0.05;compared with B,#.P<0.05; compared with C,△.P<0.05.
2.6各组小鼠成瘤瘤体平均质量比较 各组小鼠成瘤瘤体图片如图6所示,模型组小鼠肿瘤平均质量最大,而CBG低、中、高剂量组小鼠肿瘤平均质量均明显低于模型组(P<0.05),如图7所示。
2.7各组小鼠肿瘤MVD比较 各组小鼠肿瘤组织MVD免疫组化如图8示,MVD比较如图9所示,与模型组相比,CBG组小鼠肿瘤组织MVD明显减少,差异均具有统计学意义(P<0.05),并且随CBG剂量的增加,MVD减少明显有剂量依赖性(P<0.05)。


图4 小管生成实验检测HT29细胞的血管生成能力
Fig.4 Tubulogenesis test to detect angiogenesis ability of HT29 cells
Note: A.Control group;B.CBG low-dose group;C.CBG middle-dose group;D.CBG high-dose group.Compared with A,*.P<0.05;compared with B,#.P<0.05;compared with C,△.P<0.05.

图5 ELISA检测VEGF、VEGFR2的表达Fig.5 ELISA detected expression of VEGF and VEGFR2Note: A.Control group;B.CBG low-dose group;C.CBG middle-dose group;D.CBG high-dose group.Compared with A,*.P<0.05;compared with B,#.P<0.05;compared with C,△.P<0.05.

图6 各组小鼠瘤体图片(28 d)Fig.6 Tumor picture of mice in each group(28 d)Note: A.Model group;B.CBG low-dose group;C.CBG middle-dose group;D.CBG high-dose group.

图7 各组小鼠瘤体平均质量比较Fig.7 Comparison of average tumor mass of mice in each groupNote: A.Model group;B.CBG low-dose group;C.CBG middle-dose group;D.CBG high-dose group.Compared with A,*.P<0.05;compared with B,#.P<0.05;compared with C,△.P<0.05.
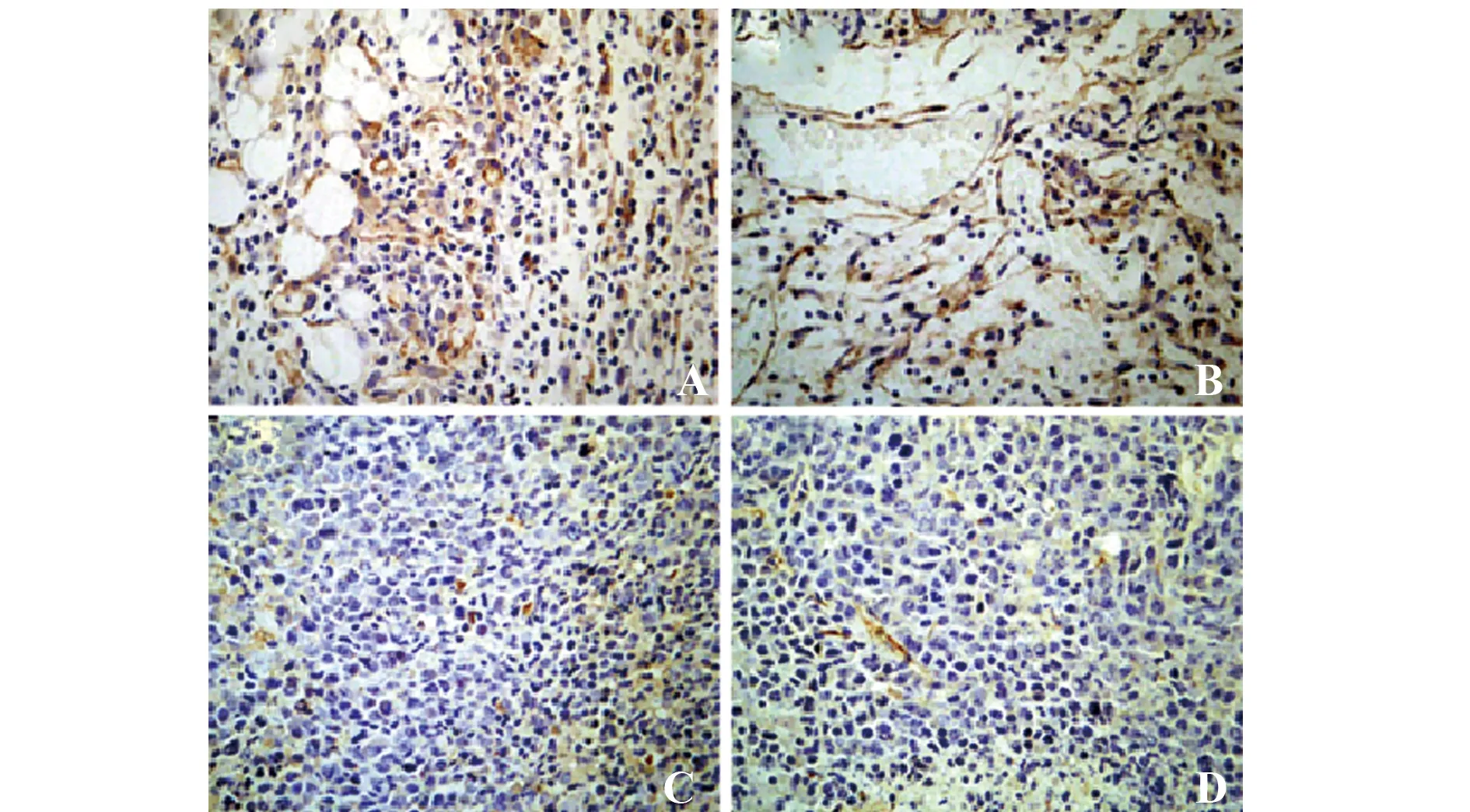
图8 各组小鼠肿瘤组织MVD(免疫组化,SP×400)Fig.8 MVD of tumor in each group(Immunohisto-chemistry,SP×400)Note: A.Model group;B.CBG low-dose group;C.CBG middle-dose group;D.CBG high-dose group.
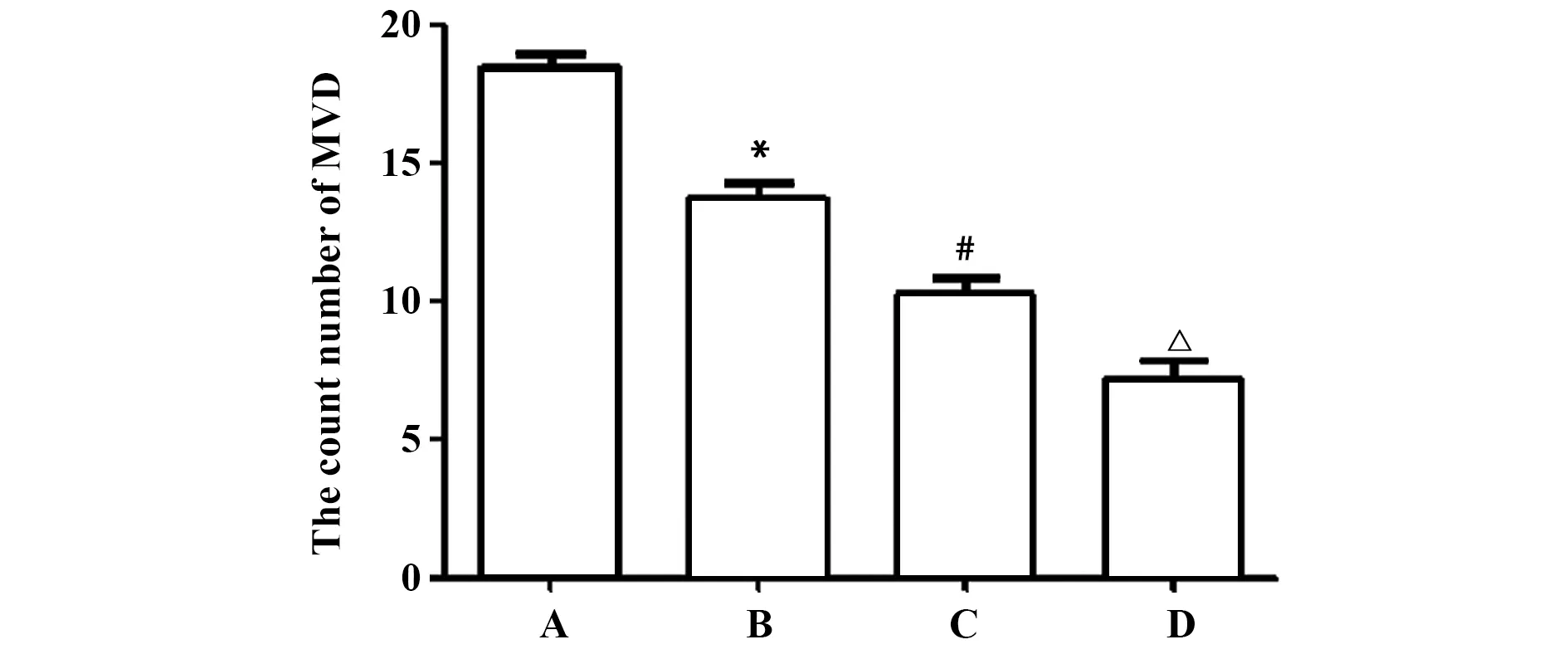
图9 各组小鼠MVD比较Fig.9 Comparison of MVD in each groupNote: A.Model group;B.CBG low-dose group;C.CBG middle-dose group;D.CBG high-dose group.Compared with A,*.P<0.05;compared with B,#.P<0.05;compared with C,△.P<0.05.

图10 Western blot法检测VEGF、VEGFR2蛋白的表达Fig.10 Western blot detection of expression of VEGF and VEGFR2 proteinNote: A.Model group;B.CBG low-dose group;C.CBG middle-dose group;D.CBG high-dose group.Compared with A,*.P<0.05;compared with B,#.P<0.05;compared with C,△.P<0.05.
2.8Western blot法检测各组小鼠肿瘤组织中VEGF、VEGFR2蛋白的表达 蛋白免疫印迹检测VEGF、VEGFR2蛋白表达,结果如图10所示:与模型组相比,CBG低、中、高剂量组小鼠肿瘤组织中VEGF、VEGFR2蛋白的表达水平明显降低,差异均具有统计学意义(P<0.05)。
3 讨论
目前,CRC的主要治疗方法是手术、放疗和化疗[9],但因上述方法具有潜在危害,以及CRC的高转移性,致使CRC患者5年生存率比较低[10]。如何从根本上阻止癌细胞的生长,抑制肿瘤细胞的侵袭转移是目前肿瘤治疗中的研究热点[11]。研究表明肿瘤血管的新生直接影响肿瘤的生长、增殖、侵袭和转移[12]。因此寻找安全、高效的药物抑制肿瘤血管的新生,在抗CRC治疗中意义重大。
CBG在临床上用来治疗大肠癌效果明显,但是其具体作用机制尚未完全明确[13]。有报道称CBG能调控VEGF、MMP-2的表达,影响人结肠癌LoVo细胞裸鼠移植瘤血管的生成[14]。因此,本研究基于肿瘤细胞血管生成的角度,设计体外和体内实验来研究CBG对高分化、高侵袭性结肠癌细胞HT29的作用机制。
首先用不同浓度CBG处理HT29,显微镜下发现HT29细胞随CBG浓度的变化发生不同程度的改变;MTT实验结果发现CBG能明显抑制HT29的增殖;而体外小管生成实验结果表明HUVECs细胞生成管状结构数量随CBG浓度的增加而明显下降(P<0.05);说明CBG能够体外抑制HT29增殖,抑制肿瘤新生血管生成,这种抑制作用可能与VEGF/VEGFR2信号通路有关。为进一步研究CBG对CRC肿瘤中血管生成的作用,本研究中构建小鼠人结肠癌HT29细胞裸鼠移植瘤模型,实验中设立模型组和Sham组,同时以不同剂量CBG灌服实验小鼠,治疗28 d后,处死小鼠。取出小鼠肿瘤组织,发现模型组中瘤体质量最大,而CBG高剂量组瘤体质量最小 (P<0.05)。肿瘤的MVD可以直观反映肿瘤血管的生成,CD31、CD34是鉴定MVD的重要标志蛋白。本研究中以CD34为标记,进行免疫组化,与模型组相比,CBG组小鼠肿瘤组织MVD明显减少,差异均具有统计学意义(P<0.05),并且随CBG剂量的增加,MVD减少有明显剂量依赖性。说明CBG可抑制CRC裸鼠的血管生成。
肿瘤血管的生成是一个多种生化因子参与、步骤复杂的生化过程[15]。在正常生理状态下,机体内的VEGF和VEGFR2处于相对平衡的状态,血管基本不生长[16];但是在肿瘤组织中,由于微环境的改变,肿瘤细胞内VEGF大量表达,从而开启“血管生成开关”,VEGFR2则是在血管内皮中直接参与肿瘤血管的生成[17,18]。本研究中体外ELISA检测结果表明,与A组相比,B、C、D组细胞中VEGF、VEGFR2的表达明显下降 (P<0.05);这与小管生成实验中新生管状结构的数量变化一致。而Western blot实验结果表明,与模型组相比,CBG低、中、高剂量组小鼠肿瘤组织中VEGF、VEGFR2蛋白的表达水平明显降低,差异均具有统计学意义(P<0.05);这一变化趋势与MVD变化趋势一致。说明CBG能通过调控VEGF、VEGFR2蛋白的表达来影响肿瘤新生血管的生成。
本研究证明中药复方肠复康可抑制HT29细胞增殖,抑制HT29细胞体外生成血管的能力,并且抑制人结肠癌HT29细胞裸鼠移植瘤模型中肿瘤血管的新生,其中的作用机制可能与VEGF/VEGFR2信号通路有关,但是如何将中药复方肠复康应用于人结肠癌的靶向治疗,还有待进一步的深入研究。
