ICAM-1参与系统性红斑狼疮中免疫球蛋白产生的实验研究①
2020-07-13李玉梅刘芝翠王树军张美玉
李玉梅 刘 帅 刘芝翠 王树军 季 萍 潘 萌 张美玉④ 王 颖
(上海交通大学医学院附属第九人民医院输血科,上海 201999)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是以多器官为靶点的自身免疫性疾病,主要病理特征是免疫系统功能紊乱,产生多种自身抗体并形成免疫复合物沉积于多个组织和器官,对机体造成病理性损伤[1]。在SLE复杂的致病过程中,活化的CD4+T细胞与B细胞的相互作用模式对B细胞的异常活化发挥重要作用。
ICAM-1又称CD54,是介导黏附的重要分子,通过与相应受体特异性结合,增强免疫细胞间、细胞与基质间的黏附作用,在T细胞活化早期,通过与抗原递呈细胞(APC)表面配体分子结合,介导细胞间的非特异性黏附,从而为T细胞表面TCR受体与APC细胞表面MHC-抗原肽的相互识别提供前期准备[2,3]。ICAM-1在肿瘤恶化、转移及调节机体免疫反应中起重要作用[4]。作为重要的黏附分子,ICAM-1在SLE中的表达水平如何,是否参与B细胞的异常激活和抗体产生值得深入研究。
本研究拟分析ICAM-1在SLE患者和SLE小鼠病理模型中的表达水平,初步探讨其对IgG/IgM产生的影响。
1 材料与方法
1.1材料
1.1.1研究对象 血清学检测的45例SLE患者来自于上海交通大学医学院附属瑞金医院,诊断均符合1997年美国风湿病协会(ACR)修订的SLE诊断标准,其中女性44例,男性1例,平均年龄(37.42±16.6)岁。收集SLE患者的临床资料及实验室检查数据,并根据SLEDAI评分标准进行评估,SLE中度活动组(≥10分)29例,轻度活动组(5~9分)12例,基本无活动性组(0~4分)4例;37例复诊患者已用药,8例初诊患者未用药。实验对照组选用我院体检中心性别和年龄匹配的健康志愿者。所有患者及健康志愿者均已知情同意。
1.1.2小鼠 6~8周龄雌性BALB/c小鼠(上海斯莱克实验动物有限公司),饲养于上海交通大学医学院实验动物科学部SPF环境,20~24℃,相对湿度50%~60%,自由饮食,光照周期为日夜各12 h。
1.1.3试剂 抗人CD3-PerCP、抗人CD8-PE、抗人ICOS-PE和抗人CD69-PE购自eBioscience公司;抗人CD8-FITC、抗人HLA-DR-APC、抗人ICAM-1-PE-Cy5、抗鼠CD3-Percp-Cy5.5、抗鼠CD4-FITC、抗鼠CD44-APC-Cy7、抗CD62L-APC、抗鼠 ICOS-PE均购自BD公司;活化用可溶性抗CD3抗体购自BD公司;IFN-α购自Cell Science公司;抗鼠ICAM-1阻断抗体和Pristane购自Thermo Fisher公司;小鼠CD4+T细胞和B细胞分选试剂盒购自STEMCELL公司;小鼠IgM和IgG检测用试剂购自上海森雄公司;RPMI1640培养液购自GIBGO公司;Fieoll-hypaque淋巴细胞分离液购自Axis公司。
1.1.4仪器 LSR Fortessa流式细胞分析仪(美国BD公司);酶标仪、生物安全柜、超低温冰箱(美国Thermo公司);高速低温离心机(德国Eppendorf公司);光学显微镜(日本Olympus公司);水平摇床(Kylin-bell公司)。
1.2方法
1.2.1样本收集 采集患者外周血3~5 ml,EDTA抗凝,1 500 r/min离心5 min,收集血浆,-80℃保存备用。在EP中加入3 ml RPMI1640 培养液,置于等体积Ficoll-hypaque淋巴细胞分离液,2 200 r/min离心20 min,收集单个核淋巴细胞(peripheral blood mononuclear cells,PBMCs)备用。
1.2.2人PBMCs细胞表型分析 在1.5 ml EP管中加入细胞,0.2 mol/管,加入3% FBS-1×PBS稀释的工作抗体,分别为抗CD3-PerCP、抗CD3-PE、抗CD8-FITC、抗ICOS-PE、抗HLA-DR-APC、抗ICAM-1-PE-Cy5和抗CD69-PE;孵育30 min,加入1 ml PBS 洗涤,离心洗涤1次后,加入200 μl的FACS buffer重悬混匀,BD LSRFortessa流式细胞分析仪检测。
1.2.3可溶性抗CD3抗体和IFN-α联合活化CD4+T细胞 将抗CD3单克隆抗体按照2 μg/ml溶解至PBS,混匀后,按照200 μl/孔加到96孔平底板中,4℃冰箱水平放置,孵育过夜。设立未刺激组和刺激组,后者加入100 ng/ml IFN-α,将纯化的CD4+T细胞(1×105个/孔)加入到已包被有抗CD3抗体的孔中;37℃、5%CO2的细胞培养箱中刺激培养24 h;流式细胞术检测CD4+T细胞表型。
1.2.4狼疮样小鼠动物模型制备 6~8周龄雌性BALB/c小鼠随机分为2组,每组6只。实验组小鼠一次性腹腔注射0.5 ml Pristane溶液,对照组小鼠一次性腹腔注射0.5 ml无菌1×PBS溶液。所有动物实验均按照上海交通大学医学院动物实验操作指南进行。6个月后处死小鼠,取脾脏。
1.2.5狼疮样小鼠模型血清中snRNR和dsDNA自身抗体检测 分别用特异性抗原U1-snRNP 68/70 kD和dsDNA包板,用1×ELISA包被液将抗原稀释至0.3 μg/ml,100 μl/孔,4℃孵育过夜。弃包被液,每孔加入300 μl洗涤液,室温放置1 min,弃洗涤液,重复洗涤3次,吸水纸拍干。每孔加入200 μl封闭液,置于水平摇床(80 r/min)室温孵育2 h。弃封闭液,每孔加入300 μl洗涤液,室温放置1 min,弃洗涤液,重复洗涤3次,将稀释好的样本加入至封闭好的96孔酶标板中,阴性对照孔为未免疫的正常小鼠血清,空白对照孔为样本稀释液,100 μl/孔,水平摇床(80 r/min)室温孵育2 h。弃样本,300 μl/孔加入洗涤液,室温放置1 min,弃洗涤液,重复洗涤3次,每孔加入100 μl辣根过氧化物酶标记的抗小鼠IgG工作液(1∶4 000),水平摇床(80 r/min)室温孵育2 h。弃酶标二抗,每孔加入300 μl洗涤液,室温放置1 min,弃洗涤液,重复洗涤7次,每孔加入100 μl 辣根过氧化酶的底物工作液,室温避光孵育15 min,每孔加入50 μl 2N的H2SO4终止液,酶标仪测定OD450值。
1.2.6小鼠脾脏CD4+T细胞表面分子检测 小鼠脾脏放入盛有PBS的培养皿(6 cm)中,研磨成单细胞悬液,1 500 r/min离心10 min。弃上清,加入5 ml 小鼠红细胞裂解液,重悬脾脏细胞置于冰内放置5 min,加入7 ml 1×PBS终止,1 500 r/min离心10 min。用10 ml 1×PBS重悬洗涤2次,计数,调节细胞浓度至2×107个/ml,将100 μl细胞悬液加入1.5 ml EP 管中,与抗鼠CD3-Percp-Cy5.5、抗鼠CD4-FITC、抗鼠CD44-APC-Cy7、抗CD62L-APC、抗鼠 ICOS-PE、抗鼠ICAM-1-APC工作液共孵育30 min,加入1 ml PBS洗涤,离心洗涤1次后,加入200 μl FACS buffer重悬混匀,Fortessa流式仪检测。
1.2.7体外CD4+T-B细胞共培养 (1)按照MACS分选试剂盒说明书分选获得小鼠CD4+T细胞和B细胞,计数,分别调整细胞浓度为1.5×106个/ml和 4.5×106个/ml。(2)分别在96孔U底板预先加入100 μl完全培养基。(3)混匀CD4+T和B细胞悬液,按照以下方案设置共培养体系。① CD4+T或B细胞对照组:每孔加入50 μl PBS或Pristane处理小鼠来源的CD4+T或B细胞悬液,完全培养基定容至200 μl,每组设置3个复孔。② CD4+T-B细胞共培养实验组:在预先加入完全培养基的孔中,按照下列组合方式分别加入50 μl细胞悬液,定容至200 μl,每组设置3个复孔。a组:PBS处理小鼠来源的CD4+T细胞和B细胞悬液。b组:Pristane处理小鼠来源的CD4+T细胞和PBS处理小鼠来源的B细胞悬液。c组:PBS处理小鼠来源的CD4+T细胞和Pristane处理小鼠来源的B细胞悬液。d组:Pristane处理小鼠来源的CD4+T和B细胞悬液。③使用排枪将每个孔中的细胞悬液混匀,周边的孔用滴管加满无菌的1×PBS溶液,用胶带将96孔 U底板放入37℃、5%CO2培养箱中培养。(4)8 d后收集培养上清,ELISA检测总IgG和IgM含量。
1.2.8小鼠IgM和IgG检测 分别用羊抗鼠IgM (H+L)和IgG (H+L)作为捕获抗体包板,用1×ELISA包被液将捕获抗体分别稀释为4 μg/ml和2 μg/ml,每孔加入100 μl,4℃孵育过夜。弃包被液,每孔加入300 μl洗涤液,室温放置1 min,弃洗涤液,重复洗涤3次,吸水纸拍干。每孔加入200 μl封闭液,水平摇床(80 r/min)室温孵育2 h。弃封闭液,每孔加入300 μl洗涤液,室温放置1 min,弃洗涤液,重复洗涤3次,将稀释好的样本加入至封闭好的96孔酶标板中,阴性对照孔为未免疫的正常小鼠血清,空白对照孔为样本稀释液,每孔加入100 μl,水平摇床(80 r/min)室温孵育2 h。弃样本溶液,每孔加入300 μl洗涤液,室温放置1 min,弃洗涤液,重复洗涤3次,每孔加入100 μl辣根过氧化物酶标记的抗小鼠IgG工作液(用样本稀释液1∶4 000稀释),置于水平摇床(80 r/min),室温孵育2 h。弃酶标二抗,每孔加入300 μl洗涤液,室温放置1 min,弃洗涤液,重复洗涤7次,每孔加入100 μl辣根过氧化酶的底物工作液,室温避光孵育15 min,每孔加入50 μl 2N的H2SO4终止液,酶标仪测定OD450。
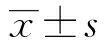
2 结果
2.1SLE患者外周CD4+T细胞表面活化分子和ICAM-1的表达显著升高 与健康者比较,SLE患者来源的CD4+T细胞表面CD69和HLA-DR的阳性表达比例明显上调(P<0.01)(图1A、C)。进一步分析细胞表面的ICOS和ICAM-1表达水平,SLE患者来源的CD4+T细胞表面协同刺激分子ICOS的阳性表达率明显增加(P<0.05),ICAM-1表达差异无统计学意义(图1B、C)。上述结果表明SLE患者体内的CD4+T细胞与健康者相比处于活化增强状态,同时辅助自体B细胞的重要辅助分子表达变化显著。
2.2抗CD3/IFN-α协同处理后,健康者外周CD4+T细胞表面活化分子和ICAM-1表达显著升高 与未刺激组相比,抗CD3/IFN-α刺激组CD4+T细胞表面CD69和HLA-DR的表达比例及MFI均显著升高(P<0.05)(图2A、C)。表面黏附分子ICAM-1的表达率及MFI显著升高(P<0.05),ICOS表达阳性率及MFI显著升高(P<0.001)(图2B、C)。上述结果表明抗CD3/IFN-α刺激CD4+T细胞后,CD4+T细胞活化状态发生变化,其表面黏附分子和协同刺激分子表达不同程度升高,升高最为显著的是黏附分子ICAM-1和协同共刺激分子ICOS。
2.3Pristane处理狼疮样小鼠中CD4+T细胞表面活化分子和ICAM-1表达水平 Pristane处理组小鼠CD4+T细胞表面CD44的表达较PBS组明显上升(P<0.05图3A),CD62L表达下降(P<0.01,图3B),表明Pristane处理组小鼠外周CD4+T细胞呈活化状态,与B细胞相互作用的共刺激分子ICOS的表达在Pristane小鼠中明显高于PBS组(P<0.01,图3C),黏附分子ICAM-1表达差异无统计学意义(P>0.05,图3D)。上述结果表明,Pristane诱导的狼疮样小鼠模型外周CD4+T细胞处于异常活化状态。

图1 健康者及SLE患者外周CD4+T细胞活化表型比较Fig.1 Comparison of activation of peripheral CD4+T cell between healthy donors and SLE patientsNote:Compared with HC,*.P<0.05,**.P<0.01,***.P<0.001.
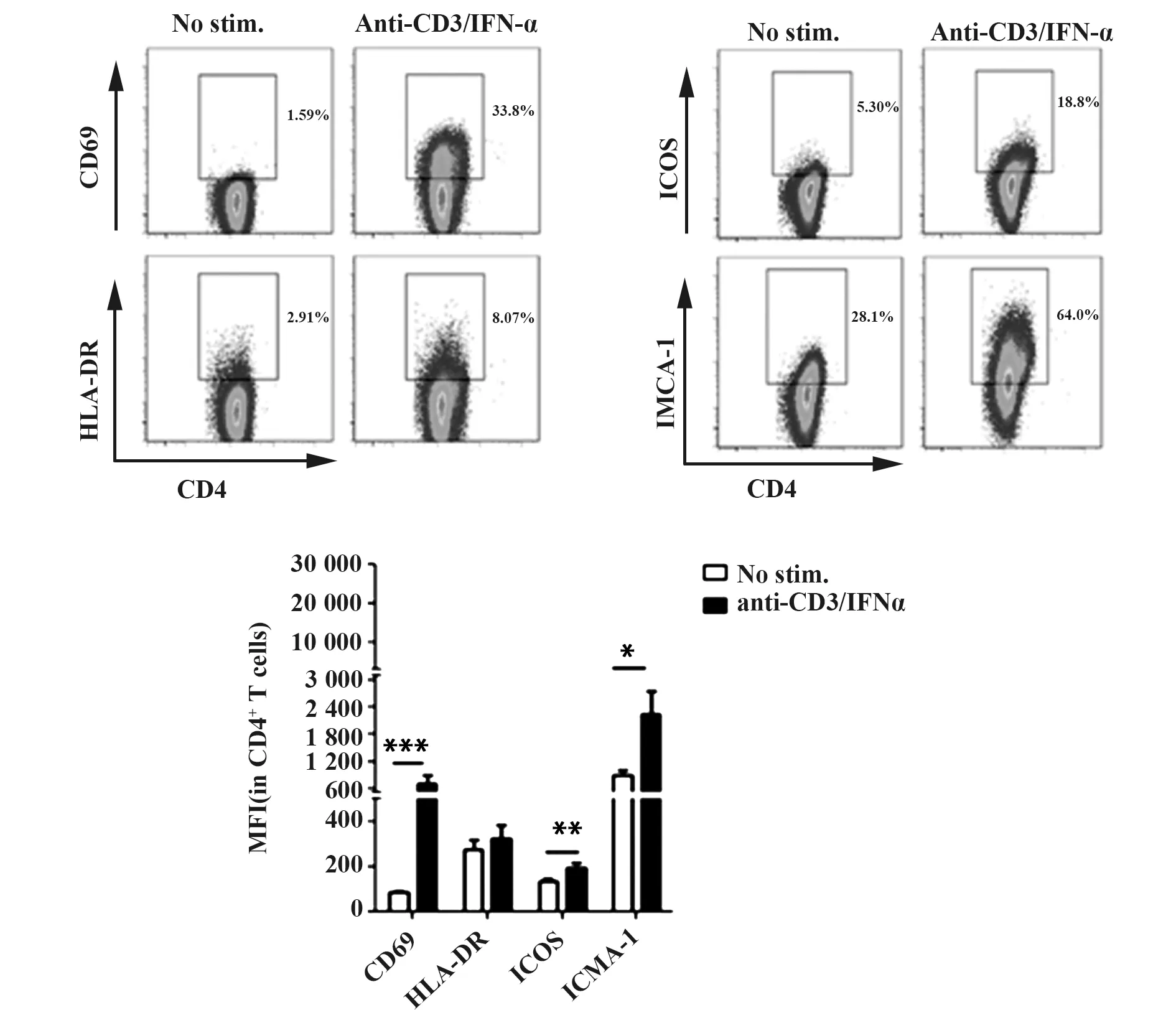
图2 Anti-CD3 Ab/IFN-α刺激健康对照组CD4+T细胞的活化表型检测Fig.2 Activation phenotype of healthy donors derived CD4+T cells stimulated by anti-CD3 Ab/IFN-αNote:Compared with No stim,*.P<0.05,**.P<0.01,***.P<0.001.
2.4Pristane处理狼疮样小鼠模型血清中自身抗体水平 第0月时,2组小鼠外周血血清免疫球蛋白和自身抗体水平差异无统计学意义;第6月时,Pristane处理组小鼠外周血血清中抗sn-RNP、抗dsDNA 抗体水平显著高于PBS对照组,表明Pristane处理后,小鼠体内逐渐产生高滴度病理性自身抗体抗sn-RNP、抗dsDNA 抗体水平在发病后期明显增高。见图4。
2.5Pristane来源CD4+T细胞与B细胞共培养可以促进B细胞产生IgM和IgG 结果显示,与a组(CT+CB)相比,b、c、 d组培养上清中总IgM和总IgG的产生水平升高,a组 图3 Pristane处理组与PBS对照组小鼠脾脏CD4+T细胞表型分析Fig.3 Phenotype analysis of spleen CD4+T cells in Pristane group and PBS groupNote:Compared with PBS,*.P<0.05,**.P<0.01. 图4 小鼠血清中抗sn-RNP、dsDNA自身抗体的含量Fig.4 Levels of anti-sn-RNP and anti-dsDNA auto-antibodies serum of miceNote:Compared with PBS,**.P<0.01,***.P<0.001. 图5 不同来源的CD4+T和B细胞共培养后培养上清中IgM和IgG水平Fig.5 IgM and IgG levels in co-culture supernatants of CD4+T and B cells from different sourcesNote:Compared with c group,**.P<0.01. 图6 阻断ICAM-1对Pristane来源的CD4+T与B细胞共培养后培养上清中总IgM和IgG水平影响Fig.6 Effect of blocking ICAM-1 on total IgM and IgG levels in co-culture supernatants of Pristane-derived CD4+T and B cellsNote:Compared with ISO,**.P<0.01,***.P<0.001. 2.6阻断ICAM-1分子对Pristane来源CD4+T细胞与B细胞共培养后的IgM和IgG水平的影响 在2组共培养体系中加入阻断抗体anti-ICAM-1 Ab后,对比加入IgG Isotype的对照组,上清中IgM含量差异无统计学意义(图6A),但IgG含量显著升高(P<0.01或P<0.001,图6B)。上述检测结果提示,活化的CD4+T细胞辅助正常或活化的B细胞产生抗体时,ICAM-1分子可促进T、B细胞相互作用,抑制IgM向IgG转换。 SLE是常见的自身免疫性疾病,其治疗目的主要是帮助机体恢复正常的免疫耐受状态,降低血清中免疫球蛋白的滴度,减轻免疫复合物在不同组织器官的沉积,改善患者的临床症状[5]。目前,SLE常用的治疗方案除了控制发病诱因外,主要采用免疫抑制剂阻止病理性自身免疫应答[6]。因此,通过探索SLE的发病机理寻找高效低毒的单克隆抗体阻断剂是目前SLE治疗研究的重要方向。 ICAM-1/LFA-1的相互作用通常被用来稳定细胞与细胞之间的连接以及促进淋巴细胞跨血管内皮迁移[7]。在浆细胞性乳腺炎中,ICAM-1介导B细胞跨乳腺导管内皮迁移,导致病变乳腺组织中浆细胞增多,加重局部炎症反应;在视网膜炎症中,ICAM-1介导B细胞跨血管内皮迁移和炎症严重程度有关;在B细胞来源的恶性淋巴瘤中,恶变的B细胞通过其表面的ICAM-1分子介导的细胞骨架重塑依赖的滚动、黏附和跨血管迁移播散到肝脏等处[8-10]。ICAM-1除参与B细胞的跨内皮迁移外,还促进生发中心B细胞活化和分化。在生发中心,ICAM-1/LFA-1的相互作用可以促进B细胞与Tfh细胞黏附,降低B细胞的活化阈值;Tfh细胞表面CD40L激活B细胞CD40信号通路,促使ICAM-1和SLAM表达上调,ICAM-1/LFA-1和SLAM/SLAM增强Tfh-GC B相互作用,促进生发中心B细胞活化,促进亮区生发中心B细胞分化为前体浆细胞、浆细胞,最终促进抗体生成[11-13]。因此,根据ICAM-1分子在不同免疫功能紊乱性疾病中发挥的作用,阻断ICAM-1可有效减轻炎症损伤,抑制淋巴瘤远处转移,减少浆细胞形成和抗体生成。 本课题组发现Pristane诱导的狼疮样小鼠模型中CD4+T细胞表面ICAM-1表达增高,因此推测SLE患者中CD4+T细胞通过ICAM-1增强与B细胞间的黏附作用,促进B细胞产生病理性抗体,导致SLE。为此,本课题组通过功能性阻断抗体anti-ICAM-1作用Pristane来源的CD4+T细胞与B细胞共培养体系发现,与同型Isotype对照组相比,ICAM-1分子被阻断后,Pristane来源的CD4+T细胞辅助PBS/Pristane来源的B细胞产生的IgM含量下降IgG含量显著升高。研究结果提示,活化的CD4+T细胞表面ICAM-1分子被阻断中和后,可抑制T-B相互作用及B细胞活化,降低抗体IgM产生;而抗体IgG水平显著升高,则提示CD4+T表面ICAM-1分子可能通过直接接触的方式抑制B细胞内IgM向IgG转换。SLE患者中CD4+T细胞表面ICAM-1表达水平增加,促进T-B细胞黏附与B细胞的活化,但抑制IgM向IgG转换。 免疫球蛋白类别转换(CSR)是发生在B细胞核内染色体上免疫球蛋白重链恒定区(C区)的删除性的基因重组[14]。通常认为免疫球蛋白类别转换和体细胞高频突变(SHM)同时发生在生发中心反应中,均由活化诱导的胞苷脱氨酶(AID)介导[15]。然而,最新研究表明免疫球蛋白类别转换主要发生在生发中心形成前早期的T-B细胞相互作用过程中,当T细胞迁移到滤泡区形成生发中心后,类别转换重组的频率迅速降低,SHM频率显著升高,即CSR和SHM的发生具有时空特异性[16]。功能紊乱的CSR会导致自身反应性BCR和B细胞源性淋巴瘤的产生。成熟的IgM-IgD B细胞在CD4+T细胞的辅助和分泌的多种细胞因子的作用下发生CSR,使IgM转换为IgA、IgG和IgE,并清除外源性抗原[17]。在生发中心形成前,CD4+T表面的CD40L通过刺激B细胞表面CD40产生信号转导,激活转录因子NF-κB转位,促进AID表达和CSR;此外,LPS激活固有免疫应答受体TLR也可以促进CSR[18]。同时,CD40信号在IL-4信号的协同作用下促进IgM转换为IgG1和IgE,在IFN-γ协同作用下转换为IgG2a,在TGF-β协同作用下转换为IgA[17,19]。 除CD40、TLRs外,跨膜活化和CAML激活因子(TACI)和B细胞活化因子(BAFF)也可以正向调控AID表达和CSR[17]。然而,这些受体信号(包括BCR信号)在诱导CSR的同时也激活PI3K-AKT信号通路。PI3K-AKT通路可以通过FOXO1、ID2和BLIMP1抑制AID表达和CSR;而PTEN蛋白通过将PI3K去磷酸化拮抗其抑制CSR的作用[17,20]。因此,PI3K-AKT信号通路和PTEN磷酸酶在免疫球蛋白类别转换的过程中,互相拮抗,共同维持CSR稳态。 在T-B细胞相互作用过程中,CD4+T细胞表面CD40L传导的CD40信号正向调控AID表达和CSR;而BCR信号复合物的活化启动了B细胞内系列的信号分子事件,包括PI3K-AKT通路的激活,抑制AID表达和CSR产生。机体通过正负反馈调控CSR共同维持免疫稳态。CD4+T细胞表面ICAM-1与B细胞相互作用可以显著降低BCR活化阈值,而与B细胞直接接触后能促进LFA-1信号通路的活化并通过Crk蛋白间接诱导启动下游PI3K信号[11,21],由此提示,ICAM-1-LFA-1在T-B细胞相互作用过程中可能通过促进PI3K-AKT通路的活化,从而抑制AID表达和CSR反应中IgM向IgG转换。 本研究发现SLE来源的CD4+T细胞一方面通过ICAM-1的介导促进与B细胞的黏附作用促进病理性抗体的产生,另一方面通过抑制早期T-B细胞相互作用下发生的免疫球蛋白IgM向IgG的类别转换影响病理性抗体的类别,而影响SLE的发生发展。总之,本研究为阐明SLE发病机理提供了细胞学和分子学层面的新见解,为自身免疫性疾病的治疗提供了新思路。



3 讨论
