长链醇类和油类物质洗涤液在磁珠法DNA和RNA共提取中的应用
2022-12-22李福刚陈华剑谢国明
王 鼎, 李福刚, 罗 旺, 陈华剑, 张 珂, 谢国明
(1.重庆医科大学检验医学院临床检验诊断学教育部重点实验室,重庆 400042;2.上海奥普生物医药股份有限公司,上海 201399)
快速、灵敏的病原体核酸检测已经成为防控公共卫生事件的重要方法。从生物样本中提取高纯度的核酸在确保核酸检测准确性中起着极其重要的作用[1]。传统的核酸提取方法需要复杂的设备,操作繁琐,耗时长,容易引起交叉污染和核酸样本损失。微流控技术具有集成化、自动化的特点,其完全密封的流体系统可避免核酸样本的交叉污染和损失[2]。因此,将微流控技术应用于核酸提取,有助于实现快速、高效、自动化的核酸检测,对于病原体感染的早期诊断和及时治疗具有巨大的临床应用价值。目前,微流控核酸提取的主要问题在于传统的70%乙醇洗涤液存在易挥发、易燃的缺点,严重制约了其在微流控领域的应用。此外,乙醇残留对后续的聚合酶链反应(polymerase chain reaction,PCR)、逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)、环介导等温扩增(loopmediated isothermal amplification,LAMP)等检测步骤,尤其是对低浓度模板的扩增有明显的抑制作用。有研究结果显示,一些无挥发性的油性物质,如硅油、FC-40、长链醇类均可作为核酸提取的洗涤液候选物,处理后的核酸回收率较高,且对后续的扩增抑制作用很小,甚至无抑制作用[3]。另外,油性物质还具有储存条件宽松和储存期较长的优点。为此,本研究拟探讨以8种长链醇类和油类物质作为洗涤液在磁珠法核酸提取中的应用价值,旨在克服微流控技术在临床应用中的局限性。
1 材料和方法
1.1 试剂和仪器
硫氰酸胍、Tris-Base、氯化钠、柠檬酸钠、乙二胺四乙酸、二甲基硅油、十一醇、正癸醇、正辛醇、1-壬醇购自国药集团化学试剂有限公司,2-十二烷醇、FC-40购自西宝生物科技(上海)股份有限公司。磁性微球购自苏州为度生物技术有限公司。北京康为世纪生物科技有限公司MagBead Virus DNA/RNA Kit和北京启研生物科技有限公司核酸提取/纯化试剂盒。PCR master mix、RT-PCR master mix由上海奥普生物医药股份有限公司研发。PCR引物序列采用肺炎支原体(Mycoplasma pneumoniae,Mp)基因:上游引物MP-F为5'-CAACATCTGGGACTGGACTGTA-3'、下游引物MP-R为5'-GCCCTATGATTTAGAGATTGCGG-3'、探针引物MP-P-FAM/BHQ为5'-CCTTCAGCCCCAAAACCATCACAGG-3'。RT-PCR所用引物序列采用呼吸道合胞病毒(respiratory syncytial virus,RSV)基因:上游引物RSV-F为5'- AACTCTGGGGCAAATAACAA-3'、下游引物RSV-R为5'-GCRTCTGTWCCATTACACTT-3'、探针引物RSV-P-ROX/BHQ为5'-GCAAAGGCTATCTTAGTGCTCT-3'。引物均由南京金斯瑞生物科技有限公司合成。PCR所用的DNA模板为含引物基因片段的质粒,由生工生物工程(上海)股份有限公司合成。RT-PCR所用的RNA模板为转录RNA,先由生工生物工程(上海)股份有限公司合成含引物匹配基因片段的质粒,在基因序列前加入T7序列,再用HiScribe T7 Quick RNA Synthesis Kit(美国NEB公司)转录出RNA,并用RNeasy Mini kit(德国Qiagen公司)纯化。Mp及培养基均购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),严格按菌株说明书进行培养。Q5荧光定量PCR仪购自美国ThermoFisher Scientific公司。
1.2 方法
1.2.1 溶液配制 (1)吸附液:3.6 mol/L硫氰酸胍,10 mmol/L Tris-Base,800 mmol/L氯化钠,200 mmol/L柠檬酸钠,pH值5.2。(2)洗脱液:10 mmol/L Tris-Base,1 mmol/L乙二胺四乙酸,pH值8.4。
1.2.2 核酸提取 取200 μL待提取的样本,加入400 μL核酸提纯吸附液,加入1.0 mg磁珠,在旋转仪上以20 r/min摇匀5 min,用磁力架吸附磁珠,吸弃管中的液体;加入800 μL洗涤液,充分混匀后,用磁力架吸附磁珠,吸弃管中的液体;加入200 μL洗脱液,充分混匀后,在旋转仪上以20 r/min摇匀解吸附5 min,用磁力架吸附磁珠,待磁珠全部被吸附后,吸出核酸提取物,作为扩增模板。
1.2.3 PCR和RT-PCR (1)反应体系:PCR reaction master mix或RT-PCR reaction master mix 5 μL,10 μmol/L引物各1 μL,10 μmol/L探针各0.5 μL,待测样本2 μL,用无核酸酶水补至总体积15 μL。(2)PCR扩增条件:95 ℃ 2 min;94 ℃ 10 s,58 ℃ 30 s,50个循环。RT-PCR在PCR扩增条件前增加60 ℃ 5 min进行逆转录。
1.2.4 模拟临床样本制备 用咽拭子在健康人咽喉部采样,在保存液中涮洗,取4 mL涮洗液加入100 μL Mp培养物,混匀,制成Mp模拟临床样本。95 ℃金属浴5 min,热裂解产物等量分装,测试不同核酸提取方法的性能,并与商品化核酸提取试剂盒进行比较。
1.2.5 不同洗涤液对核酸提取的影响 (1)以102~105拷贝/μL的DNA和RNA混合物为待提取样本,以5种长链醇类物质(十一醇、正癸醇、正辛醇、1-壬醇、2-十二烷醇)和3种油类物质(二甲基硅油、FC-40、石蜡油)为洗涤液,以70%乙醇为阳性对照,采用磁珠法进行核酸提取,比较8种洗涤液的核酸提取性能。(2)在15 μL反应体系中添加3 μL长链醇类或油类洗涤液,以3 μL ddH2O为阴性对照,分析8种洗涤液残留对101~103拷贝/μL DNA和RNA模板扩增的影响。(3)以二甲基硅油、FC-40和70%乙醇作为洗涤液,分别与湿式试剂、干式试剂配合使用,对103拷贝/μL DNA和RNA模板进行提取,比较不同试剂状态下的核酸提取性能。(4)以二甲基硅油、FC-40和70%乙醇作为洗涤液,分别采用涡旋混匀、移液枪混匀、颠倒混匀3种混匀方式,比较不同混匀方式下103拷贝/μL DNA和RNA模板的核酸提取性能。(5)分析以二甲基硅油、FC-40和70%乙醇为洗涤液的磁珠法对Mp模拟临床样本中病原体基因组DNA的提取性能,并与商品化核酸提取试剂盒A和试剂盒B进行比较。所有实验均重复3次。
1.3 统计学方法
采用SPSS 20.0软件进行统计分析。呈正态分布的计量资料以±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 8种洗涤液的核酸提取性能
8种洗涤液中,二甲基硅油和FC-40均能成功提取102~105拷贝/μL的DNA和RNA,提取性能与70%乙醇比较,差异均无统计学意义(P>0.05)。十一醇未能成功提取出102拷贝/μL DNA,其他5种洗涤液在提取102~104拷贝/μL DNA和RNA模板时均有不同程度的提取失败。见表1。

表1 8种洗涤液对102~105拷贝/μL DNA和RNA的提取性能
2.2 8种洗涤液残留对核酸扩增的影响
8种洗涤液中,二甲基硅油和FC-40残留均能成功扩增DNA和RNA,与阴性对照ddH2O比较,差异均无统计学意义(P>0.05)。其他6种洗涤液残留对PCR和RT-PCR均有不同程度的抑制作用,尤其是低拷贝数的DNA和RNA的扩增受到显著抑制。见表2。
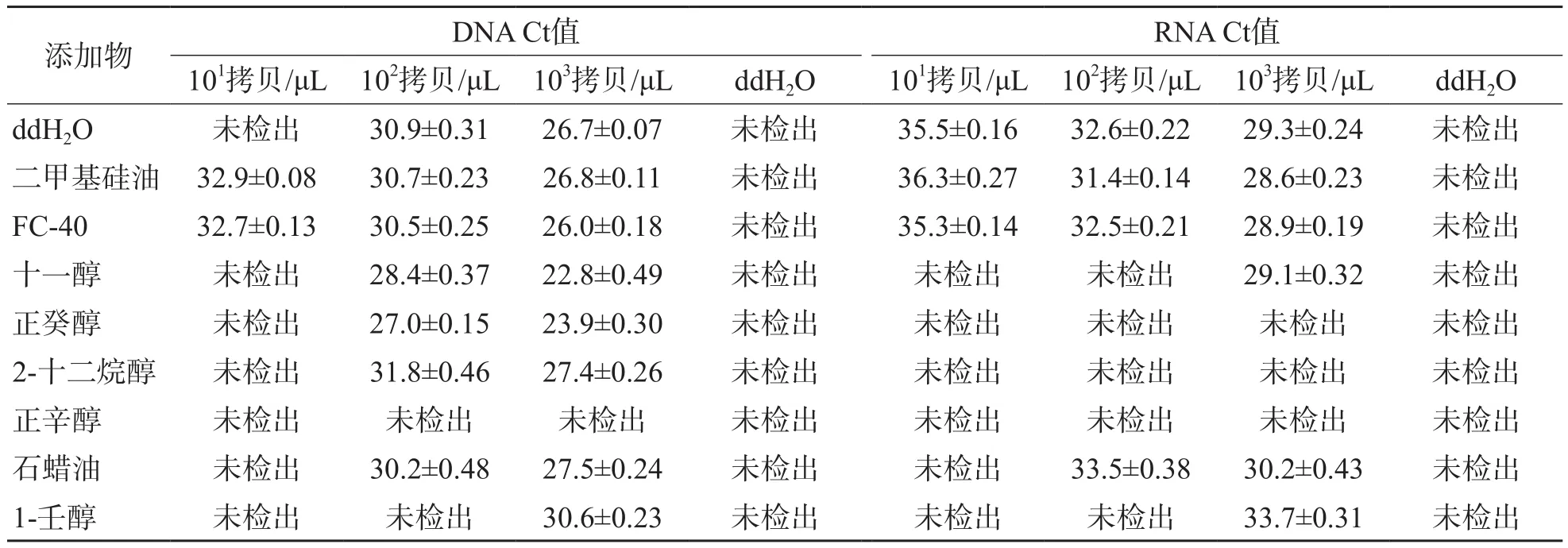
表2 8种洗涤液残留对核酸扩增检测的影响
2.3 二甲基硅油和FC-40配合不同状态试剂使用时对核酸提取性能的影响
以二甲基硅油和FC-40作为洗涤液,无论是配合干式试剂还是湿式试剂,提取103拷贝/μL DNA和RNA模板的Ct值与70%乙醇洗涤液比较,差异均无统计学意义(P>0.05)。见表3。

表3 不同状态试剂结合油类洗涤液的核酸提取性能
2.4 不同混匀方式对二甲基硅油和FC-40洗涤液的适用性
无论采用哪种混匀方式,以二甲基硅油、FC-40为洗涤液提取103拷贝/μL DNA和RNA模板的Ct值与70%乙醇比较,差异均无统计学意义(P>0.05)。见表4。
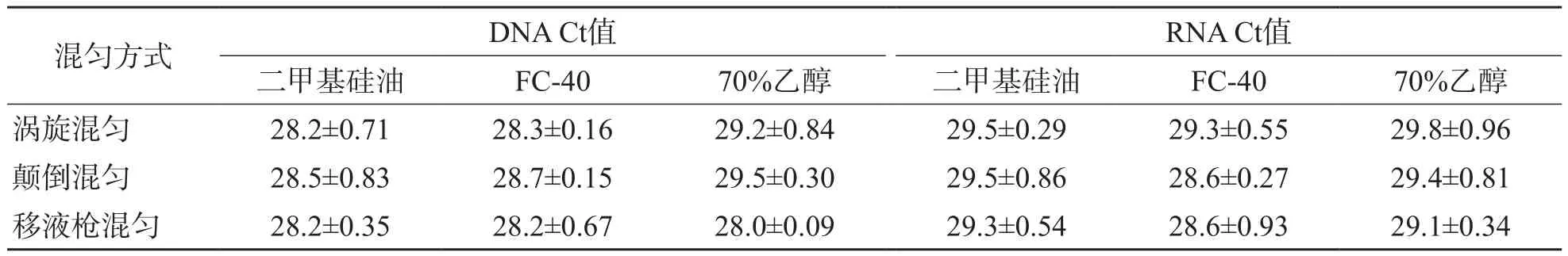
表4 不同混匀方式对二甲基硅油和FC-40洗涤液的适用性
2.5 二甲基硅油和FC-40洗涤液对病原体样本核酸的提取性能
以二甲基硅油和FC-40为洗涤液,提取Mp模拟临床样本DNA的Ct值分别为32.34±0.18和31.87±0.03,与以70%乙醇为洗涤液的Ct值(32.28±0.20)比较,差异无统计学意义(P>0.05)。以二甲基硅油和FC-40为洗涤液的磁珠法提取DNA的Ct值低于商品化核酸提取试剂盒B(Ct值为35.48±0.01)(P<0.05);与商品化核酸提取试剂盒A(Ct值为31.81±0.30)比较,差异无统计学意义(P>0.05)。
3 讨论
感染性疾病的病原体种类多种多样,准确、快速的病原体的精准检测已成为疾病诊疗和防控的关键。传统的病原体培养法周期长,抗体法易受既往感染史影响,而核酸法可规避上述弊端,能从复杂的生物样本中快速、准确地检测出特定病原体的基因组DNA或RNA,敏感性高,特异性好[4]。传统的核酸检测方法是实时荧光PCR,操作繁琐,极易造成交叉污染,导致假阳性结果。分子微流控以微管道网络为结构特征,可制备成全封闭的、自动化的设备,整合了核酸提取和扩增检测的全过程,可避免交叉污染,同时缩短了核酸检测的时间,扩大了核酸检测的应用范围[5]。
核酸检测的性能很大程度上取决于核酸提取步骤。目前,主流的核酸提取方法——磁珠法具有简便、快速、高通量、自动化等优势[6],其使用的洗涤液为70%~80%的乙醇。由于乙醇易挥发、易燃,整合在微流控板卡中运输和储存时存在一定的安全隐患;乙醇浓度降低还会导致核酸从磁珠上解吸附,造成核酸量的损失。此外,微流控产品具有体积小、重量轻、可常温储存等优点,各反应试剂需尽可能地制备成冻干品,以便常温运输和储存,但具有挥发性质的乙醇既不能做成冻干品,也无法满足上下游试剂冻干品在微流控组装过程中的极干燥环境要求[3]。因此,乙醇无法用于微流控产品。近年来,研究者们采用基于水相-气相-油相结构的表面张力辅助的不混溶相过滤(immisciblefiltration assisted by surface tension,IFAST)体系来构建微流控核酸提取和检测系统,洗涤液通常选用油类化合物[7]。HU等[8-9]构建了IFAST体系,从全血和血浆样本中迅速分离游离DNA(cell-free DNA,cfDNA),整个提取过程不超过15 min,后续又构建了基于IFAST和LAMP的一体化核酸芯片,可在60 min内完成cfDNA的提取和检测,证实了油性洗涤液在微流控平台上的潜在应用价值。
本研究对5种长链醇类和3种油类洗涤液在微流控平台上的应用进行了分析,并针对病原体的基因组分DNA和RNA两大类的特点,探讨了DNA、RNA共提取的方法,以便在微流控平台上开展多种病原体的联合检测,结果显示,8种洗涤液中,二甲基硅油和FC-40对DNA和RNA的提取性能与70%乙醇相比差异较小,在DNA和RNA模板量为102~105拷贝/μL时均能检出,而其他6种洗涤液的提取效率相对较低,尤其是对于低浓度核酸模板而言,效率更低。考虑到微流控技术平台无法模拟手工移液器的吸弃操作,难以实现洗涤液的完全去除,本研究特别检测了各种油性洗涤液残留对后续扩增的影响,其中二甲基硅油和FC-40对PCR和RT-PCR均无抑制作用,而其他6种洗涤液对下游扩增反应均有程度不同的抑制。由此可见,二甲基硅油和FC-40可取代70%乙醇,作为核酸提取的洗涤液。
针对微流控的特点,本研究将吸附液、洗脱液制成干式试剂,复溶后结合二甲基硅油和FC-40洗涤液,其核酸提取性能与湿式试剂无差异,说明油类洗涤液配合干式试剂适用于微流控平台。另外,油类洗涤液黏度较高,为探索适合微流控平台的洗涤混匀方式,本研究对涡旋混匀、移液枪混匀、颠倒混匀3种不同的混匀方式进行了探讨,结果显示,无论采用哪种混匀方式,以二甲基硅油、FC-40为洗涤液提取103拷贝/μLDNA和RNA模板的Ct值与70%乙醇比较,差异均无统计学意义(P>0.05)。说明以二甲基硅油、FC-40为洗涤液时,不同的混匀方式对核酸提取无影响。
本研究结果还显示,以二甲基硅油和FC-40为洗涤液,提取Mp模拟临床样本DNA后的Ct值与以70%乙醇为洗涤液时的Ct值比较,差异无统计学意义(P>0.05);且与商品化核酸提取试剂盒A的DNA提取性能基本一致(P>0.05),提示油类洗涤液可用于临床样本的核酸提取。
综上所述,以二甲基硅油和FC-40为洗涤液,采用磁珠法对DNA和RNA进行共提取的效率与传统70%乙醇洗涤液等效,且具有不易挥发、安全的优点,适用于微流控产品的开发和临床应用。
