miR-127-3p靶向MAPK4对肝癌HepG2细胞株生物学特性的影响①
2020-07-13张玉蓉贾俊枝徐国明
张玉蓉 贾俊枝 徐国明 郭 红
(内蒙古医科大学附属医院日间病房,呼和浩特 010050)
肝癌是全球范围内最常见的恶性肿瘤之一,每年约有63万新肝癌病例产生[1]。在我国,肝癌患者约占总癌症病例的50%,其五年存活率约为5%[2]。现阶段,对肝癌患者多采用手术切除及放、化疗进行治疗,但多因再度复发及转移而预后不良[3]。近年来肝癌发病率逐年递增,探究肝癌生长及转移相关的分子机制成为医学领域研究热点[4]。miR-127-3p是一类抑癌基因,研究表明,在骨肉瘤中,miR-127-3p可显著抑制肿瘤细胞的增殖和侵袭[5];在骨巨细胞瘤中,miR-127-3p可显著抑制癌细胞集落形成及瘤体形成[6]。而目前在肝癌中还没有关于miR-127-3p作用机制的报道。本研究通过上调miR-127-3p,对其在肝癌细胞HepG2中的作用及机制进行深入探索,为寻找肝癌的有效治疗方法提供新思路。
1 材料与方法
1.1材料
1.1.1细胞株 人正常肝细胞HL-7702、肝癌细胞HepG2购自美国ATCC公司。
1.1.2实验动物 SPF级BALB/c雄性裸鼠20只,鼠龄5~6周,体质量20~22 g,购自上海斯莱克实验动物有限责任公司[SCXK(沪)2017-0005],饲养于内蒙古医科大学新药安全评价研究中心[SYXK(蒙)2014-0003],昼夜12 h交替,经过灭菌处理的水和饲料自由摄取。本实验经内蒙古医科大学医学伦理委员会审批(IACUC 2014045),实验操作遵循3R原则。
1.1.3主要试剂与仪器 DMEM高糖基本培养液(11965-092)、Transwell小室购自美国Corning公司(3379),胎牛血清FBS购自美国Gibco公司(10100154),青链霉素购自北京索莱宝科技有限公司(P1400),Trizol购自美国Invitrogen公司(15596026),反转录试剂盒(4374967)、实时定量PCR试剂盒(10928042)、脂质体2000转染试剂盒(11668019)、荧光素酶检测试剂盒(16177)、pcDNA 3.1载体(V79020)购自美国Thermo fisher公司,RIPA裂解液(P0013E)、BCA试剂盒(P0012)、Hoechst染色试剂盒(C1017)、Tunel凋亡检测试剂盒(C1091)购自上海碧云天生物技术研究所,BrdU试剂盒购自瑞士Roche公司(11647229001),Ki67(sc-23900)、B细胞淋巴瘤/白血病基因Bcl-2(sc-509)、Bcl伴随蛋白Bax(sc-20067)、血管内皮生长因子VEGF(sc-365578)、基质金属蛋白酶MMP-9(sc-21733)抗体购自美国Santa Cruz公司,丝裂原活化蛋白激酶MAPK4(ab211501)、cleaved Caspase-3(ab2302)、MAPK活化蛋白激酶MAPKAPK5(ab97332)、磷酸化MAPKAPK5(p-MAPKAPK5)(ab138668)、热休克蛋白HSPB1(ab5579)、p-HSPB1(ab5594)抗体购自英国Abcam公司,3-磷酸甘油醛脱氢酶GAPDH(BM1623)抗体及对应二抗购自美国博士德生物工程有限公司,ABI7700 PCR仪购自美国ABI公司,pGL3 luciferase promoter载体(E1751)、GLO-Max20/20荧光检测仪购自美国promega公司,荧光显微镜、光学显微镜购自日本Olympus公司。
1.2方法
1.2.1细胞培养及分组 人正常肝细胞HL-7702及肝癌细胞HepG2(ATCC)以体积分数为15%的FBS、100 U/ml青霉素和100 μg/ml链霉素的高糖DMEM培养液进行培养。培养箱设置为37℃、体积分数5% CO2,传代次日换液,融合率达到85%以上后再以1×104个/ml 的浓度传代。肝癌细胞HepG2分为control、miR-127-3p mimic、pcDNA 3.1-MAPK4(pc-MAPK4)及miR-127-3p mimic+pc-MAPK4(mimic+pc-MAPK4)组, miR-127-3p mimic及pc-MAPK4分别或同时转染细胞6 h,control组加入等量空载,转染后换正常培养液继续培养,用于后续检测。
1.2.2建立HepG2细胞裸鼠皮下移植瘤模型 裸鼠分为control及miR-127-3p mimic组,每组10只。每只裸鼠皮下接种0.2 ml浓度为1×106个/ml的经或未经miR-127-3p转染的HepG2细胞。饲养30 d,每隔5 d记录肿瘤体积V=π/6(肿瘤长径/2+肿瘤短径/2)3,然后断颈处死,收集肿瘤组织并进行石蜡包埋,用于后续检测。
1.2.3qRT-PCR检测miR-127-3p及MAPK4基因表达 将HL-7702、HepG2细胞及1.1.3中移植瘤组织进行总RNA提取。细胞及移植瘤组织中加入Trizol于通风橱中裂解,依据总RNA提取试剂盒说明书进行抽提,得到的总RNA进行定量分析,取等量RNA反转录为cDNA,用实时定量PCR试剂盒配制PCR体系并扩增,得到阈值Δct,以对照组2-Δct平均值为基准1,实验组2-Δct平均值与对照组2-Δct平均值相比得到的2-ΔΔct为相对变化倍数。
1.2.4荧光素酶实验 生物信息预测miR-127-3p与MAPK4间连续结合片段,PCR扩增将片段插入荧光素酶报告载体中,构建MAPK4 wt质粒。对两者间结合片段位点进行突变,构建MAPK4 mut质粒。将miR-127-3p mimic与MAPK4 wt或mut共同转染HepG2细胞,继续培养24 h后,检测细胞荧光素酶活性。
1.2.5BrdU检测细胞增殖1.2.1中分组细胞以1.5×105个/ml的浓度接种于6孔板中培养24 h,然后加入10 μmol/L BrdU孵育8 h,PBS洗涤。以含体积分数95%乙醇、5%冰乙酸的固定液冰上固定细胞,洗涤后加入BrdU单抗孵育4℃过夜,二抗室温避光1 h。再用DAPI复染细胞核,荧光显微镜观察并计数。
1.2.6Hoechst染色检测细胞凋亡 固定1.2.1中分组细胞,洗涤后利用Hoechst染色试剂盒进行染色,操作方法依据Hoechst染色试剂盒说明书,利用荧光显微镜进行检测。激发波长350 nm,发射波长460 nm,可检测到细胞核呈蓝色。
1.2.7Transwell检测细胞侵袭 4℃预先融化Matrigel,取少量Matrigel到Transwell小室中预包被。接种1.2.1中分组细胞于上室,无血清培养液培养24 h后,棉签拭去滤膜上层未迁移细胞,HE染色液对迁移下层细胞进行染色并计数。
1.2.8划痕实验检测细胞迁移 先在空白细胞培养板背面画5~6条穿过板孔且相隔0.5~1 cm的横线,然后在板中培养1.2.1中分组细胞。细胞铺满板孔时进行划痕,PBS洗涤后用无血清培养液培养24 h。于0和24 h进行拍照并计算划痕闭合率,划痕闭合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.9Tunel检测组织凋亡水平 石蜡切片脱蜡,滴加蛋白酶K修复,放入内源性过氧化物酶封闭液封闭5 min,滴加Tunel检测液,37℃避光孵育1 h,洗涤后滴加DAB显色液进行显色并用苏木素复染细胞核。凋亡细胞呈棕色,正常细胞为蓝色。
1.2.10免疫组化检测Ki67 石蜡切片脱蜡,柠檬酸钠缓冲液修复,滴加一抗至切片4℃孵育过夜,二抗37℃ 1 h,滴加辣根过氧化物酶标记的链酶蛋白亲和素37℃作用40 min,洗涤后避光显色并用苏木素复染细胞核。抗原蛋白阳性细胞为棕色,正常细胞为蓝色。
1.2.11蛋白质印迹法检测相关蛋白表达 RIPA裂解液提取1.2.1中分组细胞及1.2.2中移植瘤组织总蛋白,BCA试剂盒进行定量并调平,取蛋白30 μg,质量分数10% SDS-PAGE将其分离,半干转膜法转至PVDF膜上,质量分数5%脱脂奶粉2 h室温封闭,一抗4℃孵育过夜,二抗37℃ 1 h,最后曝光显色,GAPDH为内参。
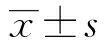
2 结果
2.1miR-127-3p与MAPK4在肝癌HepG2细胞中存在靶向关系 生物信息预测has-miR-127-3p与MAPK4之间存在连续结合片段(图1A);与人正常肝细胞HL-7702比较,肝癌HepG2细胞中miR-127-3p表达降低(t=2.661,P=0.007 4),MAPK4表达升高(t=7.156,P=0.003 1),其中miR-127-3p相对表达水平为0.37±0.04,MAPK4相对表达水平为2.36±0.27;miR-127-3p mimic可提高HepG2细胞中miR-127-3p表达,其相对表达水平为50.68±12.00(t=9.940,P=0.001 9),降低MAPK4蛋白水平,其相对蛋白水平为0.17±0.08(t=4.296,P=0.002 2,图1B)。pc-MAPK4可提高MAPK4蛋白水平,其相对蛋白水平为2.24±0.38,并减弱miR-127-3p mimic对MAPK4抑制作用,其相对蛋白水平为1.16±0.13(t=6.587,P=0.005 5,图1B);荧光素酶实验结果表明,miR-127-3p mimic可降低MAPK4 wt的荧光素酶活性(t=18.805,P<0.001,表1),以上差异均有统计学意义,而对存在结合位点核苷酸突变的MAPK4 mut,miR-127-3p mimic处理组和未经miR-127-3p mimic处理组相比差异无统计学意义。
2.2miR-127-3p靶向MAPK4对HepG2细胞增殖及凋亡的影响 各组BrdU阳性细胞百分比分别为control组(40.2±4.6)%,miR-127-3p mimic组(9.7±1.2)%,pc-MAPK4组(74.6±8.9)%,mimic+pc-MAPK4组(24.5±4.1)%;各组凋亡细胞百分比分别为control组(6.8±0.9)%,miR-127-3p mimic组(28.3±2.9)%,pc-MAPK4组(2.3±0.5)%,mimic+pc-MAPK4组(11.3±1.4)%。与control组比较,miR-127-3p mimic组中BrdU阳性细胞百分比显著减少(P=0.004 2,图2A),凋亡细胞百分比增多(P=0.005 1,图2B),Ki67及Bcl-2蛋白水平降低,Bax及cleaved Caspase-3蛋白水平升高(P=0.006 7,图2C,表2);pc-MAPK4组中BrdU阳性细胞百分比增多(P=0.008 8,图2A),凋亡细胞百分比减少(P=0.003 9,图2B),Ki67及Bcl-2蛋白水平升高,Bax及cleaved Caspase-3蛋白水平降低(P=0.003 6,图2C,表2)。与miR-127-3p mimic组比较,mimic+pc-MAPK4组中BrdU阳性细胞百分比增多(P=0.004 8,图2A),凋亡细胞百分比减少(P=0.006 3,图2B),Ki67及Bcl-2蛋白水平升高,Bax及cleaved Caspase-3蛋白水平降低(P=0.007 1,图2C,表2),以上差异均有统计学意义。



GroupsControlmiR-127-3p mimicMAPK4 wt4.73±0.421.09±0.22MAPK4 mut4.79±0.434.67±0.48
2.3miR-127-3p靶向MAPK4对HepG2细胞侵袭迁移的影响 各组细胞划痕愈合率分别为Control组(86.0±9.0)%,miR-127-3p mimic组(51.0±5.0)%,pc-MAPK4组(95.0±9.0)%,mimic+pc-MAPK4组(67.0±6.0)%;各组侵袭细胞数目分别为control组188±15,miR-127-3p mimic组86±11,pc-MAPK4组274±27,mimic+pc-MAPK4组151±19。与control组比较,miR-127-3p mimic组中细胞划痕闭合率降低(P=0.007 3,图3A),侵袭细胞数减少(P=0.005 6,图3B),MMP-9及VEGF蛋白水平降低(图3C,表3);pc-MAPK4组中细胞划痕闭合率升高(P=0.008 5,图3A),侵袭细胞数增多(P<0.01,
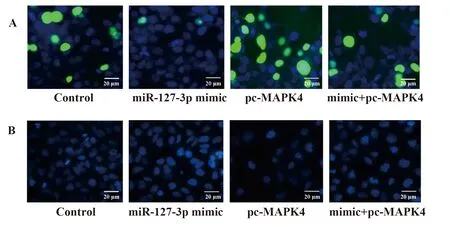

图2 miR-127-3p mimic及pc-MAPK4对HepG2细胞增殖及凋亡的影响
Fig.2 Effect of miR-127-3p mimic and pc-MAPK4 on proliferation and apoptosis of HepG2
Note: A.Detection of cell proliferation by BrdU(×400);B.Detection of cell apoptosis by Hoeschst(×400);C.Detection of proliferation and apoptosis related protein levels by Western blot.1.Control;2.miR-127-3p mimic;3.pc-MAPK4;4.mimic+pc-MAPK4.



GroupsKi67Bcl-2Baxcleaved Caspase-3miR-127-3p0.21±0.040.29±0.043.45±0.263.46±0.25pc-MAPK42.38±0.222.46±0.240.33±0.040.35±0.04mimic+pc-MAPK40.88±0.080.91±0.091.69±0.141.71±0.13F394.023334.14496.00540.16P<0.001<0.001<0.001<0.001

图3 miR-127-3p mimic及pc-MAPK4对HepG2细胞侵袭迁移的影响
Fig.3 Effect of miR-127-3p mimic and pc-MAPK4 on invasion and migration of HepG2
Note: A.Detection of cell invasion by Transwell;B.Detection of cell migration by wound healing;C.Detection of MMP-9 and VEGF protein levels by Western blot.1.Control;2.miR-127-3p mimic;3.pc-MAPK4;4.mimic+pc-MAPK4.


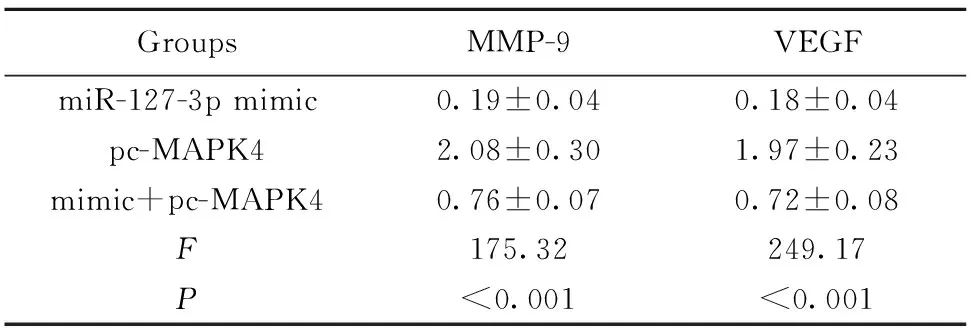
GroupsMMP-9VEGFmiR-127-3p mimic0.19±0.040.18±0.04pc-MAPK42.08±0.301.97±0.23mimic+pc-MAPK40.76±0.070.72±0.08F175.32249.17P<0.001<0.001
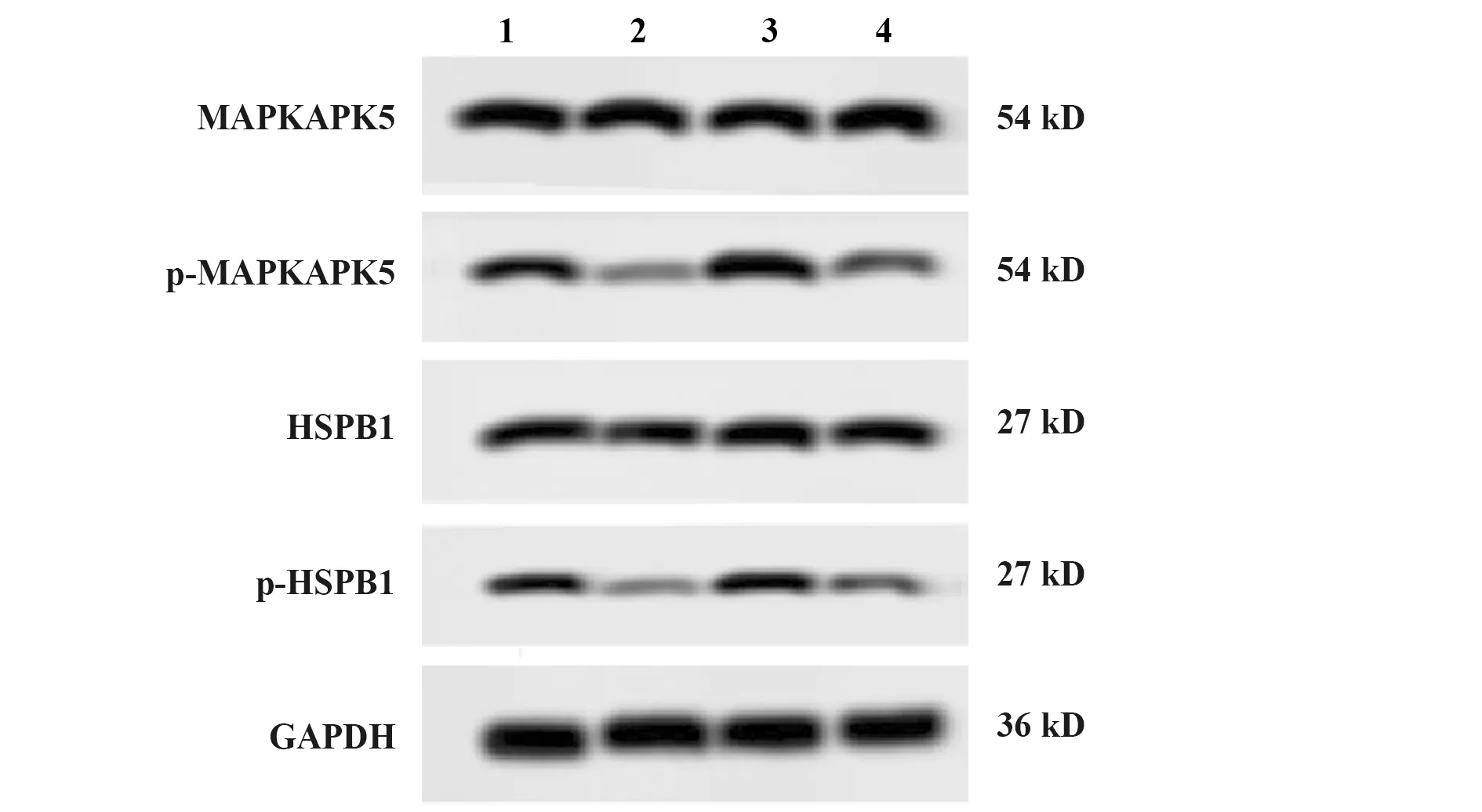
图4 miR-127-3p mimic及pc-MAPK4对HepG2细胞中MAPK4下游蛋白的影响Fig.4 Effect of miR-127-3p mimic and pc-MAPK4 on downstream protein of MAPK4 in HepG2Note:n=6;1.Control;2.miR-127-3p mimic;3.pc-MAPK4;4.mimic+pc-MAPK4.
表4 MAPK4下游蛋白水平
Tab.4 Downstream protein levels of MAPK4

Groupsp-MAPKAPK5/MAPKAPK5p-HSPB1/HSPB1miR-127-3p mimic0.32±0.060.28±0.04pc-MAPK42.13±0.201.88±0.18mimic+pc-MAPK40.74±0.090.71±0.08F312.45305.48P<0.001<0.001

图5 miR-127-3p mimic对HepG2细胞裸鼠皮下移植瘤的影响Fig.5 Effect of miR-127-3p mimic on subcutaneous transplantation of HepG2 cells in nude miceNote:A.Volumetric growth curve of subcutaneous xenografts in nude mice;B.Appearance of subcutaneous xenograft tumors in nude mice;C.Percentage of Ki67 positive cells detected by immunohistochemistry;D.Tunel detection of tumor cell apoptosis;E.Western blot detection MMP-9 protein level and p-MAPKAPK5/MAPKAPK5 ratio.
图3B),MMP-9及VEGF蛋白水平升高(P=0.005 8,图3C,表3)。与miR-127-3p mimic组比较,mimic+pc-MAPK4组中细胞划痕闭合率升高(P=0.008 3,图3A),侵袭细胞数增多(P=0.007 8,图3B),MMP-9及VEGF蛋白水平升高(P=0.006 8,图3C,表3),以上差异均有统计学意义。
2.4miR-127-3p靶向MAPK4对HepG2细胞中MAPK4下游蛋白的影响 与control组比较,miR-127-3p mimic组中p-MAPKAPK5/MAPKAPK5及p-HSPB1/HSPB1降低(P=0.007 5),pc-MAPK4组中p-MAPKAPK5/MAPKAPK5及p-HSPB1/HSPB1升高(P=0.006 8,图4,表4)。与miR-127-3p mimic组比较,mimic+pc-MAPK4组中p-MAPKAPK5/MAPKA PK5及p-HSPB1/HSPB1升高(P=0.005 5,P=0.005 6,图4,表4),以上差异均有统计学意义。
2.5miR-127-3p靶向MAPK4对HepG2细胞裸鼠皮下移植瘤的影响 与control组比较,miR-127-3p mimic组HepG2细胞裸鼠皮下移植瘤体积降低,其中control组终体积(2 035±156)mm3,miR-127-3p mimic组终体积(1 089±123)mm3(P=0.007 3,图5A、B);同时control组瘤重(2.42±0.20)g,miR-127-3p mimic组瘤重(1.34±0.16)g (P=0.005 5);miR-127-3p表达升高,MAPK4表达降低,其中miR-127-3p相对表达水平34.85±7.40,MAPK4相对表达水平0.38±0.05(P<0.001);Ki67阳性细胞百分比减少,其中control组阳性细胞百分比(43.0±5.0)%,miR-127-3p mimic组阳性细胞百分比(9.0±2.0)%(P=0.004 7,图5C),凋亡细胞百分比增多,其中control组凋亡百分比(7.0±2.0)%,miR-127-3p mimic组凋亡百分比(49.0±6.0)%(P=0.004 2,图5D);MMP-9蛋白水平与p-MAPKAPK5/MAPKAPK5降低,其中MMP-9蛋白水平0.21±0.10,p-MAPKAPK5/MAPKAPK5比值0.22±0.09(P=0.004 7,P=0.003 5,图5E),以上差异均有统计学意义。
3 讨论
近十年来,miRs逐渐被报道参与了各种生物过程,包括细胞存活、增殖、分化、凋亡及运动[7]。同时,某些miRs还可通过负调控原癌基因作为癌症的抑制因子[8], miR-127-3p也是一种肿瘤抑制因子,大量研究报道了miR-127-3p的肿瘤抑制作用[5,6,9]。本文通过生物信息预测发现miR-127-3p与MAPK4存在连续结合片段,预示miR-127-3p与MAPK4间存在靶向关系。MAPK4是MAPK信号通路中的重要一员,其表达上调可显著提高细胞的增殖能力[10]。本文通过对比正常肝细胞HL-7702发现,肝癌细胞HepG2中miR-127-3p基因表达显著降低,MAPK4蛋白水平显著升高,提示miR-127-3p下调及MAPK4上调与肝癌发生有关;利用miR-127-3p mimic上调miR-127-3p后,MAPK4蛋白水平显著下降,提示miR-127-3p对MAPK4有潜在调控作用;同时荧光素酶报告实验结果显示,miR-127-3p mimic可显著降低MAPK4 wt荧光素酶活性,而对MAPK4 mut没有显著影响。综合上述实验结果提示,在HepG2细胞中,miR-127-3p可靶向下调MAPK4表达。
降低癌细胞增殖能力可有效阻止癌症发生及其进一步恶化。据报道miR-127-3p不仅可降低癌细胞增殖能力,还可显著诱导细胞凋亡的发生,如miR-127-3p可通过负调控其靶基因细胞色素C氧化酶同源组装因子COA1显著降低骨巨细胞瘤细胞增殖能力并阻止瘤体形成[6];通过负调控赖氨酸甲基转移酶SETD8及整合素亚基-α 6显著抑制骨肉瘤细胞增殖并提高Caspase-3活性[5,11]。Caspase-3是执行细胞凋亡程序的关键蛋白,其活性增强预示着凋亡水平的提高[12]。本研究发现,在HepG2细胞中,上调miR-127-3p后,可通过靶向下调MAPK4显著减少BrdU阳性细胞百分比及Ki67、Bcl-2表达,增加凋亡细胞百分比及Bax、cleaved Caspase-3表达,而过表达MAPK4可显著增加BrdU阳性细胞百分比及Ki67、Bcl-2表达,减少凋亡细胞百分比及Bax、cleaved Caspase-3表达,并减弱miR-127-3p产生的抑增殖促凋亡作用。Ki67是细胞增殖相关蛋白,其表达水平可用于评估细胞的增殖能力[13]。Bcl-2是凋亡研究中最受重视的癌基因,可显著抑制细胞凋亡的发生[14],而Bax是一类促凋亡蛋白,通过调节线粒体通透性及凋亡诱导因子活性提高细胞凋亡水平[15]。cleaved Caspase-3是Caspase-3的活化形式,可作为检测细胞凋亡水平的经典指标[16]。同时,在本文中,miR-127-3p可通过靶向下调MAPK4显著减小HepG2细胞裸鼠皮下移植瘤体积,减少组织中Ki67阳性细胞百分比并增加凋亡细胞百分比。综合实验结果说明,miR-127-3p可通过靶向下调MAPK4显著抑制HepG2细胞生长并促进其凋亡的发生。
易复发易转移是现阶段肝癌治疗后出现预后不良的主要原因,控制癌细胞侵袭及迁移可降低癌组织的转移概率[3]。研究表明,miR-127具有强烈的抗侵袭迁移作用,可通过下调其靶基因的表达显著抑制胰腺癌、骨肉瘤、食管鳞状细胞癌及骨巨细胞瘤细胞侵袭及迁移[17-20],而miR-127表达下调对乳腺癌组织生长转移有显著促进作用[21]。同时,作为miR-127的稳定表型,报道表明miR-127-3p可通过靶向作用显著降低骨肉瘤及骨巨细胞瘤细胞的侵袭及迁移能力[5,6]。在本研究中,上调miR-127-3p不仅可减少HepG2侵袭细胞数、划痕闭合率及MMP-9、VEGF表达,还可降低HepG2裸鼠皮下移植瘤组织中MMP-9蛋白水平。而过表达MAPK4可显著提高HepG2细胞在体内及体外的侵袭及迁移能力,并减弱miR-127-3p产生的抗侵袭迁移作用。MMP-9是金属基质蛋白酶家族的一员,具有降解细胞外基质的能力,其表达量增加能显著促进癌细胞的侵袭迁移[22,23]。VEGF是血管内皮生长因子,参与癌组织新生血管和新生淋巴管的形成[24]。综合实验结果说明,miR-127-3p可通过靶向下调MAPK4显著抑制HepG2细胞侵袭迁移。丝裂原活化蛋白激酶MAPK4是MAPK-活化蛋白激酶MAPKAPK5的主要调节因子之一,MAPK4可直接激活MAPKAPK5,沉默MAPK4可导致MAPKAPK5活性发生显著降低[25]。研究表明,MAPKAPK5在肝癌细胞中被显著激活,并抑制cleaved Caspase-3及DNA修复酶PARP蛋白表达,从而显著降低癌细胞凋亡水平并促进细胞存活[26]。在本研究中,miR-127-3p可通过靶向下调MAPK4显著降低其下游蛋白MAPKAPK5及HSPB1在HepG2细胞中的磷酸化比值。HSPB1是MAPKAPK5的直接作用底物,在体内主要发挥细胞保护的功能,临床检测发现,HSPB1磷酸化比值与肝癌患者肿瘤直径及其门静脉侵袭率呈正比[27]。提示HSPB1与癌症发展有着密切联系,miR-127-3p可能通过此通路对HepG2细胞生长转移产生抑制作用。
综上所述,miR-127-3p可通过靶向下调MAPK4显著抑制肝癌细胞HepG2在体内及体外增殖、侵袭、迁移并促进其凋亡的发生。同时,miR-127-3p还可通过靶向下调MAPK4抑制其下游蛋白MAPKAPK5及HSPB1磷酸化,提示miR-127-3p可能通过此通路阻碍HepG2细胞生长转移,为miR-127-3p用于肝癌临床治疗提供理论依据。
