Fenton氧化法处理双唑杂环废水
2020-07-13汤亚飞何亚萍龚莉惠
冯 玥,汤亚飞,何亚萍,龚莉惠
武汉工程大学化学与环境工程学院,湖北 武汉 430205
杂环化合物的独特结构和性质使其在高效农药生产和有机药物合成等方面[1]占有重要地位,在近年来新开发的农药中,大约有80%是杂环化合物。吡唑类衍生物作为杂环化合物中的一个活跃分支[2],吡唑类化合物具有不同的生物活性[3-5]。双唑杂环类化合物生产废水具有难降解、有机物成分复杂、高盐、生物毒性、高浓度、恶臭气味等特征,采取单一的生化、物化或化学法处理工艺达不到理想的处理效果或处理成本太高,需要选用优势互补、经济可行的组合工艺[6-8]。Fenton法是目前应用最广泛的高级氧化方法(AOPs),利用Fe2+的催化作用使H2O2分解产生羟基自由基(·OH)氧化废水中的有机物污染物,并使其降解成为小分子有机物或矿化为CO2和H2O等无机物质[9-10]。Fenton法具有反应速率快、氧化能力强、适用范围广、无污染或污染小等优点[11-13]。Botlík 和 Oldrich[14]研究了通过Fenton氧化法去改善生物处理制药废水中生物降解性适用性。
本文以含双唑杂环类化合物的模拟废水为对象,研究了芬顿氧化法对含氮杂环有机化合物废水处理的适应性和降解机理,对同类废水处理研究和应用具有理论意义和实用价值。
1 实验部分
1.1 材料和仪器
模拟废水:在已调节pH值为3的去离子水中投加双吡唑,通过水浴搅拌(80℃)使双吡唑溶解,冷却后过滤,将得到的滤液稀释至双吡唑质量浓度为300 mg/L单物质模拟废水水样,测得COD为408 mg/L。双吡唑结构式见图1。
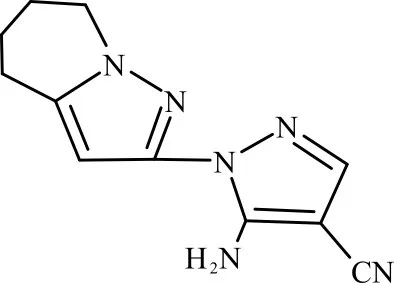
图1 双吡唑结构Fig.1 Dipyrazole structure
仪器:752PC型紫外可见分光光度计(上海光谱仪器有限责任公司)、SHA-C型数显水浴恒温振荡器(上海东玺制冷仪器设备有限公司)、PHS-3C型pH计(美国奥豪斯公司)、BSA 124S型电子天平(北京赛多利斯科学仪器有限公司)等。
1.2 实验方法
1.2.1 制标准曲线的方法 以乙醇作为溶剂,配制不同浓度的双吡唑标准溶液,在240 nm波长下测定各浓度的吸光度,绘制双吡唑标准曲线,得到的回归方程为:y=13.996x+0.140 5,R2=0.991 2。
1.2.2 Fenton实验 量取50 mL水样倒入100 mL小烧杯中,用H2SO4调整初始pH,投加一定量的硫酸亚铁和H2O2,置于振荡器中反应一定时间。反应完成后,用NaOH调整其pH为10倒入试管中,静置1 h,取上清液测定水样的吸光度和CODcr值,以吸光度来表征双吡唑化合物。
2 结果与讨论
2.1 H 2O2投加量对处理效果的影响
设定FeSO4·7H2O投加量1.0 g/L,初始pH为3,反应时间为30 min,改变H2O2的投加量。由图2(a)可知,增加H2O2的投加量,双吡唑和COD的去除率呈现增长趋势,且均是先快速增长,当H2O2用量达到30 mL/L以后增长趋近平缓,H2O2用量为40 mL/L时COD的去除率仅为54.6%,说明Fe2+的投加量还不够。双吡唑去除率高于COD降率,说明双吡唑没有彻底氧化为CO2和H2O。
2.2 FeSO4·7H2O投加量对处理效果的影响
设定H2O2投加量40 mL/L,初始pH为3,反应时间为30 min,改变FeSO4·7H2O的投加量,实验结果如图 2(b)所示。由图 2(b)可知,随着 FeSO4·7H2O投加量的增加,双吡唑和COD浓度快速降低,当投加量大于1.8 g/L时,去除率增长趋势逐渐变缓。通过对Fenton试剂的机理研究可以得到,设定H2O2投加量不变时,当Fe2+投加量增加,·OH的产生量会随之增加,COD和双吡唑会被快速降解;而过量的Fe2+会使H2O2分解为H2O和O2从而消耗了H2O2。所以最佳FeSO4·7H2O投加量为1.8 g/L,此时双吡唑和COD去除率分别为93.5%和82.3%。
2.3 初始pH对处理效果的影响
设定 FeSO4·7H2O投加量 1.8 g/L,H2O2投加量40 mL/L,反应时间为30 min,改变初始pH,实验结果如图 2(c)所示。由图 2(c)可见,双吡唑和 COD的去除率随着初始pH值的增大,会先迅速升高而后急剧降低,而去除率达到最大值时pH值为2.5。考虑到在实际生产过程中较低的pH会对设备严重腐蚀,选取pH=3为宜,此时污染物和COD去除率分别为93.4%和77.9%。
2.4 反应时间对处理效果的影响
设定FeSO4·7H2O投加量1.8 g/L,H2O2投加量40 mL/L,初始pH为3。改变反应时间,研究不同反应时间对处理效果的影响。实验结果如图2(d)所示,反应时间在30 min以前,双吡唑和COD去除率快速上升。当反应时间大于30 min后,去除率提高不明显。
2.5 Fenton试剂投加量对处理效果的影响
根据以上实验结果可以计算出此时Fenton试剂 m(Fe2+)∶V(H2O2)≈1∶20。设定初始 pH为 3,反应时间为 30 min,按 m(Fe2+)∶V(H2O2)=1∶20 投加不同量的Fenton试剂。由图2(e)可知,按m(Fe2+)∶V(H2O2)=1∶20投加,随着Fenton试剂投加量的增加,双吡唑和COD去除率先增大后减小,当FeSO4·7H2O和H2O2投加量分别为2.5 g/L和50 mL/L时达到最大值。故确定Fenton试剂投加比m(Fe2+)∶V(H2O2)=1∶20时,如最佳 H2O2投加量为 50 mL/L,此时双吡唑去除率可达97.5%,COD去除率可达82.1%。
2.6 液相色谱分析
设定H2O2投加量40 mL/L,初始pH为3,反应时间为 30 min,分别投加 0、0.4、0.8和 1.6 g/L FeSO4·7H2O,对应编号分别为 1#样、2#样、3#样和 4#样,取上清液进行液相色谱分析,测试结果见图3。

图2 影响双吡唑和COD去除率的因素:(a)H 2O2投加量,(b)FeSO4·7H 2O投加量,(c)初始pH,(d)反应时间,(e)Fenton试剂投加量Fig.2 Factors affectingremoval rate of dipyrazol and COD:(a)hydrogen peroxide dosage,(b)FeSO4·7H2Odosage,(c)initial pH,(d)reaction time,(e)Fenton reagent dosage

图 3 高效液相色谱图:(a)1#样,(b)2#样,(c)3#样,(d)4#样Fig.3 High performance liquid chromatograms :(a)No.1,(b)No.2,(c)No.3,(d)No.4
由图3(a)可知,保留4.5 min处对应的峰值为双吡唑。按峰高计算,2号水样中98%双吡唑原始物质与自由基发生了反应,同时在保留时间1.22~2.21 min出现了5个较大的吸收峰,说明双吡唑的降解过程比较复杂,依次氧化为具有更加亲水性中间产物。随着Fenton试剂用量增大,保留时间越长的物质消失越快,而对应保留时间1.223 min处物质相对比较难降解,可能为氮杂环结构。双唑杂环结构化合物中都含有2个氮杂原子,通过探究Fenton试剂降解双吡唑的机理,可推测羟基自由基(·OH)首先与杂环旁边的易断裂的键发生作用,然后才会与双吡唑发生开环反应,生成易于生物降解的有机酸。这也解释了在1.223 min停留时间处出现峰高和该出峰面积下降较缓慢的原因,同时也充分解释了在处理有机物时Fenton氧化法容易先破坏键能较小的键,然后再与键能较大的键发生反应,这也是其他有机物的存在会对双吡唑降解产生影响的原因[15]。
3 结 论
1)Fenton氧化法对双唑杂环模拟废水的处理实验结果表明,初始 pH=3,m(Fe2+)∶V(H2O2)=1∶20,FeSO4·7H2O的投加量 2.5 g/L,H2O2的投加量50 mL/L,反应时间为30 min,双吡唑去除率可达97.5%,COD去除率可达82.1%。
2)观察模拟废水经过不同处理程度后的色谱分析图,双吡唑的结构在反应中容易被破坏。在进行Fenton反应时,羟基自由基(·OH)首先与杂环旁边的易断裂的键发生作用,然后才会与双吡唑发生开环反应,生成易于生物降解的有机酸。因此1.223 min峰值处所对应物质应该是部分键断裂但未被开环的物质结构,要在后期的反应中才能逐渐降解,这说明此类含氮杂环化合物可被Fenton氧化降解。
