2种黄芪幼苗对缺硫胁迫的生理响应机制
2020-07-13唐中华郭晓瑞王洪政
张 野 杨 楠 刘 洋 唐中华 郭晓瑞 王洪政*
(1.东北林业大学化学化工与资源利用学院,哈尔滨 150040;2.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
黄芪为我国常用传统中草药,记载自《神农本草经》[1~2]。根据最新药典规定,黄芪的原植物为豆科黄芪属多年生草本植物膜荚黄芪(Astragalusmembranaceus(Fisch.) Bge.)及其变种蒙古黄芪(A.membranaceusBge. var.mongholicusHsiao)[3]。黄芪中含有黄酮类、皂苷类及多糖类等多种药用活性成分[3]。药理学研究表明,黄芪具有补气升阳、固表止汗、延缓衰老、增强机体免疫力等功效[4]。近年来,随着中药材市场对黄芪需求量的急剧增加,黄芪野生资源遭到严重破坏,目前90%以上的黄芪来源于人工培育[5],人工种植的黄芪主要分布在我国黑龙江、甘肃、山西、河北等地[5]。
种植地矿物质营养状况与黄芪生长发育及活性物质含量密切相关。已有研究结果表明,增施氮、磷、钾肥对黄芪根系和地上部的生长发育都有促进作用,并且施用钾肥可以明显提高黄芪的抗病能力[6]。当对黄芪幼苗进行缺素处理培养时,氮、磷、钾素的缺乏严重影响了黄芪根系活力并降低了叶绿素含量[7]。此外,在生长季施加氮肥显著增加了黄芪初生代谢和次生代谢的强度,提高了根部总黄酮的含量[8]。
硫(S)是植物生长发育所必需的第四大营养元素[9],它在植物生长发育和代谢调控过程中具有重要作用[10]。目前,随着土壤硫元素淋溶损失,空气硫沉降降低以及含硫肥料使用量的减少,我国多地土壤都有缺硫的报道[11]。豆科植物是需硫量较高的植物,如大豆缺硫时,叶片失绿,叶缘两侧呈棕色斑点、植株矮小、根瘤发育迟缓,导致大豆成熟期延迟、结籽量下降[12]。作为优质黄芪主产区的我国东北和西北部地区,土壤硫元素的缺乏情况也非常严重,特别是东北地区土壤的缺硫情况最为严重,据统计,其缺硫土壤面积占全省耕地面积的60%以上[13]。但目前关于黄芪对硫营养供应缺乏的生理响应相关的研究在国内外还较为少见。
本研究以药典规定的两种黄芪药材原植物膜荚黄芪和蒙古黄芪的幼苗为实验材料,在水培条件下研究了黄芪幼苗在不同程度缺硫情况下生长形态指标、光合及活性物质积累等方面发生的变化,探讨黄芪幼苗面对缺硫胁迫时的生理响应机制。
1 材料与方法
1.1 实验材料
选用膜荚黄芪(Astragalusmembranaceus(Fisch.) Bunge,以下简称A.membranaceus)和蒙古黄芪(Astragalusmembranaceus(Fisch.) Bge. var.mongholicus(Bge.) Hsiao,简称A.membranaceusvar.mongholicus)为实验材料。两种黄芪的种子均购买自河北省安国市元泰药用植物种子站。毛蕊异黄酮苷(Calycosin-7-O-β-D-glucoside)、毛蕊异黄酮(Calycosin)、刺芒柄花素(Formononetin)和刺芒柄花苷(Ononin)和标准品均购自上海纯优生物科技有限公司。色谱级甲醇、乙腈购于北京百灵威化学有限公司,去离子水(电阻率高于18.2 mΩ·cm-1)取自Milli-Q水纯化系统(Millipore,USA)。
1.2 实验方法
1.2.1 黄芪幼苗培养及缺硫处理过程
精选籽粒饱满的膜荚黄芪和蒙古黄芪的种子,用10%次氯酸钠溶液浸泡15~20 min消毒后,再用去离子水冲洗4~5次。室温浸泡24 h,播种到蛭石中。7 d后待幼苗子叶完全展开,选取长势相近的幼苗,移植到Hoagland营养液(pH5.5)中进行培养。培养条件为:温度25~30℃;每天光照14 h,光照强度为400 μmol·m-2·s-1;相对湿度保持在70%左右;每3 d更换1次培养液。溶液培养21 d后进行不同程度缺硫处理,设置全营养液(Control,CK,硫浓度为2 mmol·L-1)、低硫(Low sulfur application,LS,硫浓度为1 mmol·L-1)和无硫(No sulfur application,NS)3个处理,NS处理中所有硫酸盐全部使用其对应的氯化盐替代。每处理设3个重复,每个重复包括10株幼苗。处理进行15 d后对幼苗进行拍照和取样分析。
1.2.2 生长指标的测定
在处理前后分别用直尺(精度为1 mm)测量黄芪幼苗的株高和根长并记录用于计算处理期间株高生长量和根伸长量。
处理结束后,将黄芪植株的根、茎、叶进行分离,去除表面水分后称重记各部分鲜重,然后将样品放入烘箱中110℃杀青10 min并60℃烘干48 h,称重记各部分干重。
1.2.3 叶绿素含量测定
使用张宪政的方法[14]采用丙酮—无水乙醇混合液进行浸提并测定叶绿素a、叶绿素b、总叶绿素和类胡萝卜素的含量。
1.2.4 叶片荧光参数的测定
利用便携式调制叶绿素荧光仪(WALZ,PAM-2500,Germany)测定黄芪叶片荧光参数。选取幼苗顶端第五片展开叶,经15 min暗适应后,测量初始荧光(Fo)、最大荧光(Fm)、Fv′/Fm′、非光化学淬灭系数(NPQ)等荧光参数。每个处理重复测量5次,取平均值。
1.2.5 MDA含量测定
黄芪植株各部位组织MDA的含量采用硫代巴比妥酸(TBA)法进行测定[15]。
1.2.6 总酚和总黄酮含量测定
总酚含量参考许海棠等的方法[16]进行测定,总黄酮含量参考聂静苑等的方法[17]进行测定。
1.2.7 异黄酮含量的测定
处理结束后取黄芪幼苗根、茎、叶3个部位新鲜样品各1 g,加入70%甲醇8 mL,在40℃下超声提取45 min,过滤后的滤渣再次加入8 mL甲醇溶液超声提取,合并两次提取液。使用真空离心浓缩仪将提取液浓缩至干后,用1 mL 70%色谱级甲醇复溶样品,取上清液使用LC-MS系统测定其中异黄酮含量。色谱条件和质谱条件参考杨楠等的方法[18]进行。
1.3 数据分析
应用SPSS19.0软件对所有实验数据进行统计分析。使用单因素方差分析检验不同处理下指标的差异显著性(P<0.05)。采用SigmaPlot软件(14.0,Systat Software)绘制图表。
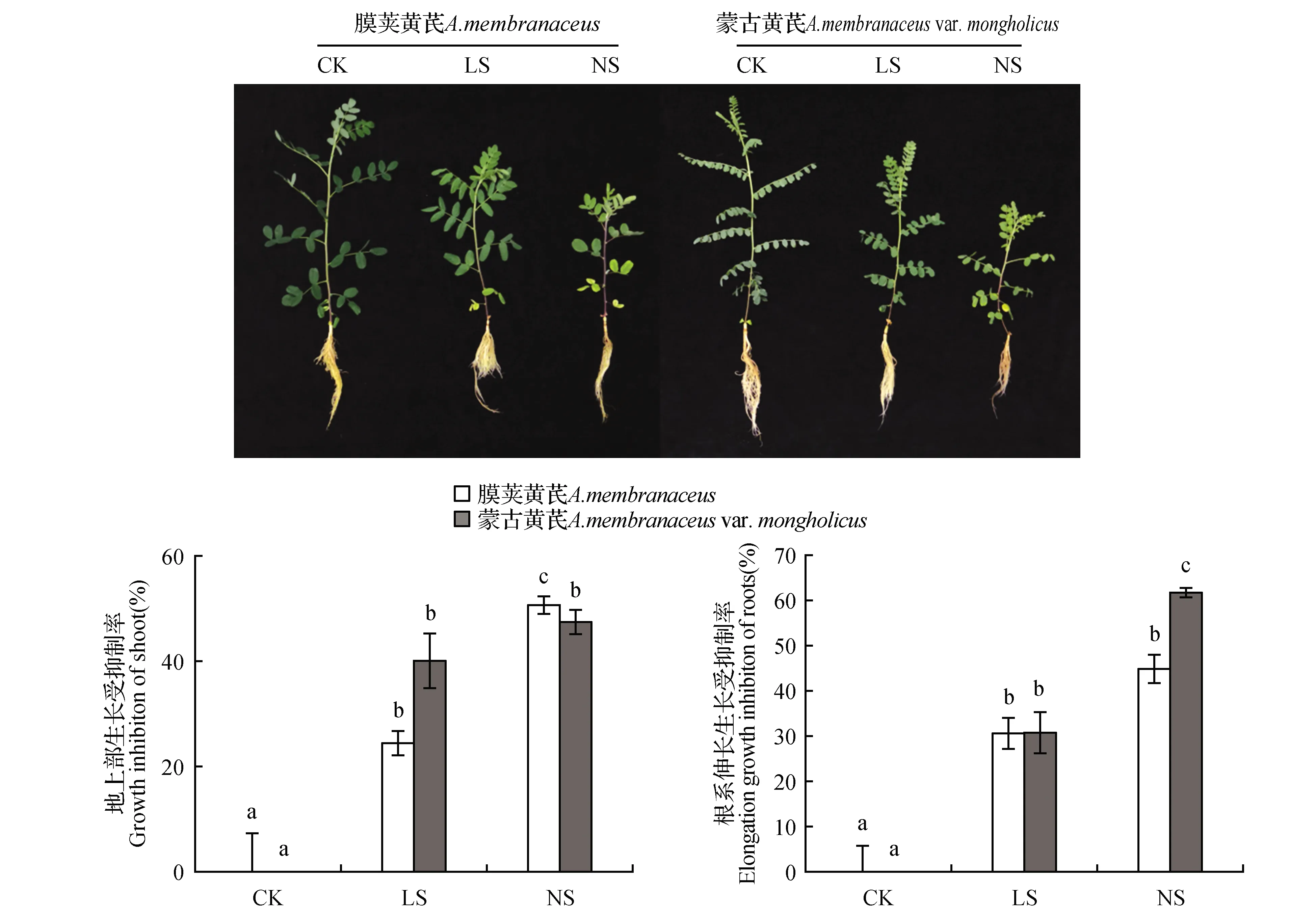
图1 不同缺硫处理对膜荚黄芪和蒙古黄芪形态的影响 不同小写字母表示差异显著P<0.05,下同。Fig.1 Morphologic effects of different degrees of sulfur deficiency on seedlings of A.membranaceus and A.membranaceus var. mongholicus Different lowercase letters indicate significant difference at P< 0.05 level,the same as below.
表1 不同程度缺硫处理对膜荚黄芪和蒙古黄芪幼苗生物量的影响
Table 1 Effects of different degrees of sulfur deficiency on biomass ofA.membranaceusandA.membranaceusvar.mongholicus
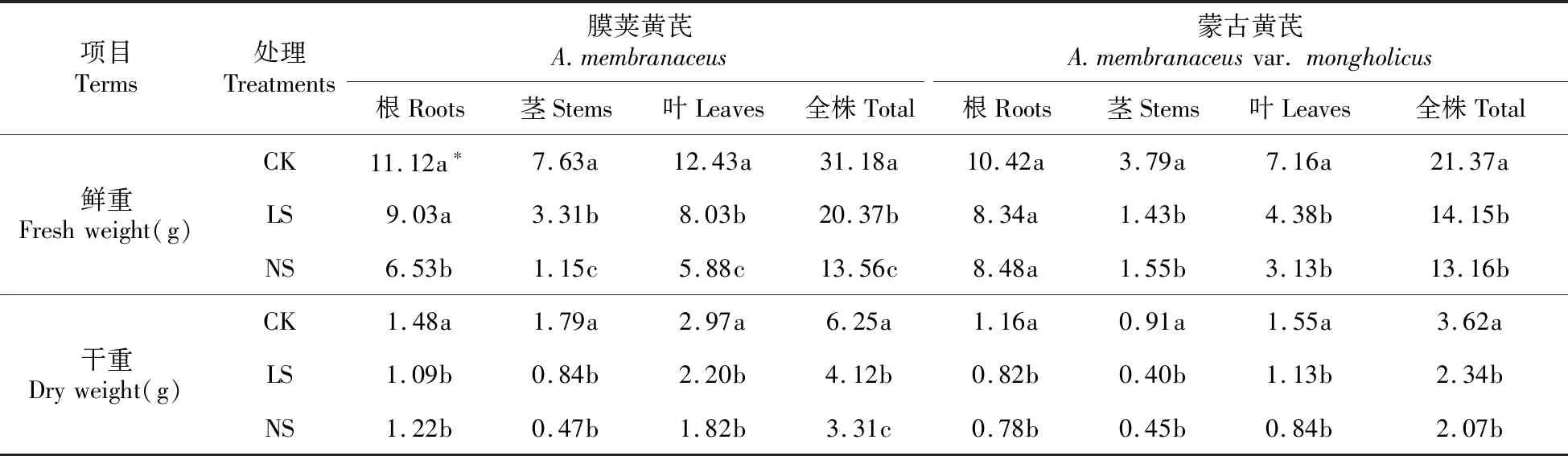
项目Terms处理Treatments膜荚黄芪A.membranaceus蒙古黄芪A.membranaceusvar.mongholicus根Roots茎Stems叶Leaves全株Total根Roots茎Stems叶Leaves全株Total鲜重Freshweight(g)CK11.12a∗7.63a12.43a31.18a10.42a3.79a7.16a21.37aLS9.03a3.31b8.03b20.37b8.34a1.43b4.38b14.15bNS6.53b1.15c5.88c13.56c8.48a1.55b3.13b13.16b干重Dryweight(g)CK1.48a1.79a2.97a6.25a1.16a0.91a1.55a3.62aLS1.09b0.84b2.20b4.12b0.82b0.40b1.13b2.34bNS1.22b0.47b1.82b3.31c0.78b0.45b0.84b2.07b
注:*小写字母不同表示同种黄芪在不同处理间指标差异显著(P<0.05),下同。
Note:*different lowercase letters indicate significant difference atP<0.05 level,the same as below.
表2 不同程度缺硫处理对膜荚黄芪和蒙古黄芪幼苗叶片叶绿素荧光参数的影响
Table 2 Effects of different degrees of sulfur deficiency on fluorescence parameters ofA.membranaceusandA.membranaceusvar.mongholicusseedlings
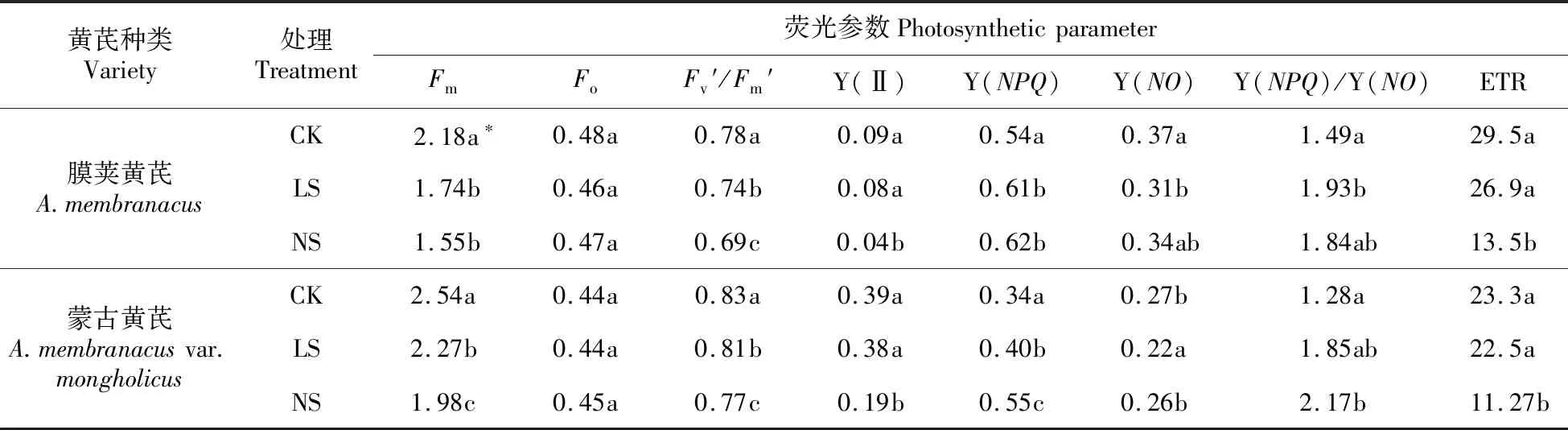
黄芪种类Variety处理Treatment荧光参数PhotosyntheticparameterFmFoFv′/Fm′Y(Ⅱ)Y(NPQ)Y(NO)Y(NPQ)/Y(NO)ETR膜荚黄芪A.membranacusCK 2.18a∗0.48a0.78a0.09a0.54a0.37a1.49a29.5aLS1.74b0.46a0.74b0.08a0.61b0.31b1.93b26.9aNS1.55b0.47a0.69c0.04b0.62b0.34ab1.84ab13.5b蒙古黄芪A.membranacusvar.mongholicusCK2.54a0.44a0.83a0.39a0.34a0.27b1.28a23.3aLS2.27b0.44a0.81b0.38a0.40b0.22a1.85ab22.5aNS1.98c0.45a0.77c0.19b0.55c0.26b2.17b11.27b
2 结果与分析
2.1 缺硫处理对黄芪幼苗形态的影响
低硫和无硫处理对膜荚黄芪和蒙古黄芪幼苗生长产生了明显的负面影响。从图1可以看出,缺硫条件下,特别是无硫条件下,两种黄芪幼苗植株高度明显变矮,复叶叶序数减少,叶片黄化,特别是老叶失绿严重,根系发生褐变现象。对处理期间黄芪幼苗根系和株高伸长生长数据分析后发现,低硫处理后,膜荚黄芪和蒙古黄芪的株高生长量和根系伸长量均显著低于对照,表明缺硫处理显著抑制了黄芪幼苗的伸长生长(见图1)。在无硫处理下,膜荚黄芪株高生长及蒙古黄芪根系伸长生长的受抑制程度进一步加强。与膜荚黄芪相比,无硫处理下蒙古黄芪地上部生长受抑制情况稍好于膜荚黄芪,其株高生长受抑制率比膜荚黄芪降低了5.61%。
2.2 缺硫处理对黄芪幼苗生物量的影响
缺硫处理除了可以抑制黄芪幼苗根系和地上部伸长生长外,还显著降低了黄芪幼苗的生物量累积水平(见表1)。从全株来看,低硫处理下膜荚黄芪幼苗鲜重和干重分别比对照降低了35.7%和34.1%,相同条件下蒙古黄芪幼苗鲜重和干重则分别降低了33.8%和35.4%。无硫处理下,蒙古黄芪幼苗生物量的受影响程度明显低于膜荚黄芪,两者的鲜重和干重分别比其对照下降了38.4%、42.8%以及56.5%和47.1%。从根、茎、叶各部分来看,不同程度缺硫处理对其生物量影响的大小顺序依次为:茎>叶>根。
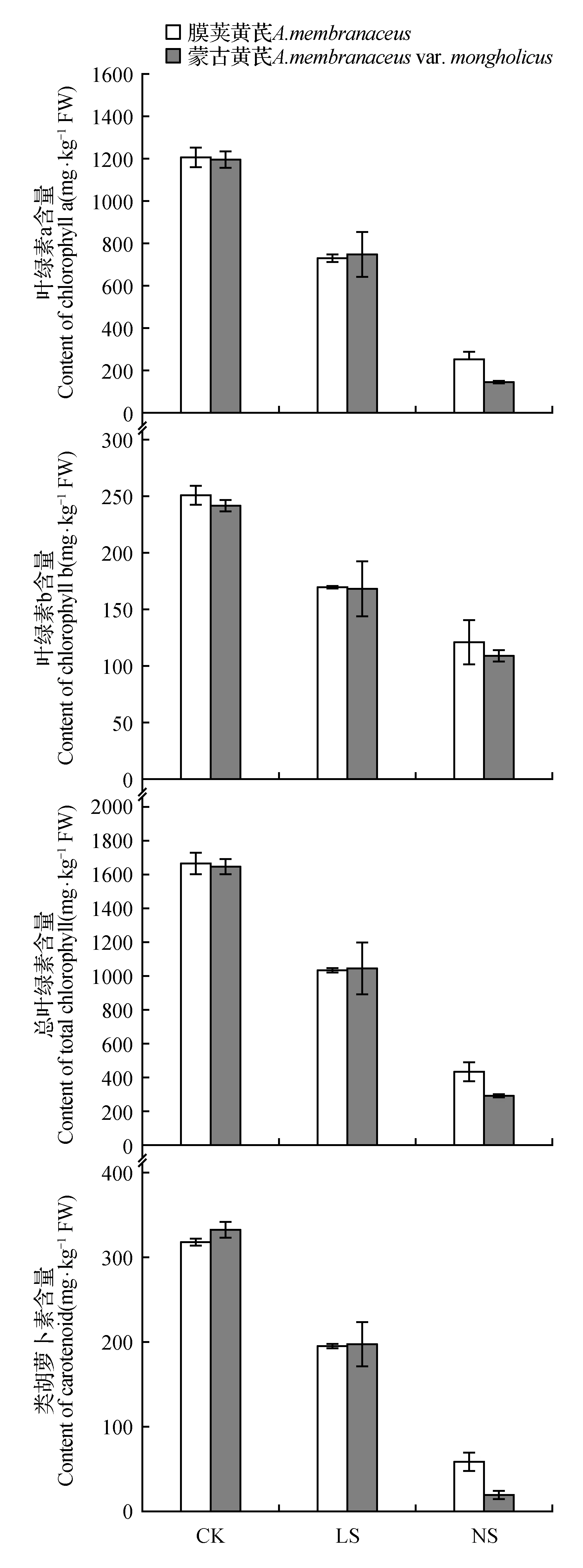
图2 不同程度缺硫处理对膜荚黄芪和蒙古黄芪叶片光合色素含量的影响Fig.2 Effects of different degrees of sulfur deficiency on photosynthesis pigment contents of A.membranaceus and A.membranaceus var. mongholicus leaves
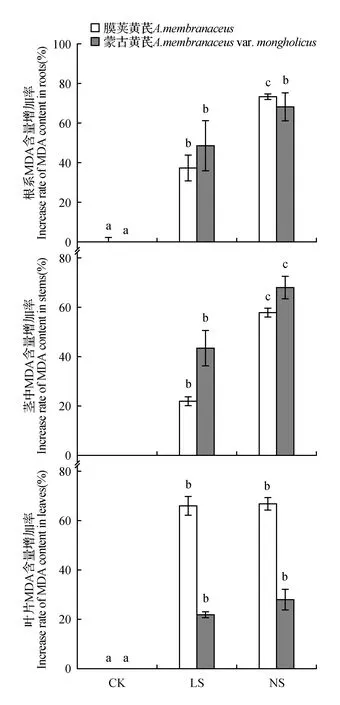
图3 不同程度缺硫处理对膜荚黄芪和蒙古黄芪幼苗丙二醛含量Fig.3 Effects of different degrees of sulfur deficiency on MDA contentsof A.membranaceus and A.membranacus var. mongholicus seedlings
2.3 缺硫对黄芪幼苗叶片光合色素含量和荧光参数的影响
缺硫处理严重影响了两种黄芪幼苗成熟叶片中光合色素的含量(见图2)。与各自对照相比,低硫处理下,膜荚黄芪和蒙古黄芪叶片中叶绿素a、叶绿素b、总叶绿素和类胡萝卜素的含量都下降了30%以上;无硫处理下,除叶绿素b外,其余光合色素含量均下降了70%以上。此外,低硫处理对两种黄芪叶片光合色素含量的影响水平相近,而无硫处理对蒙古黄芪光合色素含量的影响程度则稍大于膜荚黄芪。
缺硫处理引起了两种黄芪幼苗叶片叶绿素荧光参数的明显变化(见表2)。与正常硫供应相比,低硫处理引起了最大荧光产量Fm及光系统Ⅱ有效光化学效率Fv′/Fm′的显著降低。无硫处理除了引起上述两个荧光参数的降低外,还引起了光系统Ⅱ有效量子产量Y(Ⅱ)和电子传递速率ETR的大幅度降低,膜荚黄芪和蒙古黄芪中两个参数都比对照降低了50%以上。与上述荧光参数不同,调节性能量耗散的量子产量Y(NPQ)受缺硫处理影响而显著升高。与膜荚黄芪可以在低硫处理下提高了光保护能力Y(NPQ)/Y(NO)相比,蒙古黄芪则可以在无硫处理下更好地提高叶片在过剩光下的自我保护能力。
2.4 缺硫对黄芪幼苗膜脂过氧化水平的影响
从图3可以看出,低硫处理使得两种黄芪根、茎、叶各部位MDA含量都发生了显著升高,并且随着缺硫情况的加重,根系和茎中的MDA含量进一步增加。与对照相比,无硫条件下膜荚黄芪三个部位的MDA含量分别升高了73.5%、58.0%和67.0%。相对而言,在低硫和无硫处理后,蒙古黄芪茎中MDA含量的增加程度稍高于膜荚黄芪,而叶片中MDA含量的增加程度却都远远低于膜荚黄芪。
2.5 缺硫对黄芪幼苗总酚和总黄酮含量的影响
作为植物体内一类重要的抗氧化物质成分,酚类的合成在膜荚黄芪和蒙古黄芪根、茎和叶中均受到了缺硫处理的严重抑制(见表3)。在蒙古黄芪中,低硫处理即使得其根、茎、叶中的总酚含量分别降低了43.2%、49.8%和42.3%,在无硫情况下三个部位总酚含量进一步下降。与蒙古黄芪相似,低硫和无硫处理也引起了膜荚黄芪根、茎和叶三个部位总酚含量的显著降低,但其降低程度均稍低于蒙古黄芪。
表3 不同程度缺硫处理对膜荚黄芪和蒙古黄芪幼苗总酚和总黄酮含量的影响
Table 3 Effects of different degrees of sulfur deficiency on total phenol and flavonoid contents ofA.membranaceusandA.membranacusvar.mongholicusseedlings

项目Term处理Treatment膜荚黄芪A.membranaceus蒙古黄芪A.membranacusvar.mongholicus根Roots茎Stems叶Leaves根Roots茎Stems叶Leaves总酚Totalphenols(μg·g-1FW)CK1053a∗2386a4147a1855a2345a3417aLS939ab1730b3189b1053b1178b1970bNS793b1417c2261c741c1032c1065c总黄酮Totalflavonoids(μg·g-1FW)CK373b426a452a256a133a598aLS471a234b366b171b215b427bNS295c176c285c113c319c258c
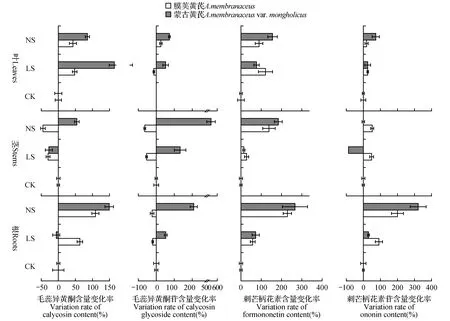
图4 不同程度缺硫处理对膜荚黄芪和蒙古黄芪4种异黄酮成分含量的影响Fig.4 Effects of different degrees of sulfur deficiency on contents of the four isoflavones in A.membranaceus and A.membranacus var. mongholicus seedlings
黄酮类物质是一类以2-苯基色原酮为框架的多酚。我们发现,在缺硫条件下,其在黄芪幼苗各部位的合成和积累也受到了与酚类相似的影响(见表3)。与酚类不同的是,低硫情况下膜荚黄芪根系中总黄酮含量出现了升高情况。此外,无论是低硫还是无硫处理,蒙古黄芪茎中黄酮含量均出现了明显升高,并且无硫条件下其升高幅度更大。与对照相比,无硫处理下蒙古黄芪茎中黄酮含量升高了近1.4倍。
2.6 黄芪4种黄酮类活性成分积累水平
毛蕊异黄酮、刺芒柄花素及其苷类是黄芪中重要的异黄酮类物质。从图4可以看出,在叶片中,与总黄酮的变化规律不同,缺硫处理引起了毛蕊异黄酮和刺芒柄花素含量的普遍升高,而且除低硫条件下刺芒柄花素外,不同情况缺硫时蒙古黄芪叶片中4种异黄酮的升高幅度均明显高于膜荚黄芪。在茎中,膜荚黄芪毛蕊异黄酮及其苷类的含量在缺硫条件下显著降低,刺芒柄花素及其苷类的含量则与此相反。值得注意的是,无硫条件下蒙古黄芪茎中毛蕊异黄酮苷的含量出现了急剧升高,与对照相比,其含量升高了4倍以上。在膜荚黄芪根系中,除了毛蕊异黄酮苷含量受缺硫诱导有所降低外,其余3种异黄酮含量均受缺硫诱导而明显升高;在蒙古黄芪根系中,除低硫处理下毛蕊异黄酮含量稍有降低外,所有异黄酮含量都因缺硫处理而升高,而且在无硫处理下毛蕊异黄酮和刺芒柄花素苷含量的升高幅度均大于膜荚黄芪。
3 讨论
硫是植物生长发育所必需的营养元素,是构成氨基酸和蛋白质的重要组分,也是多种生物酶的活性中心[19]。缺硫条件下植物的生长发育会受到阻碍,出现叶片失绿、植株矮小、根系不发达[20~21]。豆科植物是需硫量较高的植物,因此对硫缺乏的反应比较敏感。在本研究中,膜荚黄芪及其变种蒙古黄芪在缺硫条件下根系和地上部伸长生长受到严重抑制,鲜重和干重明显降低,叶片失绿明显,表明实验所设的缺硫条件显著影响了两种黄芪的生长发育。硫酯是叶绿体膜的重要组分之一,硫代谢与叶绿素的关系非常密切,缺硫能使植物叶绿素含量降低,光合作用下降[22],这也是缺硫引起植物生长受阻的重要原因。我们发现,缺硫胁迫下两种黄芪叶片所有光合色素含量均出现了大幅下降,特别是无硫处理后绝大多数光合色素含量下降了70%以上。光合色素含量的下降使得捕获和传递给PSⅡ反应中心的光能减少,引起植株净光合速率降低[23]。与此相一致,本实验中低硫和无硫处理下两种黄芪最大荧光产量Fm、光系统Ⅱ有效光化光效率Fv′/Fm′、有效量子产量Y(Ⅱ)和电子传递速率ETR均出现了明显下降。有研究认为,缺硫导致的包括半胱氨酸和铁硫中心等含硫蛋白的合成受阻,是缺硫引起ETR下降的主要原因[23]。
不同植物种类抵抗缺硫胁迫的能力不同,比如杨树抵抗缺硫胁迫的能力强于十字花科植物[24]。本研究中,在缺硫特别是无硫条件下,蒙古黄芪地上部生长、全株生物量等方面明显优于膜荚黄芪,表明蒙古黄芪比膜荚黄芪对缺硫胁迫表现出了更强的抵抗能力。在水稻中,发现无硫条件下调节性能量耗散的量子产量,研究者认为非光化学能量耗散有助于保护PSⅡ,是水稻植株适应缺硫胁迫的一种生理机制[25]。我们的实验结果显示,在低硫或无硫处理下,两种黄芪调节性能量耗散的量子产量Y(NPQ)以及光保护能力Y(NPQ)/Y(NO)都高于对照,而蒙古黄芪在无硫条件下的光保护能力更为明显,表明非光化学能量耗散能力的提高可能是蒙古黄芪更好适应缺硫胁迫的一个重要原因。较高的光保护能力可以有效减少缺硫胁迫下因光电子传递效率超氧阴离子降低而引起的活性氧产生[26],从而减轻了缺硫胁迫诱导的蒙古黄芪叶片膜脂过氧化水平。此外,我们还发现缺硫胁迫引起了蒙古黄芪茎中总黄酮以及全株各部位4种主要异黄酮成分含量的显著升高,这与我们之前研究中发现黄芪在面对镉胁迫时也会大量积累异黄酮成分相一致[27]。在此前的研究中,有研究者发现缺硫处理引起了拟南芥和水稻植株中黄酮类物质的积累,并且推断这些黄酮类物质在抵抗缺硫引起的氧化胁迫中具有积极作用[28~29]。因此,我们推断蒙古黄芪中黄酮类物质合成的增加可能在提高其对缺硫胁迫适应能力中发挥了重要作用。
综上所述,缺硫胁迫通过减少黄芪幼苗叶绿素含量、降低光合效率以及提高细胞膜脂过氧化水平等途径阻碍了黄芪幼苗的生长发育,引起了黄芪幼苗的缺硫胁迫反应。蒙古黄芪相比膜荚黄芪表现出了较强的缺硫适应能力,主要机制包括提高缺硫胁迫下叶片光保护能力以及主要异黄酮成分大量合成积累等。
