毛果杨固有无序蛋白质基因克隆及胁迫响应分析
2020-07-14董实伟杨宇宁王乃锐张含国李淑娟
董实伟 杨宇宁 王乃锐 张含国 李淑娟
(林木遗传育种国家重点实验室,东北林业大学,哈尔滨 150040)
毛果杨(Populustrichocarpa)别名测序杨为杨属青杨派植物,其中Nisqually-1基因型(雌株)是第一个有完整基因组注释的木本植物,2006年其测序结果已公布[1]。Nisqually-1的组织培养技术已被广泛使用,并已建立完整高效的遗传转化体系[2],因此毛果杨已成为研究树木生物学、比较基因组学和环境互作组学系统的模式物种[3]。
固有无序蛋白质(Intrinsically disordered proteins)简写为IDPs,是一类在天然状态下整体或局部不折叠,缺乏稳定三维结构,但能够正常行使生物学功能的蛋白质[4],它普遍存在于蛋白质组中,参与信号转导、转录调控、胁迫应答等一系列生物学过程[5]。固有无序蛋白质和有序蛋白质的氨基酸残基组成上有明显不同,主要体现在氨基酸的组成及理化性质等方面的差异[6~7]。例如,有些残基有利于形成稳定的疏水中心进而折叠形成有序结构,这些氨基酸被称为“促有序”氨基酸;与之相反,某些残基阻碍蛋白质分子形成稳定的疏水核心和后续的折叠,无序结构中极性和带电的氨基酸被称之为“促无序”残基[8~9]。另外,IDPs中氨基酸序列的复杂度较低,重复度较高,因此,IDPs的结构呈现一种松散的状态,高度动态可变[10~11]。在发现初期许多固有无序蛋白质被认为并没有什么功能,直到20世纪初证实了近100种蛋白质是固有无序蛋白质,无序蛋白质才成为研究领域关注的焦点[12]。Du等通过盐胁迫对拟南芥中的ST6-66和ST255基因分离及耐盐性分析,发现At1G13930基因敲除突变体对盐胁迫超敏感[13],Rocco等利用低温4℃和高温42℃对拟南芥进行处理,从而鉴定出38个蛋白差异位点,其中At1G13930蛋白在低温和高温处理时,与其他蛋白点相比较变化最大,研究表明At1G13930蛋白在温度胁迫中可能起着至关重要的作用[14]。其他研究也证实植物中许多逆境响应蛋白均是固有无序蛋白质[15~17]。
为深入了解毛果杨固有无序蛋白质的功能,本研究以毛果杨野生型植株为材料,克隆并获得PtrIDP1(Potri.010G161200.1)的cDNA全长序列,采用生物信息学方法对其序列特征及编码蛋白结构等方面进行预测分析,瞬时转化洋葱表皮细胞进行亚细胞定位分析,同时对该基因在毛果杨不同组织中的表达特异性及不同类型非生物胁迫下的表达特性进行分析,旨在为后续探究该基因的功能及其在毛果杨生长发育过程中的作用奠定基础。
1 材料与方法
1.1 试验材料及主要试剂
试验材料:供试植物-Nisqually-1基因型的毛果杨野生型组培苗,在林木遗传育种国家重点实验室(东北林业大学)温室培养,室内温度25±2℃。光照强度为80 μmol·m-2·s-1),长日照培养。
主要试剂:cDNA反转录试剂盒购于百泰克公司;PCR酶KOD FX购于东洋纺(上海)生物科技有限公司;琼脂糖凝胶DNA回收试剂盒和质粒小提试剂盒等购于天根公司;限制性内切酶和T4DNA连接酶购于赛默飞世尔科技公司。
1.2 试验方法
1.2.1 毛果杨总RNA的提取与反转录
选取生长状态良好且长势一致、苗龄30 d的毛果杨组培苗全株,经无菌水洗净后,液氮研磨成粉末,采用CTAB法提取植株总RNA,用超微量紫外分光光度计检测RNA的浓度和纯度,用1%琼脂糖凝聚胶电泳检测RNA的完整性。以上述得到的RNA为模板,根据cDNA反转录试剂盒的操作说明进行试验,合成cDNA第一链,于-20℃保存。
1.2.2 引物设计及目的基因克隆
从Phytozome数据库中获取毛果杨PtrIDP1基因的全长序列,采用Primer5.0软件设计引物(见表1),引物由哈尔滨市擎科嘉美生物科技有限公司合成。以cDNA为模板,利用KOD-FX PCR酶进行PCR扩增。PCR反应体系(50 μL):ddH2O 10 μL,2x PCR buffer for KOD FX 25 μL,2 mmol·L-1dNTPs 10 μL,上下游引物各1.5 μL,模板cDNA 1 μL,KOD FX 1 μL。扩增条件:94℃,2 min;98℃,10 s,58℃,30 s,68℃,30 s,35个循环;68℃,10 min;16℃保温。1.5%琼脂糖凝胶电泳对扩增产物进行检测并对目的片段进行回收,将回收产物与pROK-Ⅱ载体连接,并转入到大肠杆菌DH5α感受态细胞中,37℃过夜培养后挑取单菌落进行PCR检测,将条带位置正确的菌株送至生工生物工程(上海)有限公司测序。

表1 引物序列
1.2.3 PtrIDP1基因的生物信息学分析
使用在线工具CLUSTALW将获得的核苷酸和氨基酸序列与NCBI中已登录的12种植物序列进行比对和同源性分析,结合MEGA 5.0软件构建系统进化树,并对蛋白进行理化性质、跨膜区预测、亲水性疏水性、二级结构与三级结构分析(见表2)。
表2 生物信息学分析网站及软件
Table 2 Softwares and websites for bioinformatics analysis

功能Function软件及网址Softwareandwebsite蛋白质理化性质Physicochemicalpropertiesofproteinhttp://web.expasy.org/protparam/跨膜区预测Transmembraneregionanalysishttp://www.cbs.dtu.dk/services/TMHMM亲水性疏水性预测Pro/hydrophobicanalysishttps://web.expasy.org/protscale/蛋白二级结构Secondarystructureofproteinhttps://npsa-prabi.ibcp.fr/蛋白三级结构Tertiarystructureofproteinhttps://www.swissmodel.expasy.org/同源多序列比对Homologousmultiplesequencealignmenthttps://www.genome.jp/tools-bin/clustalw系统进化树PhylogenetictreeMEGA5.0
1.2.4 PtrIDP1蛋白亚细胞定位
为了研究PtrIDP1蛋白的亚细胞定位,克隆无终止密码子的全长PtrIDP1 CDs序列,将其连接到pGWB5载体上,构建35s::PtrIDP1-GFP融合表达载体,35s::GFP用作对照,利用基因枪转化法,分别将35s::GFP与35s::PtrIDP1-GFP融合表达载体转入洋葱表皮细胞,暗培养36~48 h后利用激光共聚焦显微镜观测拍照。
1.2.5 PtrIDP1基因的组织特异性表达检测
根据基因序列设计特异定量引物,以PtrActin为内参设计引物actin-F及actin-R(见表1),进行QRT-PCR分析。体系如下:2×TransStart® TOP/Tip Green qPCR Supermix 10 μL、PtrIDP1-QF/QR混合引物(10.0 μmol·L-1)0.4 μL、cDNA 1.5 μL,Passive Reference Dye(50×)0.4 μL,加ddH2O至20 μL。PCR反应程序如下:94℃ 30 s;94℃ 5 s,60℃ 15 s,72℃ 35 s,40次循环;95℃ 15 s,60℃ 1 min,95℃ 30 s。每个样品进行3次生物学重复,利用2-ΔΔCT法进行数据处理。
1.2.6PtrIDP1基因在不同类型非生物胁迫下的表达特性分析
选取30 d苗龄长势一致的毛果杨植株分别进行盐胁迫(200 mmol·L-1NaCl溶液)和干旱胁迫(40%的PEG溶液)处理,并分别于处理0、6、12、24、48、72 h后进行取材。以野生型毛果杨的根、茎和叶为材料提取总RNA,反转录合成cDNA后,以PtrIDP1-QF/QR为引物,PtrActin为内参,试验重复3次,对研究结果进行qRT-PCR分析。
2 结果与分析
2.1 PtrIDP1基因克隆
提取的RNA经1%琼脂糖凝胶电泳检测,28s RNA、18s RNA条带明显,5s RNA条带呈微弱弥散状(见图1A),结果表明提取的总RNA质量完好,可用于后续试验。
以毛果杨的cDNA为模板,采用特异性引物对PtrIDP1基因序列进行扩增,扩增产物经1%琼脂糖凝聚胶电泳检测,结果显示与预期目的片段423 bp大小基本一致(见图1B),条带清晰且无明显拖尾。将菌液送至生工生物工程(上海)有限公司测序,结果表明:该基因克隆成功,命名为PtrIDP1,可以进行后续操作。

图1 毛果杨总RNA(A)和扩增产物电泳图(B)Fig.1 The electrophoresis of Total RNA in P.trichocarpa(A) and PCR production of PtrIDP1(B)
2.2 PtrIDP1基因生物信息学分析
2.2.1 蛋白质的一级结构分析
通过ExPAsy分析显示,毛果杨PtrIDP1基因蛋白分子式为C630H1009N179O217S3,完整的CDs区序列长度为423 bp,共编码140个氨基酸(见图2)。预测其蛋白分子量为14.659 19 kD,理论等电点(pI)为5.58,脂溶指数为58.71,总平均亲水系数为-0.716,不稳定系数为29.60,说明该蛋白为稳定的酸性亲水蛋白(见图3),对PtrIDP1跨膜结构域进行分析,结果表明PtrIDP1基因所编码的蛋白质具有跨膜结构域,为跨膜蛋白(见图4)。

图2 PtrIDP1基因序列及氨基酸序列Fig.2 The nucleotide and amino acid sequences of PtrIDP1

图3 PtrIDP1蛋白的亲/疏水性分析预测Fig.3 Pro/hydrophobic analysis of PtrIDP1 protein

图4 PtrIDP1蛋白的跨膜区域分析预测Fig.4 Transmembrane region Analysis of PtrIDP1 protein

图5 PtrIDP1蛋白二级结构预测Fig.5 Prediction of secondary structure of PtrIDP1 protein
2.2.2 蛋白质的二级结构预测分析
采用在线软件SOPMA对毛果杨PtrIDP1蛋白的二级结构组成进行预测分析,结果表明,蛋白质二级结构主要包含α-螺旋65个,占46.43%,β-折叠2个,占1.43%,无规则卷曲73个,占52.14%(见图5)。
VL-XT预测结果显示,在PtrIDP1的蛋白质中存在3个无序区,无序氨基酸残基共78个,分别是1-26、38-52、88-124位氨基酸组成,这些氨基酸的score>0.5。PtrIDP1蛋白的全序列中有3个区中氨基酸的组成趋向于形成有序结构(1,2,3),这3个区域可能是无序蛋白中的有序结合位点。PtrIDP1蛋白质具有无序特征(见图6)。
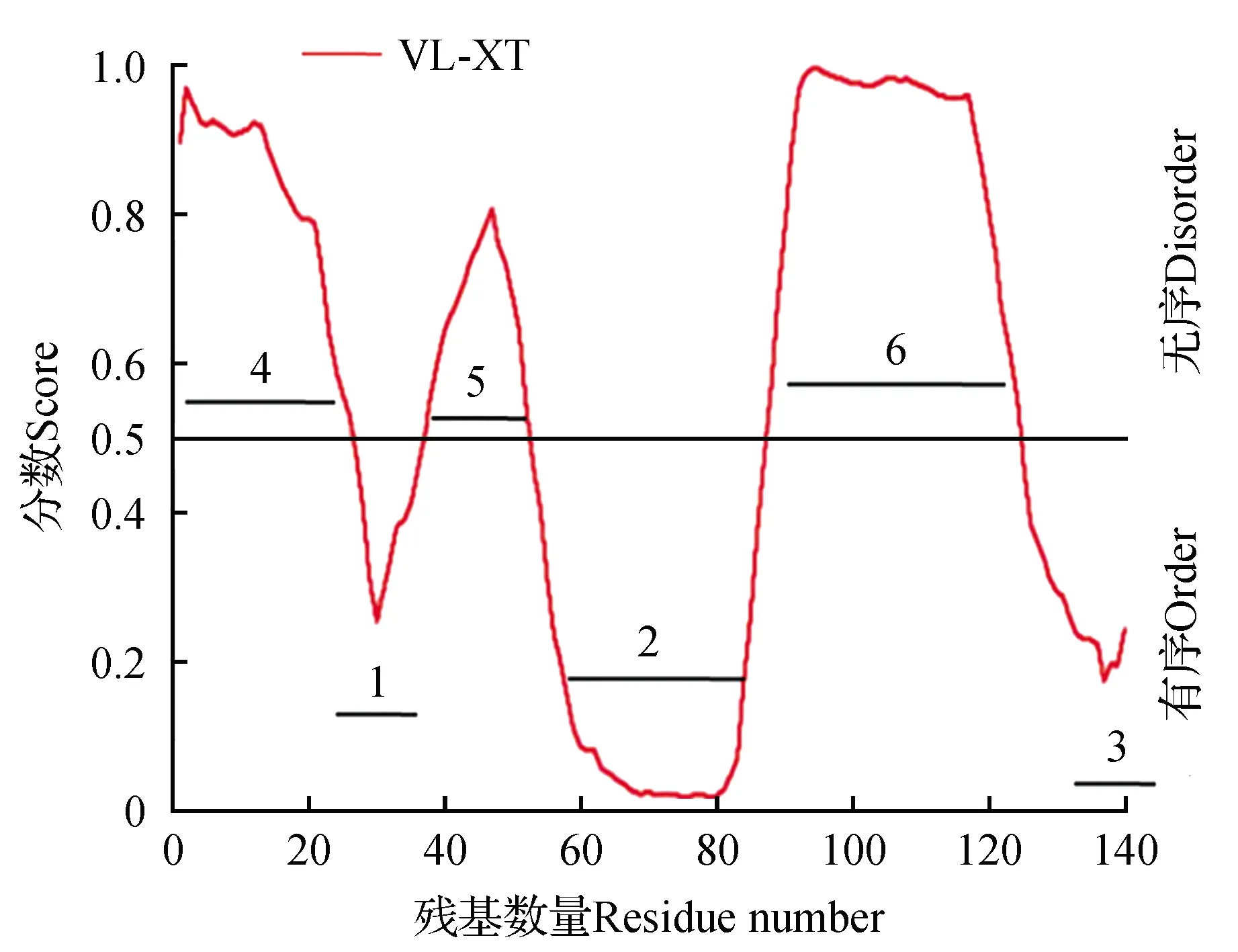
图6 PtrIDP1蛋白质无序预测Fig.6 Disorder prediction of PtrIDP1 protein
图7 蛋白质三级结构预测 A,D.蛋白三级结构正面图;B,E.蛋白三级结构侧面图;C,F.三级结构背面图Fig.7 Prediction of tertiary structure of PtrIDP1 protein A,D.Represent the front view of the protein tertiary structure; B,E.Represent the side view of the protein tertiary structure; C,F.Represent the rear view of the protein tertiary structure

图8 不同植物PtrIDP1蛋白系统进化树分析Fig.8 Phylogenetic analysis of PtrIDP1 from different plants

图9 PtrIDP1蛋白的亚细胞定位 A~B,E~F.35s::GFP对照;C~D,G~H.35s::PtrDP1-GFP融合蛋白Fig.9 Subcellular location of PtrIDP1 protein A-B,E-F.35s::GFP ontrol;C-D,G-H.35s::PtrDP1-GFP fusion protein
2.2.3 蛋白质三级结构预测
采用SWISS-MODEL工具,运用同源建模法对PtrIDP1基因编码的蛋白质进行三级结构建模,由于无序蛋白质三级结构并不稳定,所以预测结果显示两种不同的构象(见图7)。
2.2.4 基因的同源性分析及进化树分析
利用MEGA5软件构建该蛋白的系统发育进化树(见图8),结果显示,在候选的12种不同植物中,毛果杨与胡杨亲缘关系较近。
2.3 PtrIDP1蛋白亚细胞定位
利用激光共聚焦显微镜观察拍照结果显示:对照35s::GFP在细胞核与细胞质中均检测到GFP荧光信号,而35s::PtrIDP1-GFP融合蛋白仅在细胞核中检测到GFP信号,且与细胞核特异性染料DAPI染色位置一致(见图9)。上述结果表明PtrIPD1定位于细胞核。
2.4 基因的表达特性
以毛果杨根、茎、叶分别为模板,通过qRT-PCR检测分析PtrIDP1在毛果杨不同部位的相对表达量(见图10)。结果显示,PtrIDP1在叶片和茎中高度表达,在叶片中的表达量是根部表达量的27倍。
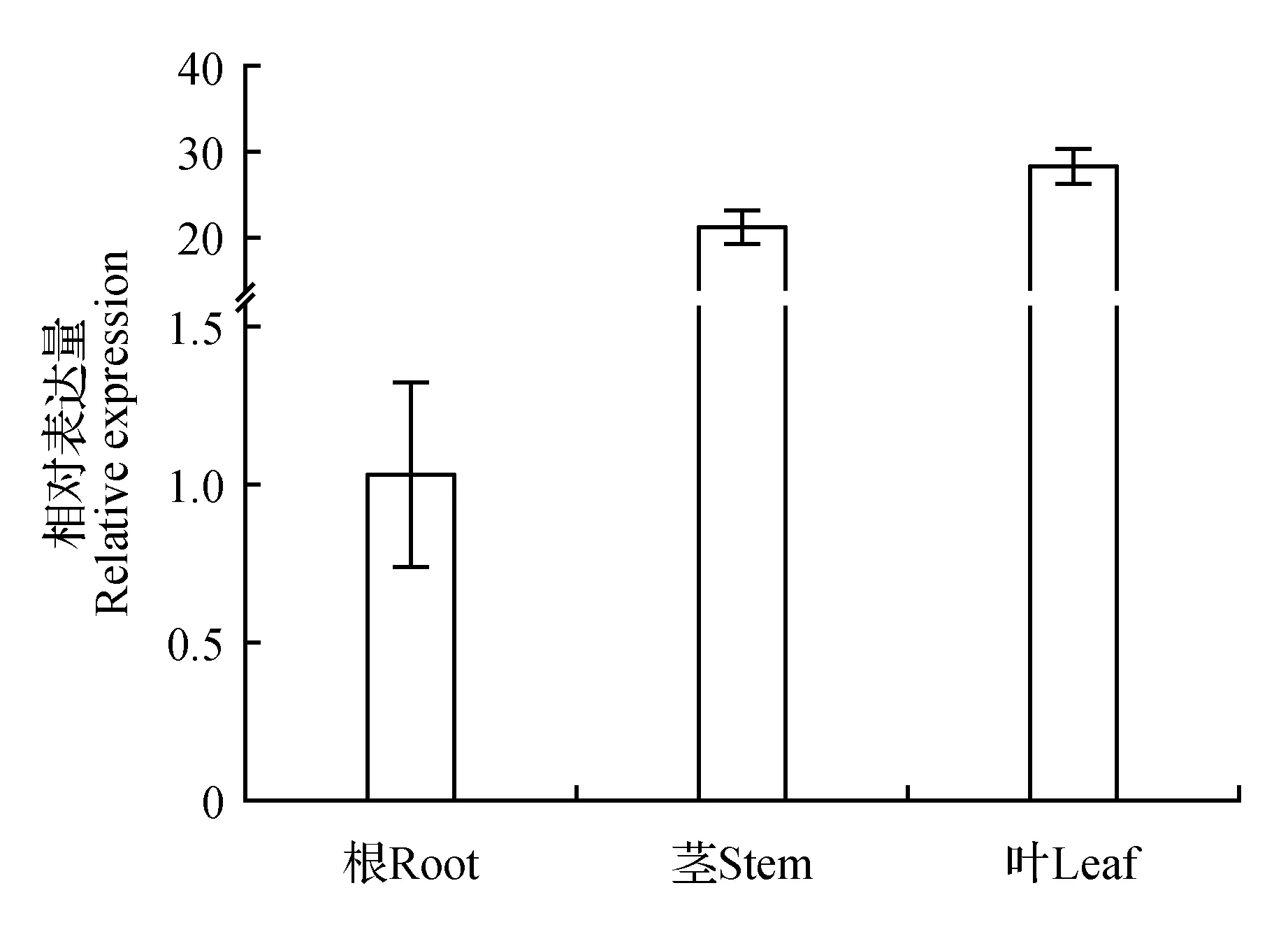
图10 PtrIDP1基因组织特异性表达分析Fig.10 Tissue specific expression analysis of PtrIDP1

图11 NaCl胁迫处理下PtrIDP1在毛果杨根、茎、叶中的相对表达量Fig.11 Relative expression of PtrIDP1 in root,stem and leaf of P.trichocarpa under NaCl stress(**P<0.01)

图12 PEG胁迫处理下PtrIDP1在毛果杨根、茎、叶中的相对表达量Fig.12 Relative expression of PtrIDP1 in root,stem and leaf of P.trichocarpa under PEG stress(**P<0.01)
为分析毛果杨PtrIDP1对非生物胁迫的表达模式,我们分别对200 mmol·L-1NaCl和40% PEG-6000两种逆境胁迫条件下毛果杨根、茎、叶组织中该基因的表达情况进行分析。在NaCl胁迫处理后,毛果杨根中PtrIDP1基因表达量呈先升高后降低的趋势,在6 h时表达量达到最高,是对照的2.4倍;茎中PtrIDP1基因在所有时间点均为下调表达,在48 h表达量最低,是对照的0.1倍;叶中该基因表达量在0~24 h内基本持平,然后出现迅速降低、再升高的趋势,72 h时达到最高(见图11)。由此可见根部对高盐胁迫反应更敏感;在PEG干旱胁迫下,毛果杨根和茎部PtrIDP1基因在所有时间点均表现为下调表达,其中根部在6 h时表达量最低,仅为对照的0.2倍,而茎部在12 h表达量最低,仅为对照的0.06倍;而在叶中该基因在胁迫12 h以内的表达量与对照基本持平,在24 h时表达量达到最高,是对照的1.4倍,然后呈逐渐降低的趋势(见图12),可见在干旱胁迫时叶片的胁迫响应更敏感。
3 讨论
干旱、高盐、低温、高温等极端条件,是植物生长过程中所面临的主要逆境因素[18~19]。在逆境条件下,许多植物中所特有的IDPs对抵抗逆境胁迫发挥了重要作用[8~11]。本研究从毛果杨中克隆得到了PtrIDP1基因,选取了胡杨等13种植物的基因序列进行多序列比对及进化树分析,结果显示:毛果杨PtrIDP1与胡杨氨基酸相似性最高。
PtrIDP1是植物中特有的固有无序蛋白质,在拟南芥中被称为At1G13930,At1G13930具有一定的组织特异性,在根尖、花药、柱头组织不表达,在生长点表达量较高,在叶中定位在保卫细胞中,逆境胁迫下At1G13930参与气孔的发育及调节[11]。本研究中PtrIDP1基因的亚细胞定位观察显示,该基因定位在洋葱表皮细胞的细胞核内。通过RT-PCR对PtrIDP1基因在毛果杨不同组织部位的表达特异性进行了全面分析,结果表明,PtrIDP1在毛果杨根、茎、叶中都有表达,其中,在叶和茎中表达量相对较高,在根中表达量相对较低。该基因在叶片中高度表达,揭示PtrIDP1基因可能与叶片的光合作用或者气孔的发育及调节相关,在茎段中高度表达,预示PtrIDP1可能与植物生长发育相关。
PtrIDP1基因不仅具有组织特异性,而且能够被逆境胁迫诱导表达。例如,拟南芥在逆境胁迫下,发现该基因所编码的蛋白与低温、高温及高盐等非生物胁迫相关[10~11]。Rocco等利用低温4℃和高温42℃对拟南芥进行处理,发现该基因所编码的蛋白在低温和高温处理时,与其他蛋白点比较变化最大,暗示该基因在温度胁迫中可能起着至关重要的作用[14]。在本研究中,毛果杨在NaCl(高盐)和PEG(干旱)胁迫下,PtrIDP1基因表达量的变化趋势有所不同。在NaCl胁迫下,毛果杨根中的表达量明显上调,胁迫6 h时是对照的2.4倍,而在茎中是明显下调表达,在叶中24 h之前的表达量变化不显著,这说明毛果杨根部对盐胁迫更敏感,茎中通过该基因的下调表达来应对盐胁迫,叶组织在胁迫48 h之后才做出盐胁迫应答;在PEG胁迫下,毛果杨根和茎部在所有时间点均表现为下调表达,根部在6 h时表达量最低,是对照的0.2倍,而茎部在12 h表达量最低,是对照的0.06倍;而在叶中的表达量与对照基本持平,在24 h时表达量达到最高,是对照的1.4倍,可见叶片对干旱胁迫的响应更快。初步分析认为,毛果杨PtrIDP1基因的表达可能参与盐胁迫和干旱胁迫的应答。PtrIDP1基因在响应高盐和干旱胁迫过程中的调控途径及作用机制还有待进一步分析和验证。
