白藜芦醇脂质载体制备及体外抗氧化活性测定
2020-07-14王欣宇李弘琨赵雪莲于雪莹付玉杰
王欣宇 李弘琨 于 良 赵雪莲 于雪莹 付玉杰*
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040;2.东北林业大学林业生物制剂教育部工程研究中心,哈尔滨 150040;3.东北林业大学化学化工与资源利用学院,哈尔滨 150040)
白藜芦醇,又称芪三酚,是一种天然的二苯乙烯类化合物,在葡萄、花生、虎杖等植物中都有存在[1],具有抗肿瘤、抗菌、抗衰老、保护心血管、抗氧化等多种活性[2~5]。但是白藜芦醇属于脂溶性物质,基本不溶于水,在水中的溶解度只有0.3 mg·L-1[6]。水溶性差和易氧化等不稳定的理化性质都对白藜芦醇的生物利用度有很大的影响,因此,近年来人们尝试使用微纳米载体技术包裹白藜芦醇,以解决其应用上现存的一些问题。
微纳米载体技术可以保护活性成分,增强其稳定性,使其便于运输贮藏。脂质作为生物活性成分的载体在脂溶性生物活性成分的传递体系中得到普遍的认同,以脂质作为微纳米载体的基础,其良好的生理性质使微纳米载体系统尺寸可以缩小到微米或亚微米,制备工艺简单,也容易放大生产,可以使亲脂性化合物的生物利用度大大提高[7]。
现在纳米结构脂质载体(NLC)是常用于医药、食品和化妆品等领域的一种微纳米载体系统,是第二代脂质纳米粒,是在传统固体脂质纳米粒和油/水型乳状液的基础上发展起来的[8~10],它由固态脂质和液态脂质的混合物构成,在常温下也呈现固态。固态脂质在加入液态脂质后产生晶格缺陷,其结晶形式发生变化,要包裹的活性成分可以被容纳其中,使其负载量升高[11],同时又避免了活性成分在传统体系运输贮藏过程中可能发生的渗漏现象。纳米结构脂质载体已经在医药领域及化妆品行业得到广泛的应用[12~13]。
1 材料与方法
1.1 主要材料
白藜芦醇、油酸、单硬脂酸甘油酯、吐温80、硬脂醇、月桂醇硫酸钠、白凡士林、甘油、橄榄油、羟苯甲脂、LO2细胞等。
1.2 主要仪器
YP2002型分析天平;HH-2型数显恒温水浴锅;Ultra-Turax T25型超高速电子搅拌机;SIM细胞培养箱;NANO高压微射流均质仪;DL-CJ-2N生物洁净工作台;Zetasizer Nano ZS90型粒度仪;Milli-Q型纯水仪;CytoFLEX流式细胞仪等。
1.3 实验方法
1.3.1 高压均质法制备白藜芦醇脂质载体
本研究中选择溶剂高压均质法作为制备白藜芦醇纳米结构脂质载体的方法。首先以溶解度为指标,对脂质进行筛选,将筛选出的的固态脂质和液态脂质混合,控制水浴温度高于固态脂质熔点5~10℃,将混合脂质熔化后混匀。再使用高速剪切分散机在1 000 r·min-1的条件下将一定量的白藜芦醇加入混合脂质中形成油相。水相即为在相同的水浴温度下混匀的乳化剂和去离子水。之后使用高速剪切分散机在1 000 r·min-1的条件下将混匀的水相用注射器匀速、缓慢地加入相同温度的油相中,搅拌5分钟,这样就形成了初乳[14],之后选择合适的条件进行高压均质,即得到白藜芦醇纳米结构脂质载体。
脂质的筛选:称取2 g脂质置于圆底烧瓶中,在75℃的水浴锅中以800 r·min-1的速度进行磁力搅拌,加入2 mg白藜芦醇搅拌一定时间,若白藜芦醇溶解完全,则继续加入白藜芦醇,直至其不能完全溶解或冷却后会出现结晶,选择溶解能力较好的脂质[15]。
1.3.2 包封率的测定
超滤离心法:取白藜芦醇纳米脂质载体加入1%十二烷基硫酸钠(SDS),超声处理,使游离药物充分溶解,再将混合溶液加到截留分子量为100 kD的超滤离心管中,10 000 r·min-1离心10 min,取滤液用流动相稀释,液相检测;取等量白藜芦醇纳米脂质载体,加入甲醇,超声处理使其破乳,进而测定总药物含量。药物包封率计算公式如下:
EE%=(Wtotal-Wfree)/Wtotal×100%
(1)
式中:Wtotal为总药物含量,Wfree为未包裹药物含量。
色谱条件为甲醇∶0.3%磷酸水=65∶35(流动相),柱温25℃,流速1.0 mL·min-1,在306 nm条件下检测。
1.3.3 MTT法检测白藜芦醇和白藜芦醇脂质载体对细胞的影响
用10%的细胞培养基对LO2细胞进行稀释,使细胞的数量为1×105mL。将100 μL细胞培养液加入96孔板,培养24 h后将培养液吸出,将白藜芦醇和白藜芦醇脂质载体用稀释培养基稀释到规定浓度后加入,体积为100 μL。置于37℃、5% CO2培养箱中培养24 h。待细胞处理完毕后,向每孔加入5 mg·mL-1MTT 20 μL,再放入培养箱培养4 h,把上清液吸出后向每个孔中加入100 mL DMSO,把孔板置于微型振荡器中轻微震荡10 min后在570 nm处对每个孔的吸光值进行测定。至少进行3次重复实验。细胞生长抑制率计算公式如下:
细胞生长抑制率(%)=(OD加药组/OD对照组)×100%
(2)
1.3.4 流式细胞仪检测白藜芦醇脂质体清除ROS能力
用10%的细胞培养基稀释处于对数生长期的LO2细胞,使细胞的浓度为1×106mL。向6孔板加入2 mL细胞液,在37℃、5% CO2的条件下培养24 h,药物保护组分别加入浓度为50 μmol·L-1的白藜芦醇和白藜芦醇脂质载体,在空白组和H2O2模型分别加入DMEM溶液,置于培养箱中培养12 h,在除空白组以外的其他各组中均加入浓度为600 μmol·L-1的H2O2,孵育12 h。待细胞经药物处理完毕后,向各组细胞中加入已配置好的DCFH-DA溶液,37℃细胞培养箱内再放置20 min。每隔几分钟轻轻摇晃使其充分混匀,待处理完毕后用不含血清的细胞培养液洗涤细胞3次后,用流式细胞仪进行检测。
2 结果与分析
2.1 高压均质法制备白藜芦醇脂质载体
2.1.1 脂质和乳化剂的筛选
本实验的评价指标为脂质对白藜芦醇的溶解度,结果见表1。本实验筛选了实验室常见的固态脂质、液态脂质各3种,试验结果表明,白藜芦醇在单硬脂酸甘油酯和油酸中溶解度较好,因此,本实验采用单硬脂酸甘油酯为固态脂质,油酸为液态脂质。
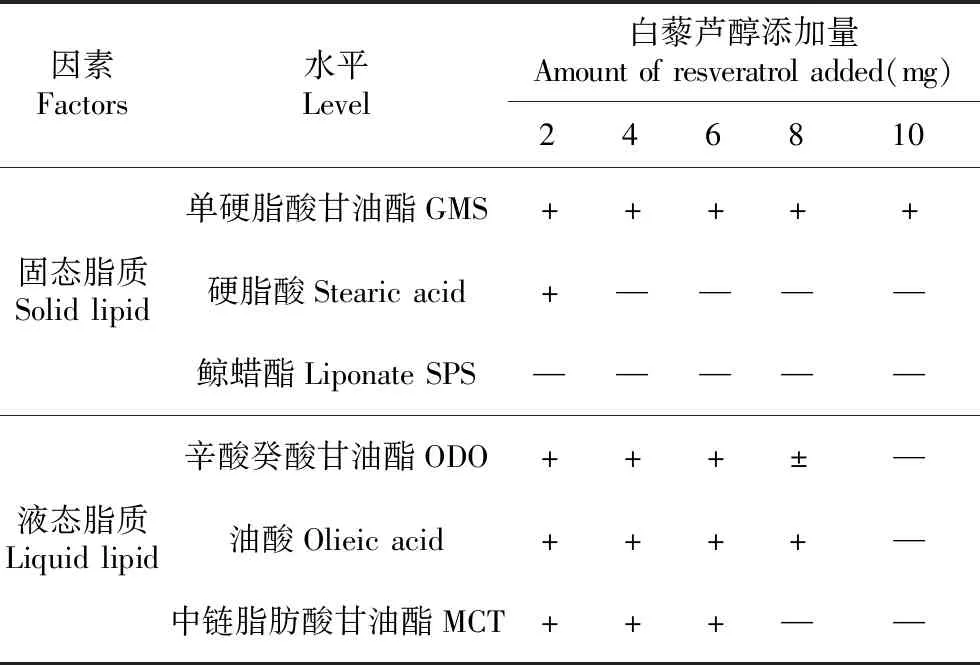
表1 脂质筛选结果
注:“—”表示不能够溶解完全;“±”表示加热时能够溶解,但冷却后有结晶析出;“+”表示能够溶解完全,冷却后也没有结晶析出。
Note:“—”means can’n be completely dissoloved;“±”means can be dissoloved during heating,but crystal precipitation after cooling;“+”means can be dissoloved,and no crystal precipitation after cooling
乳化实验则是依据亲水亲油平衡原理,以乳化能力作为评价指标来进行乳化剂的筛选。本实验选择了3种实验室常见的亲水性乳化剂,对它们的乳化能力进行筛选,结果如表2所示。其中4%的吐温80形成的乳液稳定性较好,离心后也不出现分层,因此,本实验选取吐温80为乳化剂,添加量为4%。

表2 乳化实验结果
注:“—”表示冷却会分层;“±”表示冷却不分层,离心会分层;“+”表示离心也不发生分层现象
Note:“—”means stratification occurs after cooling;“±”means no stratification occurs after cooling,but stratification occurs after centifugation;“+”means no stratification occurs after centifugation

图1 固液脂质比例对粒径的影响Fig.1 Effect of solid-liquid lipid ratio on particle size
2.1.2 固液脂质比例的筛选
固液脂质比例影响药物包封率,进而影响粒径。如果液体脂质太少,则不能够破坏固态脂质的晶格结构,造成药物裸露,从而导致体系粒径变大;而液体脂质太多又不利于纳米结构脂质载体的形成,本实验选取固液脂质比例分别为3∶1、2∶1、1∶1、:1∶2、1∶3进行试验,结果如图1所示。当固液脂质比例为1∶1时,体系的平均粒径最小,因此选择固液脂质比为1∶1。

图2 均质压力对粒径的影响Fig.2 Effect of homogeneous pressure on particle size

图3 均质次数对粒径的影响Fig.3 The influence of homogenization degree on particle size
2.1.3 热高压均质压力及循环次数的确定
高压均质压力和循环次数都对纳米结构脂质载体粒径有着非常重要的影响。一般来讲粒径在提高均质压力和增加循环次数后都会降低,但是对于不同的油脂/乳化剂体系有各自最适合的均质压力和循环次数,在超过这个条件之后,粒径反而会变大。
本实验分别在300、400、500、600和700 bar的条件下对白藜芦醇初乳进行处理。如图2所示,体系的平均粒径随着均质压力的改变而变化。当均质压力低于600 bar时,随着均质压力的升高体系的平均粒径从234 nm减小至179 nm。当均质压力继续上升时,体系平均粒径不降反升,这可能是由于体系的温度随着均质压力增大而逐渐升高,致使体系中的液滴发生聚集,进而导致其平均粒径变大。因此,选择均质压力为600 bar。
本实验分别选择循环次数1、2、3、4和5次对白藜芦醇初乳进行处理。如图3所示,体系的平均粒径随着均质次数的改变而发生变化。当均质次数小于3次时,平均粒径随着均质循环次数的増加而减小,从255 nm降到179 nm。而当继续增加均质次数时,体系平均粒径变化不明显甚至回升。因此,综合考虑,选择均质次数为3次。
综上,确定以单硬脂酸甘油酯为固态脂质,油酸为液态脂质,二者比例为1∶1,吐温80为乳化剂,添加量为4%,在均质压力为600 bar的条件下均质3次,此时制备的白藜芦醇脂质载体平均粒径最小,可降低至179.6±1.7 nm,在水中的分散度也良好,此时药物包封率为85.33%。
2.1.4 傅里叶变换近红外光谱分析(FTIR)
图4为白藜芦醇、单硬脂酸甘油酯以及白藜芦醇脂质载体的红外图谱。白黎芦醇粉末的红外图谱在1 608 cm-1(苯环上碳碳双键的伸缩振动峰),1 592 cm-1(烯烃上碳碳双键的伸缩振动峰)和966 cm-1(反式碳碳双键的特征峰)处具有较强的吸收峰。白藜芦醇的这些主要特征吸收峰在其脂质结构载体上也依旧存在,这表明白黎芦醇在其脂质结构载体制备过程中并没有发生化学反应,其结构没有发生变化。
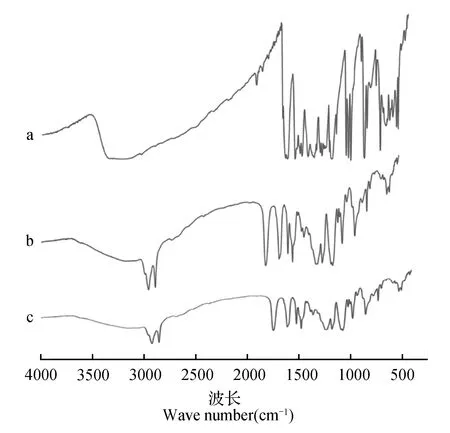
图4 傅里叶变换近红外光谱Fig.4 FTIR of Res(a),GMS(b),Res-NLC(c)

图5 白藜芦醇及其脂质载体对L02细胞的毒性试验a.白藜芦醇处理12 h;b.白藜芦醇脂质载体处理12 h;c.白藜芦醇处理24 h;d.白藜芦醇脂质载体处理24 hFig.5 Effects of resveratrol and resveratrol NLC on L02 cells a.Treated with resveratrol for 12 h; b.Treated with resveratrol NLC for 12 h; c.Treated with resveratrol for 24 h; d.Treated with resveratrol NLC for 24 h
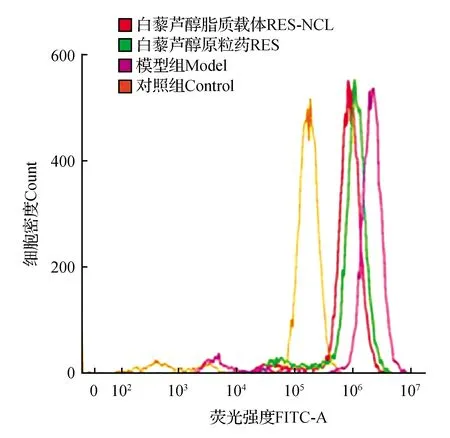
图6 白藜芦醇及其脂质载体清除ROS能力Fig.6 ROS scavenging capacity of resveratrol and Res-NLC
2.2 MTT法检测白藜芦醇和白藜芦醇脂质载体对细胞的影响
如图5所示,白藜芦醇和白藜芦醇脂质载体随着浓度升高,细胞死亡率越高。白藜芦醇处理时间为12和24 h,浓度低于200 μmol·L-1时并未对细胞产生明显毒性。白藜芦醇脂质体处理时间12和24 h,浓度低于100 μmol·L-1时未对细胞产生明显毒性。综合考虑,我们选择50 μmol·L-1的白藜芦醇和白藜芦醇脂质载体作为后续实验的给药浓度。
2.3 流式细胞仪检测白藜芦醇脂质载体清除ROS能力
外源性过氧化氢(H2O2)可以透过细胞膜进入细胞,并在细胞内分解产生自由基,导致细胞内的ROS含量急剧增加。DCFH-DA是一种最常用的活性氧荧光检测探针,其本身不产生荧光,却能穿过细胞膜,到达细胞内部后,水解生成不可以透过细胞的DCFH,细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF。我们通过对荧光强度进行测试,确定白藜芦醇脂质体清除ROS的能力。
如图6所示,浓度为600 μmol·L-1的H2O2溶液作用12 h后,相比于空白对照组,H2O2损伤组DCF在细胞内的荧光强度明显增加。然而预先加入50 μmol·L-1白藜芦醇脂质载体和白藜芦醇原料药的实验组处理12 h后,DCF的荧光强度有所下降,并且白藜芦醇脂质载体对ROS的清除能力强于白藜芦醇原料药。
3 结论
本研究采用高压均质法制备白藜芦醇脂质载体,研究结果表明白藜芦醇脂质载体显著降低了药物粒径,在水中分散度良好。首先以脂质对白藜芦醇溶解度为评价指标,确定以单硬脂酸甘油酯为固态脂质,油酸为液态脂质。再以稳定性为评价指标,确定以4%吐温80为乳化剂。以粒径为评价指标,确定固液脂质比例为1∶1,均质压力为600 bar,循环3次时得到的白藜芦醇脂质载体粒径最小,为179 nm,此时药物包封率为85.33%。MTT实验和ROS清除实验结果也表明白藜芦醇脂质载体浓度低于100 μmol·L-1时未对细胞产生明显毒性,并且有优于白藜芦醇原料药的抗氧化活性。通过这些实验结果,可以为白黎芦醇在医药及化妆品等领域的应用提供依据。
