基于OBE理念的药物化学生物学实验教学案例设计
2020-07-11徐仲玉岳岭佳
黄 瑾,徐仲玉,岳岭佳
(华东理工大学药学院,上海200237)
0 引 言
成果导向教育理念(Outcomce Based Education,OBE)自1981 年提出以来便得到了教育工作者的广泛重视与认可,已成为欧美等发达国家教育改革的主流理念,其以产出为导向,要求学生具备分析和解决复杂问题的能力、创新意识和团队合作精神。新形势下我国药学专业高等教育的任务是培养具有创新精神和实践能力的高级药学专门人才,其中创新以知识为基础,思想为关键,实践为根本。药物化学生物学是现代化学与生命科学交叉产生的新兴学科,通过使用化学小分子干预疾病发生发展的过程,为发现新药提供理论依据[1-3],是新形势下本科药学专业的核心课程,这一课程对知识、思想和实践的综合强化与当前主流教育理念和培养目标不谋而合。目前,我校药学专业已开设了药物化学生物学课程。为契合培养具有扎实的药学专业基础知识和药学实践能力的培养目标,体现从基因到药物,理工结合、教研结合的专业特色,及时跟踪学科发展的最新成果,将科研成果及科研心得引入教学实践中,完善更新药物化学生物学课程教学内容[4]。
从分子水平上详细了解并阐明小分子药物与靶蛋白的相互作用,是现代药物化学生物学研究的重要内容之一。该研究有助于更加深入、清晰地认识各种药物在生物体内的药理活性及其作用方式,同时也可为筛选药效更显著、毒副作用更小的新型药物提供科学依据[5]。
小分子化合物与靶标蛋白相互作用的识别是开发靶向候选药物的一个重要起点[6],蛋白质热漂移实验(Protein Thermal Shift Assay,TSA),也叫差示扫描荧光检测实验(Differential scanning fluorimetry,DSF),是检测目标蛋白热稳定性的热变性实验,也是一种经济实用、方便快捷确证活性小分子与靶蛋白相互作用的实验手段。不同小分子化合物对蛋白的热稳定性影响不同[7],通过TSA法检测加入小分子化合物后靶标蛋白熔解温度的变化(ΔTm),可判断小分子化合物对蛋白的作用强弱,进而筛选出可有效结合靶蛋白的小分子化合物[8]。
1 蛋白质热转移法
1.1 实验原理
蛋白的Tm值(熔解温度)对确定蛋白的结构特征、稳定性及蛋白-配体间相互作用具有重要意义。配体与靶标蛋白结合后,通常能增强靶标蛋白的稳定性,使靶标蛋白的Tm值发生改变(ΔTm)。Tm值的改变源于配体与受体蛋白间的结合能(ΔGbind),可通过蛋白质热漂移实验进行测定[9],其原理如图1 所示。
通常蛋白质处于一种折叠的状态,其疏水部分藏于蛋白内部。SYPRO Orange 是一种在水溶液中几乎不发光、与蛋白疏水性表面结合后可产生荧光的染料分子[10]。当目标蛋白所处溶液体系温度缓慢升高时,目标蛋白随温度升高解开折叠并逐渐暴露出疏水表面,疏水表面非特异性地结合SYPRO Orange 染料,导致体系荧光信号强度上升。当温度达到某一临界点时,展开的蛋白质链聚集,阻止荧光染料结合,被阻止的荧光染料重新回到周围的水环境中,导致高温下荧光淬灭,荧光信号强度下降。通过检测体系中荧光信号的变化,可得出目标蛋白的熔解曲线,并计算出蛋白的Tm值(Tm值为熔解曲线增色效应达到最大值一半时的温度)。加入化合物后若目标蛋白的Tm值出现明显增加(一般升高至少2 ℃以上),则说明该化合物能与目标蛋白结合并稳定其构象[11],如图2 所示。

图1 配体诱导蛋白质的构象变化示意图
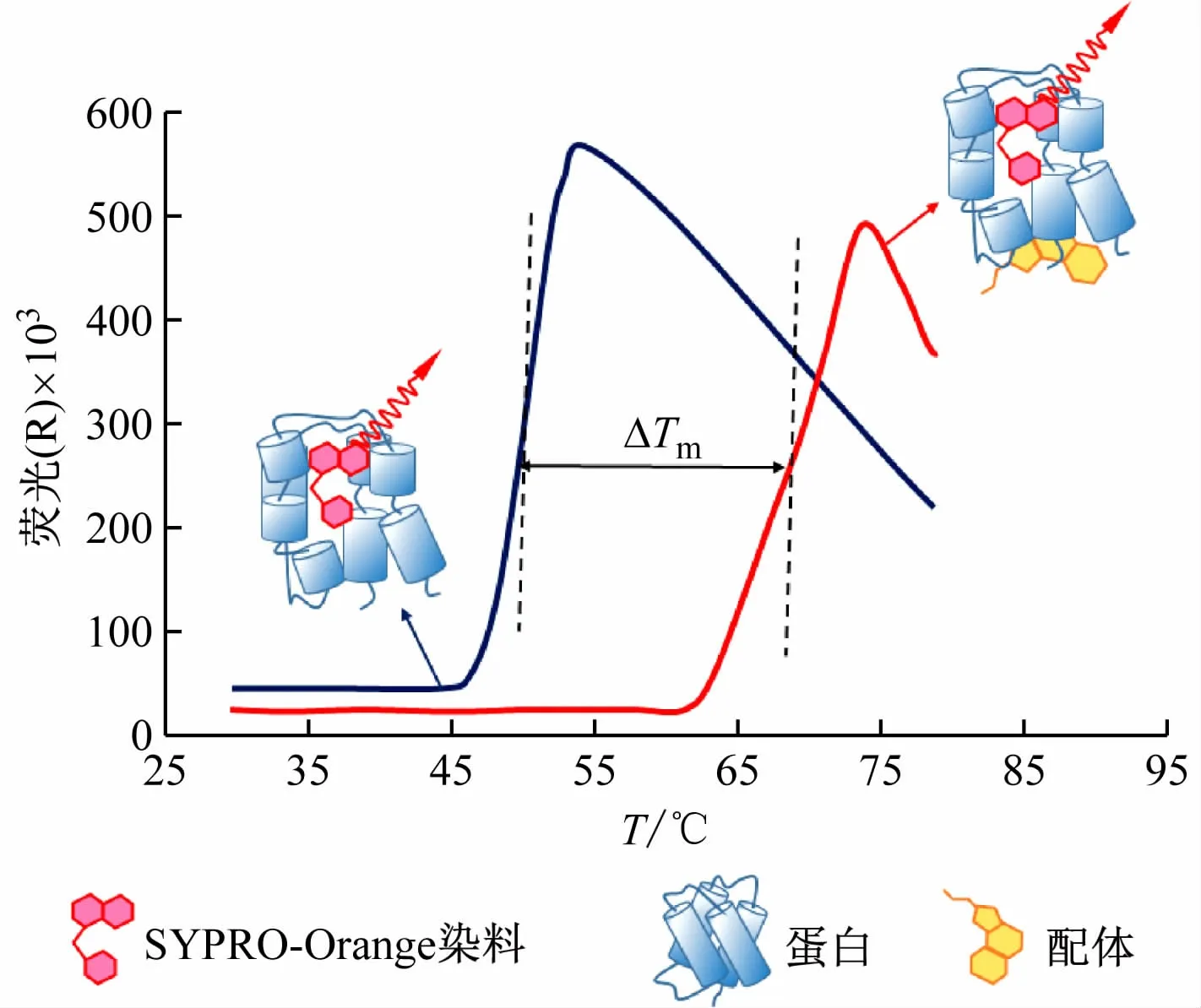
图2 蛋白质热转移法原理
2 实验内容
2.1 实验材料、主要试剂与仪器
2.1.1 实验材料
法尼醇X 受体的羧基末端配体结合区(FXRLBD)(北京百诺威生物科技有限公司),96 孔定量PCR板(伯乐生命医学产品(上海)有限公司)。
2.1.2 实验试剂
SYPRO Orange 5000X(赛默飞世尔科技(中国)有限公司),盐酸小檗碱Berberine Hydrochloride(上海诗丹德有限公司),伊维菌素Ivermectin(上海诗丹德有限公司),Tris-Hcl(国药集团化学试剂有限公司),NaCl(国药集团化学试剂有限公司),乙二胺四乙酸EDTA(国药集团化学试剂有限公司),二硫苏糖醇DTT(国药集团化学试剂有限公司),二甲基亚砜DMSO(上海泰坦科技有限公司)。
2.1.3 实验仪器
荧光实时定量PCR 仪(Bio-Rad 上海有限公司),Eppendorf移液器(艾本德(中国)股份有限公司)。
2.2 实验操作流程
TSA实验主要是在96 孔定量PCR板中利用荧光实时定量PCR 仪完成平行检测。实验反应体系相对简单,包括蛋白缓冲液,蛋白质样品,SYPRO Orange以及配体化合物。实验的具体操作流程如图3 所示。

图3 蛋白质热转移法的实验操作流程
2.3 样品溶液配置
以稳定性较高的代谢类疾病重要靶标法尼醇X受体FXR为目标蛋白,分别选择无活性的盐酸小檗碱(Berberine Hydrochloride)及高活性的伊维菌素(Ivermectin)[12]两种化合物开展实验,用二甲基亚砜(DMSO)配置成5 mmol/L 的化合物母液备用。按以下比例配置实验所需的活性测试液(10 mmol/L Tris,10 mmol/L NaCl,0.5 mmol/L EDTA,5 mmol/L DTT,pH 8.0)50 mL,0.22 μm 滤膜过滤后备用,用活性测试液将荧光染料SYPRO Orange稀释1000 倍待用。将实验样品分为3 组,一组空白组(检测蛋白本身的Tm值)以及两个化合物组,每组设置3 个平行。为减少同一样品的测试误差,可将3 个平行孔的染料、蛋白和化合物预先在1.5 mL 离心管中配制混合液150 μL,包括已稀释好的染料溶液141 μL,化合物1.5 μL(终浓度为50 μmol/L),以及蛋白7.5 μL(终浓度5 μmol/L),按40 μL/孔分装到PCR 板内用封条把PCR 板封紧,在4 ℃条件下1 000g,离心2 min 使孔内无气泡,再放入Bio-Rad CFX96 型RT-PCR仪中。
2.4 PCR程序设置
在荧光实时定量PCR 仪上打开Bio-Rad 软件,新建一个测试程序,在新程序中插入Melt Curve,调整温度检测范围为25 ~90 ℃,每18 s上升0.3 ℃,调整样品体积的参数为40 μL。点击next,选择Edit Selected,将Scan Mode改为Fret;点击next,然后对准孔槽放入样品,关上盖子,启动程序。
2.5 结果分析
在实验原理部分已知通过实时监测荧光信号即可以观察到蛋白的热稳定性状态。如果蛋白结合某一化合物后Tm值发生变化,当ΔTm升高2 ℃以上时,表明该化合物对受体蛋白有结合。在Bio-Rad 软件程序运行结束后,软件会自动分析直接可得到蛋白的Tm值。由图4 可以看到,只有阳性化合物伊维菌素显著提高了FXR-LBD的热稳定性,盐酸小檗碱对FXR-LBD 的热稳定性无影响。

图4 伊维菌素对FXR-LBD熔解温度的影响
为进一步探索化合物浓度对蛋白稳定性的影响,将伊维菌素用DMSO配置成不同浓度,使其在体系中终浓度分别为1、10、25、50、100 μmol/L,用上述方法分别测定不同浓度的伊维菌素对FXR-LBD 蛋白熔解曲线的影响,计算得到Tm值,如图5 所示。检测结果显示,随着化合物浓度的增高,蛋白的热稳定性升高。

图5 不同浓度的伊维菌素对FXR-LBD的热稳定性的影响
3 实验注意事项
从实验溶液配制分装技巧、体系中颗粒和细菌控制以及平行操作3 个角度总结了整个实验需要注意的事项。
实验操作中溶液的配制和分装是重要环节,溶液的混匀操作对整个实验的准确性至关重要。实验中涉及多管反应配制混合液,可先将各组分在1.5 mL EP管中混合均匀后再分装到96 孔定量PCR 板中;涉及浓度梯度稀释时,务必将高浓度溶液混合均匀后再进行稀释。
反应溶液中的颗粒和细菌会对测试体系的澄清度及蛋白质稳定性造成影响,从而影响整个实验的准确性,故实验过程中用到所有溶液,配制完成后均须用0.22 μm的滤头过滤,除去不溶性颗粒物及细菌,方能使用[13]。为了避免不同体系交叉污染,实验过程中所用的枪头,96 孔板,离心管等均为一次性使用,切勿重复利用。
为了提高实验结果的可靠性,每组样品设置至少3 个复孔及未加入化合物的阴性对照,对数据进行严格校正以消除误差[14]。设置阴性对照可帮助准确判断实验中所用的蛋白,染料,缓冲液等是否变质,避免因实验体系污染产生的错误实验结果。
4 教学讨论
本实验项目有较强的连贯性和综合性,且实验成本较低,受众面较广,适合作为药物化学生物学实验教学环节的综合性实验开设。不同于基础性验证实验,热稳定性检测靶标蛋白与小分子化合物的相互作用模拟了一个小型研究课题,整体实验设计以学生为主,让学生以小组协作形式自行设计实验细节及操作实验,给予学生更多的自主空间,团队协作讨论,充分激发学生的主观能动性和团队协作精神。在实验结束后,师生一起对实验过程中出现的问题及实验结果进行讨论和点评,使学生进一步系统全面地掌握科研中常用的蛋白质热转移法实验,对培养学生的药物创新思维、团队协作精神提高科研能力具有重要的意义[15]。
在本实验过程中熔解曲线可能会出现如下问题,经过师生讨论进行了进一步的拓展:① 无熔解曲线:并非所有蛋白质都能在热变性时有理想的熔解图谱,约15% ~20%的重组蛋白没有理想的变性曲线,其常见的原因包括:蛋白本身缺乏紧密的球形折叠,缺少疏水核心或在室温下稳定性差,热迁移实验不适用于检测存在以上情况的靶标蛋白质与化合物的相互作用分析。②熔解曲线不光滑:在蛋白质热迁移的实验过程中,缓冲液温度会缓慢上升,实验前应提前明确蛋白缓冲液随温度升高pH 值变化的情况[16-17],需选择温度升高对测试体系pH 值影响较小的缓冲液条件。此外,还可以通过改变一些参数来改变熔解曲线不光滑的情况,如SYPRO Orange染料的浓度,缓冲液的配方及蛋白的浓度等,寻找目标蛋白最佳熔解曲线测试条件。③熔解曲线出现多个峰:当蛋白质含有不止一个结构域或形成低聚物时,熔解曲线可能会出现多个峰,这时不能准确得到蛋白的熔解温度。可通过改变缓冲液,确定蛋白的展开条件。也可获取靶标蛋白单独的活性结构域再使用蛋白质热转移法进行相关测试。
5 结 语
本实验从我校理工结合、教研结合的专业特色出发,以OBE教育理念为导向,从培养目标达成角度分析,将科研中常用的蛋白质热转移技术设计导入药物化学生物学实验教学环节,把科研成果引进药学本科课堂教学[18],通过科研反哺教学。学生通过小组协作自主实验观察加入伊维菌素和盐酸小檗碱两种不同化合物后,FXR-LBD蛋白的熔解曲线的变化,判断小分子化合物对蛋白作用的强弱。整个实验过程既有利于药学专业本科生理解并掌握小分子与蛋白相互作用的相关药物化学生物学知识,也有利于同学们了解药物化学生物学学科的前沿动态,还可激发学生们的学习积极性以及创新精神,培养团队协作精神,切实为培养具有药物创新意识、团队协作精神,能在新药创制领域从事各类科研开发管理等工作的人才培养目标服务。
