大气压冷等离子体对肿瘤细胞增殖和凋亡的影响及其机制
2020-07-10王甜王欢博安广洲张俊平张克英周艳李静郭玲李和平丁桂荣
王甜,王欢博,安广洲,张俊平,4,张克英,周艳,李静,郭玲,李和平,丁桂荣
1.空军军医大学军事预防医学系/辐射防护医学教研室,陕西西安710032;2.西安市中心医院神外微创及转化医学中心,陕西西安710032;3.空军军医大学基础医学院学员队,陕西西安710032;4.中国人民解放军61255部队,山西侯马043000;5.清华大学工程物理系,北京100084
前言
脑胶质瘤和宫颈癌是较常见的两种肿瘤,严重危害着人类健康。目前临床上治疗这两种疾病主要采取手术、化疗及放疗相结合的方式,虽然有一定疗效,同时也伴随着比较明显的副作用。最新研究发现,大气压冷等离子体(Cold Atmospheric Plasma,CAP)射流在灭菌[1]、促进伤口愈合[2]及杀伤癌细胞[3]等方面具有良好的效果且无明显副作用,显示了其潜在的应用前景。CAP射流温度低,在作用区域内不会产生明显的不适,特别是在杀伤肿瘤细胞的同时,不会导致正常组织的损伤,具有安全、有效靶向治疗肿瘤的潜力,已经成为该领域的研究热点之一[4]。
研究发现不同组织来源的细胞对等离子体的敏感性不同。据报道,电压为2~5 kV,频率为30 kHz的冷等离子体处理皮下膀胱癌肿瘤,能够使肿瘤显著减小,并不会造成皮肤损伤,该参数的等离子体还可导致体外培养的肺癌细胞SW900 脱离培养平板,但对正常的支气管上皮细胞(Human Bronchial Epithelial Cells,NHBE)没有影响[5];电压3 kV、频率25 kHz 的冷等离子体处理可降低瘢痕瘤细胞keloid的迁移能力和胶原形成,而对正常的成纤维细胞却具有相反的作用[6];用8 kV,10 L/min 的CAP 处理4种鳞状细胞癌(Head and Neck Squamous Cell Carcinoma,HNSCC)细胞(JHU-022,JHU-028,JHU-029,SCC25),结果发现CAP 能降低HNSCC 细胞的活力,其作用效果与处理时间和射流大小等有关,但是对口腔正常上皮细胞系OKF6 和NOKsi 的细胞活力没有明显影响[7],表明正常细胞和肿瘤细胞对等离子体的敏感性不同。不同来源的肿瘤细胞对CAP 是否亦存在敏感性差异?目前尚不清楚。本研究以两种不同组织来源肿瘤细胞(脑胶质瘤细胞U87和宫颈癌细胞Hela)为研究对象,探讨CAP 对其增殖和凋亡的影响及可能的作用机制。
1 材料与方法
1.1 试剂
DMEM 高糖培养基(Hyclone),胎牛血清(四季青),0.25%胰酶-EDTA溶液(索莱宝),BCA蛋白浓度检测试剂盒(碧云天),CCK-8 增殖检测试剂盒(七海公司),细胞凋亡检测试剂盒(索莱宝),小鼠抗caspase3 抗体(abcam),兔抗Nrf2 抗体(abcam),小鼠抗GAPDH 抗体(invitrogen),山羊抗兔lgG(H+L)(Invitrogen),山羊抗鼠lgG(H+L)(Invitrogen)。
1.2 CAP射流装置
本研究中采用的是高度集成的CAP 发生器CAP-Med,如图1a所示。该装置来自于清华大学等离子体健康科技组(PHSG),包括高压交流电源模块、氦气流速控制模块、驱动频率及输出电压控制旋钮模块和同轴型介质阻挡放电(Dielectric Barrier Discharge,DBD)等离子体发生器,氦等离子体射流由发生器下方喷口处喷出,与被处理细胞培养液接触。发生器结构如图1b所示,直径为1.00 mm的长钨丝被用作高压电极,薄铜片则作为地电极,两电极间表面均覆盖着厚度为1.00 mm的石英管作为介质层,两石英管间的放电间隙宽度为1.50 mm,聚四氟乙烯作为绝缘层,包裹在发生器外侧。稳定氦气放电的驱动频率f=17.00 kHz,放电电压Vd=2.57 kV,放电电流Id=8.33 mA,输入功率Pin=9.65 W,氦气的流量固定为Q=10.81 slpm(standard liters per minute)。处理细胞时,将等离子体发生器喷嘴垂直置于细胞培养液面上方约3 mm处,通过移动喷嘴实现对细胞的均匀处理。

图1 CAP Med照片(a)和介质阻挡放电等离子体发生器结构(b)Fig.1 Picture of CAP Med(a)and the schematic structure of dielectric barrier discharge plasma generator(b)
图2是利用ICCD(Andor,DH334T-18U-03)在发生器喷嘴下方垂直距离3 mm 处采集的发射光谱,可以看出由同轴型介质阻挡放电等离子体发生器产生的氦射流中不仅包含了大量的氦粒子,同时也包含大量活性氮氧基团,如NO、OH,主要来自于等离子体射流中电子、氦粒子与空气中气体分子(N2、O2、H2O)间的相互作用。在这些基团中,NO 在帮助细胞抵抗肿瘤和有害微生物方面体现出了较大潜力[8-9],因此是等离子体医学中最受关注的活性粒子之一;OH 在液相条件下可形成长寿命的H2O2分子,进而可作为调节细胞间交流的信号分子[10]。
1.3 细胞培养与传代

图2 氦气等离子体射流的发射光谱Fig.2 Emission spectrum of helium plasma jet
人神经胶质瘤细胞系U87 和宫颈癌细胞系Hela均培养于含10%胎牛血清的DMEM 高糖培养基中,置于37 ℃,含5% CO2的培养箱内进行培养,每日观察细胞的生长情况,定期换液。细胞长至80%融合后,用0.25%的胰酶-EDTA溶液消化传代。
1.4 CCK-8法检测细胞增殖
将处于对数生长期的U87和Hela细胞接种于96孔板中,每孔接种3 000个细胞,每组设5个复孔。分别设置正常对照组(不处理),He处理组,CAP处理不同时间(30、60、90 s)组。处理完毕后,放于培养箱中培养,于处理后24、48、72和96 h,加入CCK-8试剂,使用酶标分析仪检测450 nm波长处的吸光度值。
1.5 流式细胞仪检测细胞凋亡
将对数生长期的U87和Hela细胞接种于6 cm 培养皿中,分为正常对照组、He 处理组、CAP 处理60 s组,细胞长至密度为60%左右时,CAP 处理,在处理后24 h 消化收集细胞,根据试剂盒说明染色,上流式细胞仪检测,分析凋亡率的变化。
1.6 免疫印迹法检测蛋白表达
将处于对数生长期的U87 和Hela 细胞接种至6孔板,长至60%~70%融合后,随机分为正常对照组,He 处理组,CAP 处理不同时间(30、60、90 s)组,处理后24 h,用RIPA 裂解液裂解细胞提取蛋白,BCA 法测蛋白浓度。采用12%的下层胶进行SDS-PAGE 电泳,转膜后,5%的牛奶TBST 室温封闭2 h,接着孵育一抗,小鼠抗caspase3(1:1 000),兔抗Nrf2(1:1 000),4 ℃过夜,然后孵育二抗,山羊抗兔(1:50 000)和山羊抗小鼠(1:100 000),每个步骤都用TBST 洗涤3次,每次10 min,最后化学发光成像后用Image J软件分析蛋白表达情况。
1.7 数据处理和统计分析
采用SPSS 19.0软件进行统计学处理。所得数据以均数±标准差表示,多个样本间的均数比较用单因素方差分析,两样本间均数比较用两独立样本t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 CCK-8检测结果
CCK-8 检测结果显示,与对照组相比,U87 和Hela 细胞经纯He 处理后,其细胞增殖能力没有显著变化,Hela 细胞经30 s CAP 处理后,细胞的增殖能力即受到显著抑制,U87细胞增殖无明显变化(图3、4),两种细胞经60 和90 s CAP 处理后,增殖均受到显著抑制(图3、4),对U87 细胞而言,CAP 处理时间越长,增殖抑制作用越明显。
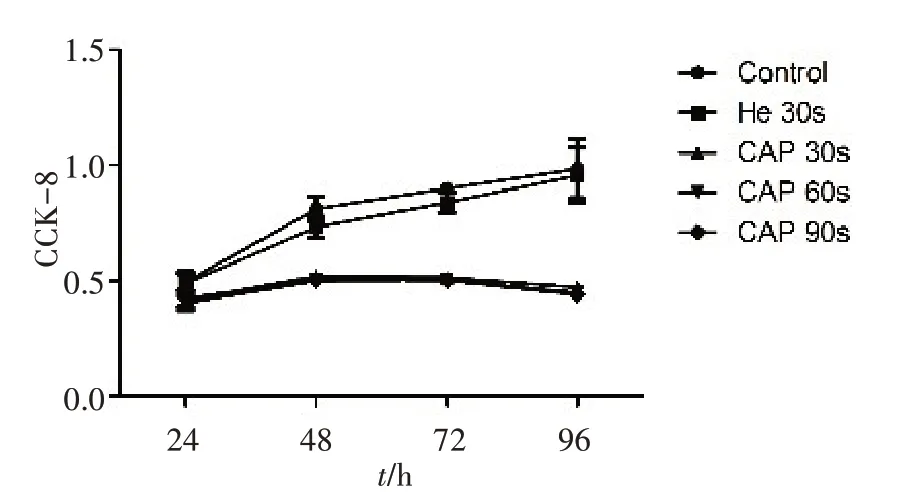
图3 Hela细胞经CAP不同时间处理后的生长情况Fig.3 Proliferation curve of Hela cells after CAP treatment for different durations
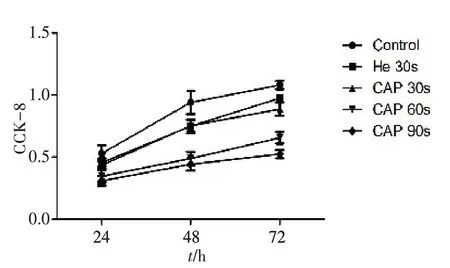
图4 U87细胞经CAP不同时间处理后的生长情况Fig.4 Proliferation curve of U87 cells after CAP treatment for different durations
2.2 细胞凋亡检测结果
流式细胞仪凋亡检测结果显示,与对照组相比,He 处理后U87 和Hela 细胞的凋亡率没有显著变化,用CAP处理60 s后24 h,两种细胞的凋亡率与对照组相比均显著增加(P<0.01)(图5、6)。
2.3 免疫印迹结果
免疫印迹结果显示,与对照组相比,He处理组的调亡相关蛋白(caspase3)和氧化应激关键蛋白(Nrf2)水平没有显著变化,CAP 处理不同时间后,两种细胞的caspase3 和Nrf2 表达水平随CAP 处理时间的增加,呈逐渐上升趋势(图7、8),提示CAP 可以诱导肿瘤细胞凋亡,且与氧化应激有关。
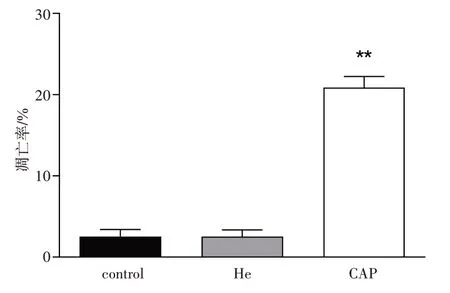
图5 CAP处理后Hela细胞的凋亡情况Fig.5 Apoptosis rate of Hela cells after CAP treatment

图6 CAP处理后U87细胞的凋亡情况Fig.6 Apoptosis rate of U87cells after CAP treatment
3 讨论
已有的研究表明,CAP 对多种肿瘤细胞具有杀伤作用,如:将小鼠神经母细胞瘤细胞分别用CAP 处理30、60 和120 s,可导致肿瘤细胞代谢活性和细胞活力明显下降,凋亡显著增加,处理后7 d 的细胞持续显示肿瘤生长抑制作用[12],用20 kV 的CAP 处理U87 和正常星形胶质细胞E6/E7 后发现,U87 的凋亡率是E6/E7的3倍[12]。Conway等[13]发现120 kV,50 Hz的冷等离子体能够降低人脑胶质瘤细胞系U373和宫颈癌细胞系Hela 的活力,并且其抑制作用与冷等离子体处理时间呈正相关,进一步研究发现,Hela 细胞较U373 细胞更为敏感。本研究结果显示,人胶质瘤细胞U87 和宫颈癌细胞Hela 经CAP 处理后,两种细胞的活力均显著下降,且与处理时间有关,Hela 细胞在处理30 s后其活力即发生显著降低,而U87细胞在CAP处理60 s后活力才显著下降,说明两种肿瘤细胞对CAP 的敏感性有一定的差异性,Hela 细胞较U87细胞更为敏感,结果与Conway 等[13]的发现具有类似性。流式细胞仪检测细胞凋亡结果显示,经CAP 处理60 s 后24 h,两种肿瘤细胞的凋亡率都明显上升,同时伴有caspase3蛋白的表达增加。caspase3是凋亡过程中的关键剪切酶,其表达水平随着CAP 处理时间的增加而增加,表明CAP 处理时间越长,凋亡发生率越高。
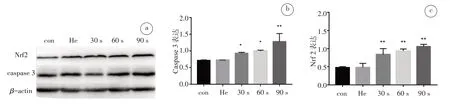
图7 Hela细胞经CAP处理后Western Blot(a)检测caspase3(b)和Nrf2(c)的蛋白表达变化Fig.7 Results of western blot(a)in Hela cells after CAP treatment and the expression levels of caspase3 protein(b)and Nrf2 protein(c)
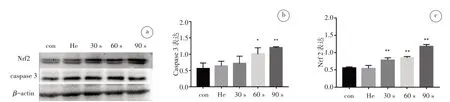
图8 U87细胞经CAP处理后Western Blot(a)检测caspase3(b)和Nrf2(c)的蛋白表达变化Fig.8 Results of Western blot(a)in U87 cells after CAP treatment and the expression levels of caspase3 protein(b)and Nrf2 protein(c)
文献报道和本研究的结果显示,CAP 对肿瘤细胞具有显著的增殖抑制作用和凋亡诱导作用,但是具体作用机制尚不明确。据报道,CAP 诱导细胞产生的ROS 可能是导致细胞凋亡的主要原因,一方面,细胞内抗氧化系统由于ROS 过度消耗而失衡,另一方面过量的ROS 可能导致细胞DNA 和线粒体损伤,最终引起细胞损伤[14-16],而Nrf2蛋白是氧化应激通路的关键分子[17-18],本研究结果显示,两种肿瘤细胞经CAP 处理后,Nrf2的表达显著增加,提示CAP可能通过影响细胞的氧化应激系统发挥作用,最终导致细胞损伤。我们的结果与Li等[19]的报道结果一致。
上述研究结果表明,本实验条件下的CAP 能够有效抑制人脑胶质瘤U87 细胞和宫颈癌Hela 细胞的增殖能力,并诱导其发生凋亡,其机制可能与氧化应激有关。Hela细胞较U87细胞对CAP更为敏感。
