肺癌靶向多肽荧光分子探针的研制及其应用
2020-07-10李贵平符珍敏江英齐永帅池晓华何云
李贵平,符珍敏,江英,齐永帅,池晓华,何云
南方医科大学南方医院核医学科,广东广州510515
前言
恶性肿瘤是当前人类面临的主要健康问题,肺癌是癌症相关死亡的主要原因。肺癌疗效得不到有效提高的主要障碍是因为肺癌诊断时已是晚期,虽然目前肺癌的检查方法多样,但是很大部分患者可能是因为体质量减轻、骨痛、头痛或者是肿瘤症候群才到医院检查,可能已经出现了远处转移[1]。基于小分子多肽的肿瘤分子影像学是目前临床肿瘤学研究的热点[2]。小分子多肽cNGQGEQc 最早是由郭琳琅等学者利用组合化学肽库技术筛选出来的一种能够与非小细胞肺癌结合的多肽,由8个氨基酸残基组成的短肽,分子两端的D 型半胱氨酸形成一对二硫键,是一个环形的多肽分子,研究发现cNGQGEQc(两端半胱氨酸形成一对二硫键)可以通过细胞膜上的整合素α3 与非小细胞肺癌细胞结合[3]。本课题组前期已成功将放射性核素131I、99mTc 标记多肽分子cNGQGEQc,并进行SPECT 显像[4-7]。这种多肽分子在合成过程中成本较高,耗时,本课题组在前期研究中还发现链状多肽分子cNGQGEQc(两端半胱氨酸不形成一对二硫键,简写成cNGQGEQc-L)也可与肺腺癌A549 细胞株结合,链肽分子相对环肽合成更方便、更经济。本实验选择能与整合素α3 受体结合的链状多肽分子cNGQGEQc-L 作为靶向载体,将羧基荧光素(FAM)与cNGQGEQc-L连接构建荧光分子探针,通过荧光成像探讨该多肽分子探针用于肺腺癌显像的可行性,为该探针的临床转化应用奠定基础。
1 材料与方法
1.1 材料
本实验所用肺腺癌A549 细胞株,购买自中国科学院上海生科院细胞库。5~6 周龄、体质量18~22 g的BALB/c nu/nu 裸鼠购自南方医科大学动物中心。肺腺癌特异性靶向小分子多肽的氨基酸序列为cNGQGEQc,小分子链肽cNGQGEQc-L 及修饰有荧光素FAM 的小分子链肽(FAM-cNGQGEQc-L)由强耀生物科技有限公司合成。
1.2 肺腺癌A549细胞与荧光多肽的体外结合实验
利用荧光倒置显微镜观察体外培养肺腺癌A549细胞与荧光多肽FAM-cNGQGEQc-L的结合,方法如下:取对数期生长的肺腺癌A549细胞铺入96孔板中孵育,每孔细胞数约104个,在细胞孵箱中孵育24 h后,分别加入浓度为0.3、0.7和1.0M的荧光多肽FAM-cNGQGEQc-L,锡纸包裹后,在孵箱孵育1、3 h后吸去荧光多肽,PBS浸洗4遍,再加入多聚甲醛100µL固定10 min。吸去多聚甲醛,PBS浸洗3遍,每孔加入100µL DAPI溶液染核10 min,吸去DAPI,PBS浸洗3遍后,在倒置荧光显微镜下观察荧光多肽FAM-cNGQGEQc-L与肺腺癌A549细胞的结合情况。上述实验重复3次。
1.3 肺腺癌A549 细胞与不同浓度荧光多肽结合曲线的测定
取对数期生长的肺腺癌A549细胞于EP管内(细胞数约为4.5×105个),共9 管,倍比稀释法加入不同浓度的荧光多肽,分别为0(空白对照组)、0.003 906 25、0.007 812 5、0.015 625、0.03125、0.062 5、0.125、0.25、0.5 mmol/L,在摇床上避光孵育1 h,离心弃上清液,利用PBS 润洗3 次,将1~9 号EP 管中的细胞转移至1~9号流式管后,利用流式细胞仪测定每管的荧光强度,分析并绘制荧光多肽的浓度与肿瘤细胞结合的荧光强度的摄取曲线。
1.4 肺腺癌A549 细胞与荧光多肽结合的竞争抑制实验
利用流式细胞仪测定肺腺癌A549细胞与荧光多肽的竞争抑制实验,设置竞争抑制组和实验组。方法如下:竞争抑制组预先将肺腺癌A549 细胞与未修饰FAM的链肽cNGQGEQc-L(浓度为100µg/100µL)孵育30 min,然后吸去多肽,再加入荧光多肽FAMcNGQGEQc-L(浓度为25 μg/100 µL),孵育1 h。实验组则不添加未修饰FAM 的链肽,仅将细胞悬液至于同样条件下孵育30 min,然后再加入等量的荧光多肽FAM-cNGQGEQc-L(浓度为25 μg/100 µL),孵育1 h。最后用流式细胞仪测定上述两组A549 细胞上结合荧光多肽的荧光强度,并进行对比。
1.5 荧光多肽FAM-cNGQGEQc-L在荷瘤裸鼠动物模型中的荧光显像研究
1.5.1 荷瘤裸鼠模型建立及肿瘤病理切片制作取3~4周龄的无胸腺裸鼠,右侧腋窝用酒精棉球消毒2遍,将肺腺癌A549 细胞悬液(细胞数约为5~6×106个/150 µL)注射到裸鼠右侧腋窝皮下。裸鼠在SPF 条件下饲养,定期观察裸鼠成瘤情况并记录。待肿瘤长至1 cm 左右时进行实验。取肿瘤组织制成组织切片,并进行HE 染色,在正置显微镜下观察肿瘤组织切片是否符合肺癌改变。
1.5.2 荧光多肽在荷瘤裸鼠体内各器官生物分布及移植肿瘤的荧光显像实验取上述建模成功的肺腺癌A549细胞移植荷瘤裸鼠,于实验前一晚禁食禁水,经尾静脉注射荧光多肽FAM-cNGQGEQc-L(0.1 mg/150 µL)。将注射荧光多肽后的裸鼠置于暗室中,分别于1、2和5 h处死裸鼠,在器官分离过程中,尽量避免组织间荧光染料的交叉污染。提取的荷瘤裸鼠脏器有:肿瘤、肝脏、胆囊、脾脏、双肾、胃肠、心脏、肺以及脑组织。将离体器官在100 mm 规格的细胞培养皿上摆开,最后置于活体成像仪下进行成像。在Bruker MI SE 软件下观察不同离体器官的荧光结合强度,分析肿瘤及各个脏器组织的荧光摄取值,计算肿瘤/非肿瘤比值(T/NT比值)。
1.6 统计学方法
采用统计软件SPSS 22.0 进行统计分析,计量资料用均数±标准差表示,组间均数比较采用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 荧光多肽FAM-cNGQGEQc-L质量控制分析报告
荧光探针FAM-cNGQGEQc-L 的质谱分析报告显示所制备的目标产物的相对分子质量为1 195.31,与荧光探针的理论分子量1 196.20相近,化学纯度在98%以上,符合实验设计要求(图1)。

图1 FAM-cNGQGEQc-L 的分子结构图Fig.1 Molecular structure of FAM-cNGQGEQc-L
2.2 肺腺癌A549 细胞与荧光多肽FAM-cNGQGEQc-L的体外结合实验结果
倒置显微镜下荧光素FAM 发出黄绿色光,DAPI发出蓝色光。荧光多肽FAM-cNGQGEQc-L 与肺腺癌A549细胞孵育1、3 h后,倒置荧光显微镜下发现肿瘤细胞膜以及细胞质均可见绿色荧光(图2、图3),提示荧光多肽可以与A549细胞膜结合并且可进入到细胞质中。相同浓度下,随着孵育时间延长,孵育3 h时细胞表达的绿色荧光强度明显强于1 h的荧光强度。
2.3 肺腺癌A549 细胞与不同浓度荧光多肽FAMcNGQGEQc-L结合曲线的测定结果
荧光多肽FAM-cNGQGEQc-L 与A549 细胞孵育1 h 后,用流式细胞仪进行分析,观察不同浓度下A549细胞的荧光结合强度。空白对照组中未见有荧光摄取,而实验组则可见荧光结合峰,如图4所示。随着荧光多肽浓度的增加,A549 细胞相对荧光结合强度逐渐增加。当荧光多肽FAM-cNGQGEQc-L 的浓度大于0.125 mmol/L 时,A549 细胞的相对荧光结合强度趋近饱和。当FAM-cNGQGEQc-L 荧光多肽浓度为0.125 mmol/L 时,结合荧光多肽的A549 细胞数占总细胞数的比值(P2/P1)为98.3%(图5)。
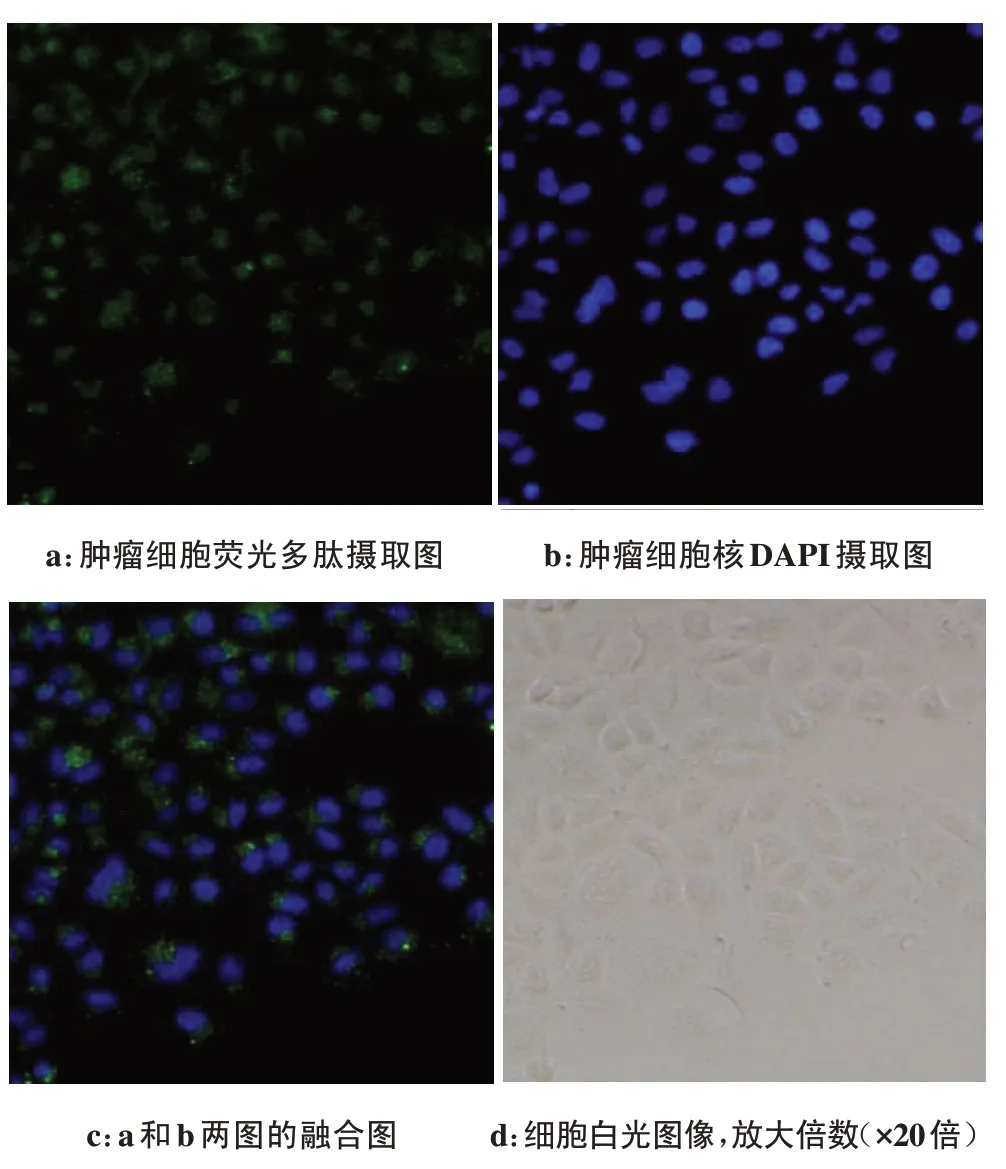
图2 倒置荧光显微镜下A549细胞与荧光多肽FAM-cNGQGEQc-L(1 mol/L,70µL)孵育1 h的荧光摄取图Fig.2 Inverted fluorescence microscope images showed the uptake of fluorescence-labeled polypeptide in A549 cells which were incubated with FAM-cNGQGEQc-L(1 mmol/L,70µL)for 1 hour
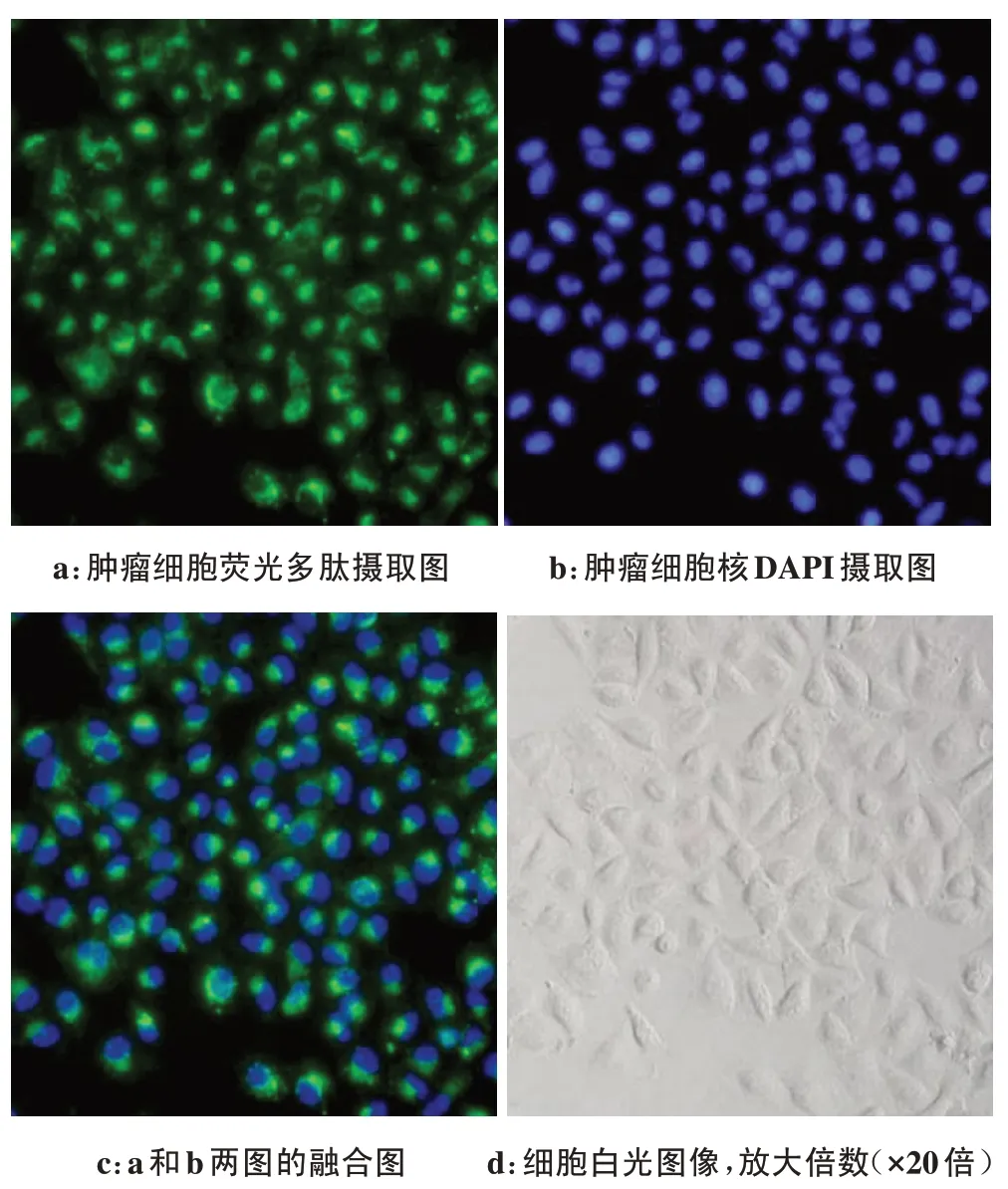
图3 倒置荧光显微镜下A549细胞与荧光探针FAM-cNGQGEQc-L(1 mol/L,70µL)孵育3 h的荧光摄取图Fig.3 Inverted fluorescence microscope image showed the uptake of fluorescence-labeled polypeptide in A549 cells which were incubated with FAM-cNGQGEQc-L(1 mmol/L,70µL)for 3 hours
2.4 肺腺癌A549 细胞与荧光多肽FAM-cNGQGEQc-L结合的竞争抑制实验
肺腺癌A549细胞与荧光多肽FAM-cNGQGEQc-L结合的竞争抑制实验结果见图6。如图6所示,实验组肺腺癌A549细胞在加入浓度为0.025 mg/100µL的荧光多肽后,流式细胞仪检测发现大部分A549 细胞均结合了荧光多肽;而在竞争抑制实验组中可见,在预先加入4 倍剂量的cNGQGEQc-L(浓度为0.1 mg/100 µL)抑制后,A549 细胞几乎与荧光多肽无结合。结果提示cNGQGEQc-L 能够竞争抑制荧光多肽与A549细胞的结合。
2.5 荧光多肽FAM-cNGQGEQc-L在荷瘤裸鼠动物模型中的荧光显像研究
肺腺癌A549 细胞在裸鼠中建模成瘤时间约为6周,移植瘤肿瘤组织病理切片符合肺腺癌改变(图7)。荷瘤裸鼠注射荧光多肽FAM-cNGQGEQc-L 后,分别于1、2、5 h 处死裸鼠,分离主要脏器组织,进行活体离体脏器组织的荧光成像。显像结果显示上述3 个时间点肿瘤的荧光强度均强于大脑、肺、心、肝、脾(P<0.05)。肾脏可见到较强的荧光显示,胆囊及胃肠也可见明显荧光染料聚集,提示荧光探针可通过泌尿系统及胆道系统排泄。比较不同时间肿瘤与大脑、肺、心脏、肝脏、脾脏、肾脏荧光平均摄取值的肿瘤/非肿瘤比值(T/NT比值),发现随时间的延长肿瘤/肺、肿瘤/心、肿瘤/肝、肿瘤/脾的T/NT 比值呈逐渐上升的趋势。各脏器荧光摄取情况如图8所示。荷瘤裸鼠于注射后1、2 和5 h 各主要器官的T/NT 比值见表1,结果显示肿瘤摄取多肽要高于正常肝、脾、肺、心。
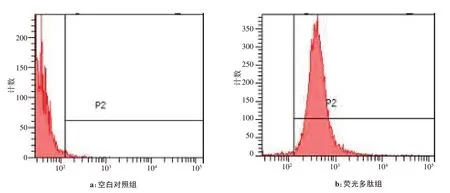
图4 肺腺癌A549细胞对荧光多肽FAM-cNGQGEQc-L 的摄取Fig.4 Uptake of fluorescence-labeled polypeptide FAM-cNGQGEQc-L in lung adenocarcinoma A549 cells
3 讨论
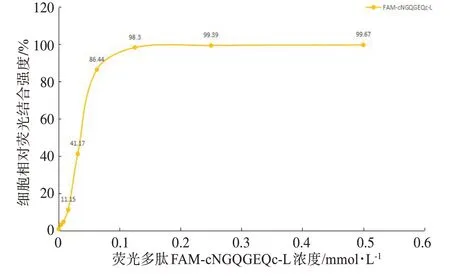
图5 肺腺癌A549细胞对不同浓度荧光多肽FAM-cNGQGEQc-L的摄取曲线Fig.5 Uptake curve of different concentrations of fluorescence-labeled polypeptide FAM-cNGQGEQc-L in lung adenocarcinoma A549 cells
尽管目前医疗技术取得很大的进展,癌症仍旧是全世界范围内导致死亡的一个主要原因,如果能找到合适的适用于肿瘤显像或治疗的靶点,无论是肿瘤诊断还是治疗都具有非常大的临床价值。分子影像是医学研究的热点,机体内存在某些细胞膜表面抗体、蛋白表达产物或蛋白酶等物质,这类物质可能在病理发生、发展过程中出现或表达上调,可作为诊断疾病的标志物,作为疾病诊断、治疗的靶点,能够在细胞水平及亚细胞层面提早发现病变,研制靶向分子探针是分子影像不可或缺的一部分[2,8-9]。

图6 肺腺癌A549细胞与FAM-cNGQGEQc-L 荧光结合的竞争抑制实验Fig.6 Competitive inhibition experiment of lung adenocarcinoma A549 cells combining with fluorescence-labeled polypeptide
图7 肿瘤HE染色病理切片图Fig.7 Tumor pathological slice with HE staining
整合素是一种跨膜蛋白,一种细胞表面受体,由亚基α 和β 组成,根据亚基组成的不同,整合素种类多样。目前在哺乳动物中共发现整合素24 种,由18个α 亚基和8 个β 亚基以非共价键结合的形式构成。整合素参与细胞间、细胞与细胞基质间的粘附、信息传递,还可介导细胞的增值、分化、凋亡等[10]。整合素受体可以作为靶点用于肿瘤显像或疾病治疗,目前研究应用较多的整合素有αvβ3、αvβ5、α4β7、α4β1等,整合素受体作为一种分子显像或治疗靶点具有很大的应用潜能[11-12]。有研究表明非小细胞肺癌细胞表面高表达整合素α3。1991年Lam等[13]提出利用“一珠一肽链”的组合化学肽库技术合成多肽分子,根据实验需要可以合成含有不同长度肽链的肽库。郭琳琅等[14]利用组合化学肽库技术筛选出来一种能够与非小细胞肺癌细胞表面整合素α3受体结合的小分子环肽cNGQGEQc,该环肽与肺癌细胞的结合可以被整合素α3βv 阻断。李贵平等[6]对小分子环肽cNGQGEQc 的相关实验研究中,成功地将放射性核素99mTc、131I 标记到环肽分子上并进行SPECT 显像研究,131I标记的小分子环肽cNGQGEQc对肺腺癌NCIH1975 细胞具有良好的亲和力及明显的靶向抑制作用。而小分子链肽cNGQGEQc-L的氨基酸序列与环肽cNGQGEQc 完全相同,但是两端半胱氨酸不形成二硫键,是链状排列的结构形式,链肽分子相对环肽合成更方便、更经济。

图8 注射荧光多肽FAM-cNGQGEQc-L 后1、2和5 h荷瘤裸鼠体内脏器组织的荧光显像图Fig.8 Fluorescence biodistribution maps of tumor-bearing nude mice at 1,2 and 5 hours after injection of fluorescence-labeled polypeptide FAM-cNGQGEQc-L
表1 荧光多肽FAM-cNGQGEQc-L 在荷瘤裸鼠体内的T/NT比值(± s)Tab.1 Tumor/non-tumor(T/NT)ratios of fluorescencelabeled polypeptide FAM-cNGQGEQ-L in tumor-bearing nude mice(Mean±SD)

表1 荧光多肽FAM-cNGQGEQc-L 在荷瘤裸鼠体内的T/NT比值(± s)Tab.1 Tumor/non-tumor(T/NT)ratios of fluorescencelabeled polypeptide FAM-cNGQGEQ-L in tumor-bearing nude mice(Mean±SD)
与1 h相比,*P<0.05;与2 h相比,△P<0.05
脏器大脑肺脏心脏肝脏脾脏肾脏胃十二指肠1 h 1.45±0.03 1.89±0.02 1.43±0.05 1.37±0.02 2.04±0.04 1.05±0.03 0.78±0.06 2 h 1.16±0.02*2.38±0.03*2.56±0.05*1.90±0.01*2.89±0.07*1.36±0.06*0.22±0.03*5 h 2.11±0.04*△2.53±0.06*3.42±0.08*△2.51±0.04*△3.95±0.03*△1.40±0.09*1.12±0.04*△
FAM 是一种常用的荧光素衍生物,内含苯环结构,是一种脂溶性物质。FAM 在激发光源的照射下发射出绿色荧光,可通过荧光显微镜或者多模式小动物活体成像系统观察荧光表达强度。若将FAM 与多肽分子连接,根据探测的荧光强度能够间接反映多肽分子的结合程度。荧光多肽分子探针常温下与细胞进行结合,不需要加热,而且相较于放射性核素探针,研究人员可以避免接受射线照射,减少辐射污染。本实验所需要的连接了FAM 的荧光探针FAMcNGQGEQc-L 经过质量检测其化学纯度均在98%以上,符合实验要求。倒置荧光显微镜下观察细胞体外荧光结合实验结果显示,荧光分子探针FAMcNGQGEQc-L 可以与A549 细胞结合,荧光多肽分子与细胞膜结合,并进入到细胞质中。流式细胞检测仪分析结果发现细胞与荧光多肽探针孵育1 h,细胞的相对荧光结合强度随着荧光多肽探针浓度的增加而增加,具有饱和性。采用4 倍浓度的多肽cNGQGEQc-L 进行荧光多肽的抑制实验时,流式细胞仪分析结果显示抑制效果显著,在孵育时间内几乎所有细胞均被抑制,证明荧光多肽与肺腺癌A549细胞的结合具有特异性。取注射荧光多肽探针的荷瘤裸鼠离体器官进行观察,荷瘤裸鼠活体成像显示肿瘤能够摄取荧光多肽,FAM-cNGQGEQc-L 荧光探针在5 h 的成像效果较好,荧光探针在肿瘤的荧光表达强度高于实体器官,如肝脏、脾脏、肺、心脏。荧光探针不但经过泌尿系统排泄,在胆囊和胃肠道也可见较多荧光染料聚集,考虑除了多肽本身的因素外,可能还与连接的荧光素相关,因为荧光素是一种脂溶性物质。离体脏器的活体成像结果表明,胃内可见有明显荧光染料浓聚,考虑可能是由于离体解剖过程中,邻近十二指肠内容物交叉污染导致。因此,仍有必要对该小分子多肽探针进行改性修饰以利于其进一步的转化应用。
综上所述,利用荧光素连接cNGQGEQc-L 构建荧光分子探针FAM-cNGQGEQc-L,体外、体内荧光实验结果显示,荧光分子探针cNGQGEQc-L 可与肺癌A549细胞、肺癌移植瘤结合,能够特异性靶向肺腺癌,因此小分子多肽cNGQGEQc-L 有望成为肺癌特异性诊断的新型分子探针。
