肝细胞癌癌组织Hic-5和COL1A1表达及其对术后生存的预测价值*
2020-07-10顾世玉秦文举高建芝薛明辉
顾世玉,秦文举,高建芝,薛明辉
肝细胞癌(hepatocellular carcinoma,HCC)是一种常见的原发性肝癌(primary liver cancer,PLC),约占所有PLC的90%[1]。HCC患者早期临床症状隐匿,就诊时往往已发展为中晚期,临床预后较差[3]。目前,主要采取外科手术根治性切除肿瘤治疗,但术后复发率和转移率高,易导致临床治疗失败,5 a生存率较低[2]。寻找HCC的分子标志物,正确评估患者的预后,指导临床治疗,具有重要的意义。氧化氢诱导的克隆基因-5(hydrogen peroxide inducible clone-5,Hic-5)也称为生长转化因子β诱导转录基因,是转化生长因子(transforming growth factor,TGF)-β1信号通路的辅助启动因子,参与调控细胞增殖分化、肿瘤细胞迁移和侵袭等生物学过程[4]。I型胶原α1链(collagen type I alpha gene,COL1A1)是细胞外基质的组成成分,与细胞的生长、增殖、分化密切相关[5]。临床研究显示[6,7],Hic-5和COL1A1参与了调控肝组织的纤维化,且在多种恶性肿瘤均存在异常高表达,但其在肝癌组织的表达研究较少,对肝癌患者预后的影响尚不清楚。因此,本研究检测了HCC患者癌组织Hic-5和COL1A1表达情况,并分析了它们对HCC患者术后生存的影响,现将结果报道如下。
1 资料与方法
1.1 一般资料 2013年9月~2016年7月在本院行肝癌切除术治疗的HCC患者97例,男66例,女31例;年龄30~75岁,平均年龄为(54.4±10.2)岁。均经影像学检查和术后组织病理学检查确诊为HCC。根据CT和MRI检查结果,确定肿瘤直径≤5 cm 者43例,>5 cm者54例;根据Edmondson分级法[8],Ⅰ期12例,Ⅱ期30例,Ⅲ期36例,Ⅳ期19例;TNM分期:Ⅰ期17例,Ⅱ期38例,Ⅲ期30例,Ⅳ期12例;存在血管侵犯43例,存在门静脉癌栓40例;甲胎蛋白(alpha fetoprotein,AFP)≥400 ng/mL者58例,AFP<400 ng/mL者39例。排除标准:转移性肝癌、存在其他恶性肿瘤、无法耐受手术治疗、凝血功能异常、存在心、脑、肺、肾等重要脏器功能异常、有肝移植手术史者。患者给出知情同意书,本研究经我院医学伦理委员会审核通过。
1.2 手术方法 根据肿瘤大小和部位,对所有纳入HCC患者选择性行肝叶、肝段、半肝和局部切除术。
1.3 肝组织Hic-5和COL1A1检测 采用免疫组化法检测,无菌取HCC患者癌组织和癌旁组织,进行常规的固定、脱水、包埋和切片。切片依次经二甲苯和梯度酒精脱水,采用柠檬酸修复缓冲液进行抗原修复,经PBS洗涤后加入3%过氧化氢溶液,室温避光孵育25 min,用PBS洗涤后,加入牛血清白蛋白封闭30 min,分别加入兔抗人Hic-5多克隆抗体(1:100,北京绿源伯德生物科技有限公司)和兔抗人COL1A1多克隆抗体(1:100,北京绿源伯德生物科技有限公司),4℃下孵育过夜,加二抗37℃下孵育1 h,经DAB显色,苏木素复染细胞核2 min,常规梯度酒精和二甲苯脱水封片,于显微镜下镜检,发现细胞膜和胞质出现棕黄色颗粒者为阳性表达。
1.4 肝组织Hic-5和COL1A1 mRNA检测 采用实时荧光定量(real-time,RT)-PCR法测定,无菌取HCC患者癌组织和癌旁组织,匀浆,采用RNA提取试剂盒(北京索莱宝科技有限公司)提取组织总RNA,采用反转录试剂盒(北京索莱宝科技有限公司)将总RNA反转录合成cDNA,使用RT-PCR分析仪(美国ABI公司,7500型)行实时RT-PCR反应, Hic-5上游引物:5′-GCAGCTTCTTCGAGAAGGATG-3′,下游引物:5′-TGAGCGCCGAGATGTAGTTATC-3′,PCR反应条件:95℃预变性5 min,95℃变性15 s,58℃退火20 s,72℃延伸20s,共40个循环。COL1A1上游引物:5′-ATCAACCGGAGGAATTTCCGT-3′,下游引物:5′-CACCAGGACGACCAGGTTTTC-3′, PCR反应条件:95℃预变性5 min,95℃变性15 s,60℃退火20 s,72℃延伸20s,共40个循环。以GAPDH作为内参照,计算Hic-5和COL1A1相对水平。
1.5 随访 患者出院后,在门诊复查或电话随访。治疗后1年内每3个月门诊复查1次,2年内半年复查 1次,以后至少每年复查一次,随访截止至2019年8月。所有患者均随访36个月。随访时,记录肿瘤复发或转移、生存和死亡。

2 结果
2.1 HCC癌组织Hic-5和COL1A1蛋白表达情况 HCC患者癌组织Hic-5和COL1A1阳性表达率显著高于癌旁组织(P<0.05,图1和表1)。
2.2 不同临床和病理学特征的HCC患者癌组织Hic-5和COL1A1 mRNA阳性率比较 见表2。

表1 癌组织与癌旁肝组织Hic-5和COL1A1阳性率(%)比较
与癌旁组织比,①P<0.05
①P<0.05
2.3 癌组织Hic-5和COL1A1阳性表达对HCC患者术后3 a生存时间的影响 本研究纳入97例患者,共获得87例(89.7%)患者的生存资料,失访10例(10.3%)。87例患者生存时间为8.2~36.0个月,中位生存时间为36.0(14.6,36.0)个月。生存分析显示,癌组织Hic-5阳性表达患者3 a生存率和3 a无事件生存率显著低于Hic-5阴性表达者,差异具有统计学意义(P<0.05),但癌组织COL1A1阳性表达患者3 a生存率和3 a无事件生存率与癌组织COL1A1阴性表达者比较,差异无统计学意义(P>0.05,图2、表3)。
图1 HCC癌组织Hic-5和COL1A1表达(SP,400×)A:癌旁组织Hic-5表达;B:癌组织Hic-5表达;C:癌旁组织COL1A1表达;D:癌组织COL1A1表达

图2 癌组织Hic-5 mRNA阳性与阴性患者生存时间比较
表3 癌组织Hic-5和COL1A1 mRNA阳性与阴性患者生存时间【M(IQR)】比较
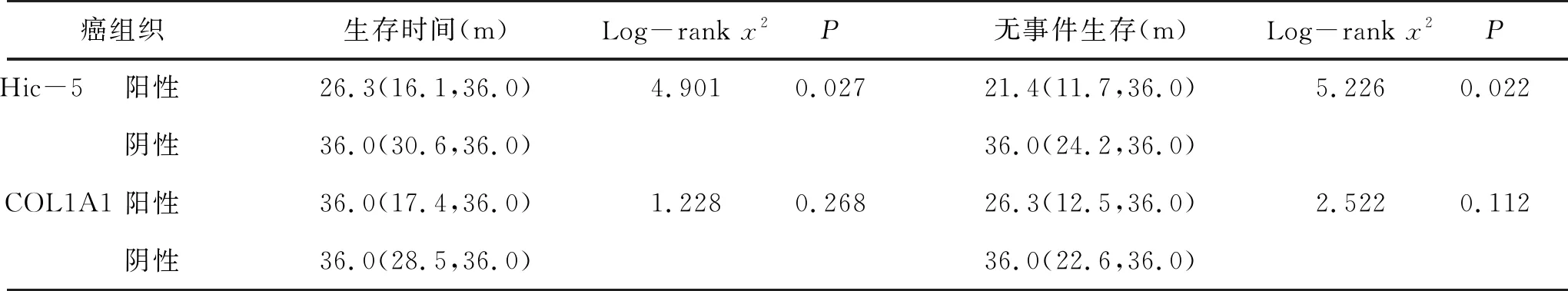
癌组织生存时间(m)Log-rank x2P无事件生存(m)Log-rank x2PHic-5 阳性26.3(16.1,36.0)4.9010.02721.4(11.7,36.0)5.2260.022阴性36.0(30.6,36.0)36.0(24.2,36.0)COL1A1 阳性36.0(17.4,36.0)1.2280.26826.3(12.5,36.0)2.5220.112阴性36.0(28.5,36.0)36.0(22.6,36.0)
3 讨论
HCC是一种常见的恶性肿瘤,具有高侵袭性,术后易发生复发和转移,严重影响了患者的预后生存[9]。HCC患者的发生发展涉及多个因素、多个信号通路,其发病机制尚不明确,研究影响HCC患者预后的分子标识物,对于指导临床用药和新靶向药物的研发具有重要意义。本研究发现HCC患者癌组织Hic-5表达阳性率显著高于癌旁组织。Hic-5属于LIM蛋白家族,是细胞内TGF-β1信号通路的特异性辅助启动因子,通过调节TGF-β相关通路,调控多种细胞的生长和增殖等[10]。Hic-5与肝纤维化的发生发展有关,过表达的Hic-5可以促进细胞外基质的合成,促进肝纤维化的形成,促进肝癌的发生,提示HCC组织过表达的Hic-5参与了HCC的发生发展[11]。TNM分期和门静脉癌栓是临床常用的评估HCC患者疾病发展的指标,与HCC患者预后密切相关[12],癌组织Hic-5表达可能与患者预后差有关。本研究发现HCC癌组织COL1A1表达阳性率显著高于癌旁组织,且其阳性表达与HCC患者TNM分期、是否存在门静脉癌栓密切相关,提示癌组织COL1A1表达可能也与HCC患者预后有关。COL1A1是编码Ⅰ型胶原纤维的前α1链,组成细胞外基质的重要成分,可以参与调节细胞间的黏附和分化[13]。临床研究显示[14,15],COL1A1基因在前列腺癌、胰腺癌、乳腺癌等多种恶性肿瘤中均存在异常高表达,异常高表达的COL1A1基因可能通过改变肿瘤微环境,提高肿瘤细胞的运动和迁移能力,从而促进肿瘤细胞的侵袭和转移,提示COL1A1基因可能通过参与调控肿瘤细胞的侵袭和转移,加快HCC的恶性发展。
Hic-5可以激活TGF-β1信号通路,调节细胞外基质的合成,COL1A1是细胞外基质的主要成分,提示Hic-5可能促进了COL1A1的表达[16,17]。Hic-5在肝癌组织表达明显上调,上调的Hic-5可能通过促进COL1A1的表达,促进Ⅰ型胶原的合成,促进肝组织纤维化,促进HCC的发生[18]。在三维细胞外基质模型,发现Hic-5是肿瘤细胞表型的关键调节因子,可用于预测肿瘤细胞在体内的迁移和侵袭行为[19]。Ⅰ型胶原可以通过调节非小细胞肺癌E-钙黏蛋白介导的细胞间黏附作用,促进癌细胞的增殖、侵袭和迁移[20]。本研究发现Hic-5表达与HCC患者的预后有关,癌组织Hic-5阴性表达患者3 a生存率显著长于Hic-5阳性表达患者。
综上所述,HCC患者癌组织Hic-5过表达可能预示预后差,是否与肿瘤分期较晚或存在门静脉癌栓有关,需要进一步研究。
