小儿二尖瓣关闭不全瓣膜成形术的临床疗效分析
2020-07-09莫绪明
范 明 莫绪明 陈 俊 孙 剑
彭 卫1,2 戚继荣1,2 武开宏1,2
小儿二尖瓣关闭不全是一组较为少见的先天性心脏瓣膜畸形,由于二尖瓣病理结构复杂,通常会合并其他心脏畸形,小儿二尖瓣关闭不全的手术治疗一直是外科学中一项较为艰巨的挑战[1]。 目前二尖瓣关闭不全的常用外科治疗方法为二尖瓣成形术和二尖瓣置换术。 二尖瓣成形术可以最大限度地保留二尖瓣的原始结构,维持二尖瓣及左心室功能,促进二尖瓣正常的血流动力学恢复,是临床首选术式。 本研究收集2012 年1 月至2019 年1月南京医科大学附属儿童医院心胸外科202 例采用二尖瓣成形术治疗的二尖瓣关闭不全(不包括房室间隔缺损)患儿临床资料,现将治疗效果报告如下。
材料与方法
一、临床资料
收集2012 年1 月至2019 年1 月由南京医科大学附属儿童医院心胸外科收治的202 例二尖瓣关闭不全(不包括房室间隔缺损)患儿作为研究对象,其中男童84 例,女童118 例,手术年龄范围为1 ~179个月,平均为(21.2 ±33.3)个月,体重范围为3.2 ~49 kg,平均为(9.92 ±6.75)kg。 所有患儿术前行经胸超声心动图,评估二尖瓣关闭不全潜在的病理类型及反流程度。 本次研究中二尖瓣反流分级的定义主要参考美国超声心动图学会(American Society of Echocardiography,ASE)指南[2],用反流束面积/左房面积比值评估反流程度,当左房扩大时,评估标准为少量: <20%;中量:20%~40%;大量: >40%。当左房无扩大时,评估标准从严,评估标准为少量:<25%;中量:25%~50%;大量: >50%。 对每个患儿行超声检查时均应综合考虑,包括瓣叶的形态、左心室的大小、反流束的血流汇聚、反流束宽度、反流束面积,甚至反流频谱的形态等多个因素。 在至少两个切面上进行评估,同时分析反流的形成机制,以鉴别最常见的裂缺反流和中央性反流。 入组患儿均为中量以上反流,其中大量反流22 例,中-大量反流26 例,中量反流154 例。 由于二尖瓣关闭不全病理类型复杂,本组研究以Carpentier 分型[3]为标准,将其分为瓣叶活动正常型112 例,瓣叶脱垂型54 例,瓣叶活动异常型36 例。 单纯性二尖瓣关闭不全24 例,余178 例合并一种以上其他心脏畸形,包括室间隔缺损146 例、房间隔缺损27 例、动脉导管未闭26 例、主动脉缩窄12 例、左室流出道狭窄9 例、法洛四联征5 例等,合并三尖瓣反流22 例。
二、方法
所有患儿在全麻、中低温、体外循环下行二尖瓣成形术,通过胸骨正中切口,经右心耳注入肝素,常规行主动脉和腔静脉插管,建立体外循环。 转流降温,于主动脉根部注入心脏停跳液,4℃冰水于心脏表面降温以保护心肌。 经右心房房间隔切口暴露二尖瓣,通过注水试验仔细观察瓣叶、瓣环、腱索和乳头肌位置及功能。 采用标准三步法: ①处理瓣下结构,增加瓣下活动度; ②改善瓣叶对合; ③折叠并加固二尖瓣环。 结合术中经食管超声心动图确定二尖瓣病理类型及反流程度,选择最佳手术方法。 手术过程中同期矫治其他心脏畸形。 所有患儿术后定期行TTE 检查,记录患儿左室舒张末期内径(left ventricular end diastolic dimension,LVDD)、左房内径(left atrial dimension,LAD)、主肺动脉内径(main pulmonary artery dimension,MPA)、左室射血分数(left ventricular ejection fraction,LVEF)以及反流程度等指标,并与术前比较,评估患儿二尖瓣及左心室功能改善情况。
三、统计学处理
所有数据均采用SPSS 19. 0 统计软件进行分析,对于年龄、体重、体外循环时间、LVDD、LAD、MPA 等计量资料采用均数± 标准差(x±s)表示。对手术前后心功能以及反流程度变化采用配对χ2检验。 手术前与手术后各随访时间段LVDD、LAD、MPA 的比较采用方差分析(Dunnett 检验)。 以P<0.05 为差异具有统计学意义。
结 果
本组202 例患儿均在体外循环下行手术治疗,无术中死亡病例。 平均体外循环时间为(75.89 ±51.36)min,平均主动脉阻断时间为(45. 65 ±17.89)min。 术中病理改变主要包括二尖瓣瓣环扩大58 例,瓣叶裂54 例,瓣叶脱垂54 例,瓣叶活动受限36 例,降落伞样二尖瓣5 例。 最终手术方法包括:①瓣环成形术91 例,包括Wooler-key 成形术15 例,改良De Vega 环缩76 例; ②瓣叶裂缝合54 例;③双孔成形术80 例; ④腱索修复12 例(腱索缩短、转移8例,人工腱索植入4 例); ⑤乳头肌修复5 例:包括乳头肌开窗或劈开,主要用于降落伞样二尖瓣畸形。 所有患儿术中复跳后均行食管超声心动图检查,5 例中度以上反流者再次体外成形,术毕反流改善,无中量以上反流。 术后免于再次成形率为92.6%。 早期死亡定义为住院或术后30 d 内死亡,早期死亡5 例(2.5%),其中1 例合并重度肺动脉高压,于术后第2天死亡;1 例术后出现心力衰竭和弥漫性血管内凝血(diffuse intravascular coagulation,DIC),于术后第3 天死亡;1 例术后出现急性肾衰竭,于术后第10 天死亡;1 例合并法洛四联征,术后仍有中-大量反流,并出现多器官功能衰竭,于术后第8 天死亡;1 例术前有严重支气管肺炎、重度肺动脉高压,术后患儿心肺功能差,不能脱离呼吸机,于术后第6 天死亡。
对早期存活的197 例患儿进行随访,随访时间1 ~68 个月,平均随访(19.49 ±17.48)个月。 14 例术后远期行二次二尖瓣成形术,其中2 例分别植入25 mm、29 mm 成形环,1 例采用Gortex 人工血管补片做成形瓣环,其余患儿均行成形术。 1 例行3 次二尖瓣成形术,目前二尖瓣仍有中量反流。 中晚期死亡3 例(1.5%),其中1 例合并主动脉缩窄,术后5 个月仍然出现二尖瓣大量反流,并出现二尖瓣狭窄,行二次成形手术,于术后1 个月因心力衰竭而死亡;1 例二尖瓣大量反流,术后2 年由于二尖瓣仍存在中量反流,遂植入25 mm 成形环,后因多脏器功能衰竭死亡;1 例合并Williams 综合征,于术后1 年出现二尖瓣中-大量反流,后再次手术,于术后3 年死亡。 其总体存活率为96.0%。
所有患儿术后定期行TTE 评估及术前二尖瓣功能及左心室功能差异评估。 术后1 年患儿心功能分级(NewYork Heart Association,NYHA)为Ⅰ级117例,Ⅱ级56 例,Ⅲ级23 例,与术前心功能分级Ⅰ级35 例,Ⅱ级92 例,Ⅲ级47 例,Ⅳ级28 例相比明显改善,差异有统计学意义(χ2=69.09,P=0.00),见图1。 术后2 年内的LVDD、LAD、MPA 与术前相比明显改善,差异有统计学意义(P<0.05),见表1。术后1 年患儿无反流41 例,少量反流119 例,中量反流11 例,大量反流1 例,与术前相比亦得到很大改善,见图2。
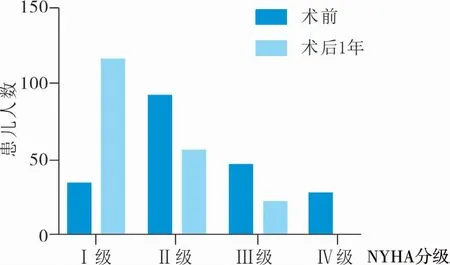
图1 二尖瓣关闭不全患儿术前与术后1 年心功能对比Fig.1 Comparing cardiac functions at 1 month before and after surgery
表1 二尖瓣关闭不全患儿术前与术后各随访时段LVDD、LAD、MPA 测量值比较(±s)Table 1 Comparing preoperative and postoperative measurements of LVDD,LAD and MPA(±s)

表1 二尖瓣关闭不全患儿术前与术后各随访时段LVDD、LAD、MPA 测量值比较(±s)Table 1 Comparing preoperative and postoperative measurements of LVDD,LAD and MPA(±s)
注 *:与术前相比,P<0.05
组别LVDD(mm)LAD(mm)MPA(mm)术前36.53 ±8.08 24.71 ±7.10 17.18 ±3.66术后1 个月32.39 ±6.77*20.7 ±5.47*14.92 ±3.45*术后3 个月31.43 ±6.20*19.76 ±5.44*14.30 ±2.97*术后6 个月31.7 ±5.38*20.01 ±4.92*14.66 ±2.78*术后12 个月33.17 ±5.05*20.54 ±4.46*16.47 ±9.30*术后24 个月33.95 ±6.13 21.73 ±5.53*15.39 ±2.32*术后36 ~68 个月16.19 ±1.93 36.71 ±3.63 26.52 ±8.93
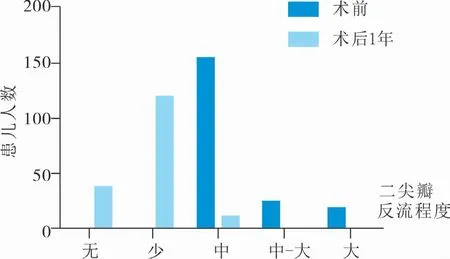
图2 二尖瓣关闭不全患儿术前与术后1 年二尖瓣反流程度比较Fig.2 Comparing reflux extent of mitral value at 1 year before and after surgery in children
讨 论
小儿二尖瓣关闭不全的病理类型复杂,通常会合并其他心脏畸形,由于患儿年龄过小,瓣膜组织极其脆嫩,缝合困难,加之瓣膜发育需要和患儿发育同步生长等,导致小儿二尖瓣畸形的矫治具有很大的挑战性。 目前主要的外科治疗方法为二尖瓣成形术和二尖瓣置换术。 由于小儿二尖瓣空间结构小,不同年龄段瓣环差异很大,加之先天性二尖瓣畸形发病率较低,因此很难找到合适的人工瓣。除此以外,二尖瓣置换术后患儿需要终身抗凝,出现血栓风险较大,且极大破坏了二尖瓣的原始结构,降低了患儿术后的生存率,因而目前临床上治疗方式首选二尖瓣成形术[4]。 二尖瓣成形术可以最大限度保留二尖瓣原始结构,维持了二尖瓣的功能结构和左心室功能,避免了二尖瓣置换术可能引发的出血、血栓等并发症,提高了患儿的生活质量。有研究提示二尖瓣成形术的远期疗效和生存率明显高于二尖瓣置换术[5]。
小儿二尖瓣结构的复杂性往往预示着手术修复的困难程度。 因此,为了获得良好的手术效果,在决定行二尖瓣成形术前,需根据患儿临床症状以及超声心动图评估二尖瓣病理类型以及功能状态,术中需充分暴露二尖瓣的各个结构,通过食管超声心动图结合注水试验确定最终的病理结构和反流程度,成形时采用标准三步法,最终拟定针对性的手术方案[6]。 本研究参考成人二尖瓣成形经验,采用标准三步法处理,较好地解决了小儿二尖瓣成形术操作规范性的问题。
瓣环成形术是二尖瓣成形术的基础。 瓣环成形术可以稳定修复效果并增加前后瓣叶的对合面积,减少瓣叶对合张力。 除了单纯性瓣叶裂不需要行瓣环成形术外,其余病理类型的修复都需考虑加行瓣环成形术[7]。 目前常用的瓣环成形术为: ①Wooler-key 成形术,即用Gortex 线带自体心包垫片分别缝合折叠环缩前后瓣交界; ②改良De Vega 环缩。 罗又桥等[8]认为对于1 岁以上的患儿可行后瓣大部分环缩,对于2 岁以上患儿适用于“C”型瓣环。 但随着患儿的生长发育,婴幼儿后瓣环环缩不应超过2/3 二尖瓣环,太小会导致二尖瓣狭窄。 对于年龄较大患儿,可以考虑行人工环植入,但小儿二尖瓣常伴有有瓣叶及乳头肌问题,人工环植入并不一定有很好的成形效果[9]。 本组有3 例使用成形环技术,其中1 例死亡。 单纯的瓣叶裂只需要间断缝合裂隙,不主张加用垫片,以避免影响瓣叶活动度。 对于腱索断裂、延长或其他原因导致瓣叶脱垂者,大龄患儿可行人工腱索植入或者腱索转移。人工腱索植入需选择最佳的植入点,其最大的困难是植入腱索长度的选择,太长或太短都会导致瓣叶对合不良,目前常用Loop 技术植入人工腱索[10]。腱索转移使用自体腱索,将正常瓣叶区腱索转移至脱垂区,一般无腱索长短选择问题,但仅能使用于较大年龄患儿。 本研究中有4 例行人工腱索植入,其中有1 例术后出现中量以上反流,术后长期使用强心、利尿药物维持心功能,术后1 年再次行二尖瓣成形术,予双孔成形术,术后二尖瓣反流缓解,目前仍在随访中。 二尖瓣双孔成形技术已经有20 余年的历史,主要针对二尖瓣中重度以上脱垂、二尖瓣结构发育不良致中心性反流经环缩技术处理等不满意的患儿,特别是婴幼儿和新生儿,因对腱索转移与人工腱索很难适用,所以二尖瓣双孔成形术更为适用[11]。 该术式的关键在于寻找最佳对合点,由于临床上对合点一般不是前后瓣叶的中点,成形时需反复注水观察,术中注意避免瓣叶撕裂或是缝合过多导致二尖瓣狭窄[12]。 患儿术后近中远期二尖瓣狭窄的疑问是二尖瓣双孔成形术早期比较担心的问题,但经过多年随访,只要使用方法适当,并无证据证实二尖瓣狭窄的发生率较高。 已有研究报道认为,行双孔成形患儿术后血流动力学与同面积的自然二尖瓣无明显差异,其对跨二尖瓣压力阶差和血流流速无明显影响,亦不会减少瓣口面积导致人为的二尖瓣狭窄[13]。 2017 年Vricella 等[14]回顾性分析了18 例行双孔成形术患儿,只有1 例早期死亡,其余术后恢复尚可,94.4%的患儿为轻度及以下反流,患儿术后无二尖瓣狭窄与二尖瓣前叶收缩期向前运动现象(systolic anterior motion,SAM),手术疗效稳定。 莫绪明等[12]此前亦对102 例行双孔成形术患儿进行了长期随访,发现患儿术后早期均无狭窄,中期随访有4 例狭窄,远期无新增狭窄患儿,同时该4 例狭窄患儿远期无加重现象。 本组随访也有相同的结果。
由于患儿二尖瓣有生长发育潜能,术后需使用超声心动图监测患儿二尖瓣及左心室各项指标,本研究发现患儿术后2 年内LVDD、LAD、MPA 与术前相比先是明显缩小,后缓慢增大,最终升至正常水平,术后心功能亦得到了很大恢复。 这表明二尖瓣成形术对小儿二尖瓣关闭不全具有很好的疗效。 不过小儿二尖瓣关闭不全病理结构复杂,必须根据超声心动图以及术中直接观察结果实施综合治疗措施。对于使用一种成形方法效果不确切或者存在多处畸形的患儿,需根据术者经验联合使用多种术式,而这恰恰是小儿二尖瓣关闭不全外科治疗的难点。
总之,对于小儿二尖瓣关闭不全,二尖瓣成形术是首选术式,可改善大部分患儿二尖瓣功能以及促进心功能恢复,有着很好的临床疗效。 但是由于婴幼儿自身的生理结构不完善以及二尖瓣病理类型的多样性,术中需要选择一种或联合多种针对性的成形术式,因此二尖瓣成形术对外科医生而言具有很大的挑战性。
