当归四逆汤治疗糖尿病周围神经病变靶点预测和机制探讨
2020-07-09邢琪昌陈佳刘征江雅琴李伟
邢琪昌,陈佳,刘征,江雅琴,李伟
当归四逆汤治疗糖尿病周围神经病变靶点预测和机制探讨
邢琪昌,陈佳,刘征,江雅琴,李伟
湘潭市中心医院药学部,湖南 湘潭 411100
采用网络药理学方法对当归四逆汤治疗糖尿病周围神经病变(DPN)的相关靶点进行预测,并探讨其作用机制。利用中药系统药理学数据库与分析平台(TCMSP)筛选当归四逆汤有效成分和相关靶点蛋白,通过Drugbank、TTD、DisGeNET数据库检索并筛选DPN疾病相关靶点,整合筛选出当归四逆汤有效成分与DPN交集靶点,运用Cytoscape3.2.1软件构建当归四逆汤成分-靶点-疾病网络,通过在线分析工具Enrichr对当归四逆汤治疗DPN作用靶点进行GO生物过程和KEGG通路富集分析。当归四逆汤中28个活性成分对应作用于152个靶点蛋白,其中32个靶点与DPN相关。富集分析结果显示,该方可能通过作用MAPK级联正向调节等生物过程和糖基化终末产物-受体等信号通路发挥作用。当归四逆汤治疗DPN具有多靶点、多途径、整体调节作用特点。
当归四逆汤;糖尿病周围神经病变;网络药理学;靶点;机制
糖尿病周围神病变(diabetic peripheral neuropathies,DPN)是临床最常见的糖尿病慢性并发症之一。DPN患者临床多见温觉或痛觉异常、感觉和运动神经元传导功能下降,表现为肢体麻木、疼痛,甚至感觉障碍、肌肉无力等症状和体征,严重危害糖尿病患者生存质量,是患者致残、致死的危险因素。根据DPN临床表现,可将其归属于中医学“痿证”“血痹”等范畴,其病机主要与病程日久所致阴阳气血亏虚、血行瘀滞、脉络痹阻等相关[1]。临床可将DPN分为气虚血瘀、阳虚寒凝等证型,当归四逆汤为治疗阳虚寒凝型DPN之方药[2-3]。
当归四逆汤出自《伤寒论•辨厥阴病脉证并治》:“手足厥寒,脉细欲绝者,当归四逆汤主之。”该方由当归、桂枝、白芍、细辛、通草、甘草和大枣组成。方中当归入肝经,行补血活血之用;桂枝味辛温,温经通脉;白芍养血平肝;细辛外温经脉,内通脏腑;通草通经脉;甘草、大枣调和诸药。全方共奏充阴血、除客寒、振阳气、通经脉之功,以达温手足而脉亦复之效。现代临床中,当归四逆汤被广泛应用于血管性头痛、坐骨神经痛、肩周炎等疾病[4],药理研究表明其具有抗凝、抗血栓[5]及扩张末梢血管、镇痛、抗炎、解痉等作用[6]。然而当归四逆汤治疗DPN的作用机制目前尚不明确。
中药以其多成分、多靶点、多途径的作用特点在疾病治疗中具有独特优势,同时也为阐释其作用机制和物质基础带来巨大挑战。近年来,网络药理学技术的诞生与发展为中药复方研究提供了新的思路和策略,其基于药物成分-靶点-疾病等多层次的相互作用网络,整体性、系统性阐释药物与疾病的关联,其特点与中药及其方剂作用的整体性、复杂性相契合[7]。本研究以当归四逆汤主要活性物质为研究对象,运用网络药理学方法构建成分-靶点-疾病网络,系统预测作用靶点,为深入阐释当归四逆汤治疗DPN的作用机制提供依据。
1 资料与方法
1.1 药物化学成分检索与筛选
通过中药系统药理学数据库与分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)[8]检索当归四逆汤中当归、白芍、桂枝、细辛、通草、甘草、大枣的化学成分,并以口服生物利用度(OB)≥30%、类药性(DL)≥0.18为条件筛选所得化合物。
1.2 有效成分-靶点网络构建
将筛选后的化合物编号输入TCMSP,检索其对应靶点,整理获得化合物-靶点Excel表格,上传至Cytoscape3.2.1软件,生成药物-靶点相互作用网络图。
1.3 疾病靶点搜集
通过Drugbank(https://www.drugbank.ca/)、TTD(https://db.idrblab.org/ttd/)、DisGeNet(http://www. disgenet.org/)数据库[9-11],以“diabetic peripheral neuropathies or diabetic neuropathy”为检索词,搜集与DPN相关的靶点。
1.4 药物有效成分与疾病交集靶点网络构建
将当归四逆汤有效成分靶点通过Uniprot转换为对应基因名并对应注明Uniprot ID。将搜集到的DPN疾病相关靶点与药物有效成分靶点置于同一列,运用Excel(Office 365 MSO)筛选功能,以Uniprot ID为查询条件,映射出当归四逆汤每个活性成分靶点与DPN疾病相关靶点重合部分,获得成分靶点与疾病靶点交集的关键靶点,并构建成分-靶点-疾病网络。
1.5 靶点富集分析与机制预测
运用在线基因集富集分析工具Enrichr(http://amp.pharm.mssm.edu/Enrichr/)分析药物有效成分与疾病交集关键靶点基因的GO生物过程和KEGG通路[12],挖掘并预测当归四逆汤治疗DPN作用机制相关途径和通路。对所得KEGG通路进行深入挖掘,预测并构建当归四逆汤治疗DPN的分子网络图。
2 结果
2.1 当归四逆汤活性化合物及其靶点
通过TCMSP共收集到当归四逆汤化合物813个,其中当归125个、桂枝106个、细辛67个、通草32个、白芍77个、大枣125个、甘草280个。按OB≥30%、DL≥0.18条件筛选后,得到当归2个、桂枝5个、细辛8个、通草4个、白芍13个、大枣28个、甘草92个,经去重,共得到138个化合物。检索其对应靶点,结果显示有28个化合物分别作用于152个靶点,见表1。
表1 当归四逆汤活性化合物基本信息
化合物代码化合物名称OB/%DL靶点数来源 MOL000449Stigmasterol43.830.7644当归 MOL000073ent-Epicatechin48.960.2418桂枝 MOL001736(-)-taxifolin60.510.2718桂枝 MOL001558sesamin56.550.8324细辛 MOL001460Cryptopin78.740.7245细辛 MOL000359sitosterol36.910.75 6通草 MOL001918paeoniflorgenone87.590.37 3白芍 MOL001919Compound 143.560.53 5白芍 MOL001924paeoniflorin53.870.79 2白芍 MOL001928albiflorin_qt66.640.33 2白芍 MOL000096(-)-catechin49.680.2422大枣 MOL000098quercetin46.430.2887大枣 MOL000211Mairin55.380.78 4大枣 MOL000358beta-sitosterol36.910.7551大枣 MOL000492(+)-catechin54.830.2423大枣 MOL000627Stepholidine33.110.5445大枣 MOL000787Fumarine59.260.8344大枣 MOL001454berberine36.860.7829大枣 MOL001522(S)-Coclaurine42.350.2437大枣 MOL000239Jaranol50.830.2921甘草 MOL000354isorhamnetin49.600.3136甘草 MOL000392formononetin69.670.2136甘草 MOL000417Calycosin47.750.2425甘草 MOL000422kaempferol41.880.2455甘草 MOL000497licochalcone a40.790.2931甘草 MOL000500Vestitol74.660.2132甘草 MOL001484Inermine75.180.5431甘草 MOL001792DFV32.760.1824甘草
2.2 当归四逆汤成分-靶点-疾病网络
共搜集到DPN相关靶点114个,将其与当归四逆汤152个成分靶点蛋白取交集,得到当归四逆汤治疗DPN作用靶点32个,通过Cytoscape3.2.1构建成分-靶点-疾病网络,结果见图1。
2.3 GO生物过程和KEGG通路富集分析
将32个交集靶点输入Enrichr,检索后查看Ontologies项下GO Biological Process 2018(sorted by p-value ranking),结果见图2;查看Pathways项下KEGG 2019 Human(sorted by p-value ranking),值最小的前10位生物过程和通路见图3。
2.4 潜在分子机制
对上述成分-靶点和作用通路进行深入挖掘。当归四逆汤有效成分可能直接作用于阿片受体(OPR)和去甲肾上腺素受体(ADR),产生镇痛疗效;通过作用于乙酰胆碱受体(CHRM)影响神经信号传导;通过作用于胰岛素受体(INSR)参与调节脂肪酸代谢,减少脂毒性;此外,当归四逆汤也可参与周围神经组织炎性因子的合成与释放过程,从而减少神经细胞功能损伤;糖基化终末产物(AGEs)可能通过结合其受体(RAGEs),进一步激活NADPH氧化酶,诱导氧化应激,并通过p38(MAPK)途径活化核因子-κB(NF-κB),从而调控白细胞介素(IL)-1B、IL-6、肿瘤坏死因子(TNF)-α等细胞因子引起神经细胞凋亡,当归四逆汤可直接或间接调控该通路中相关蛋白,发挥治疗DPN作用。见图4。
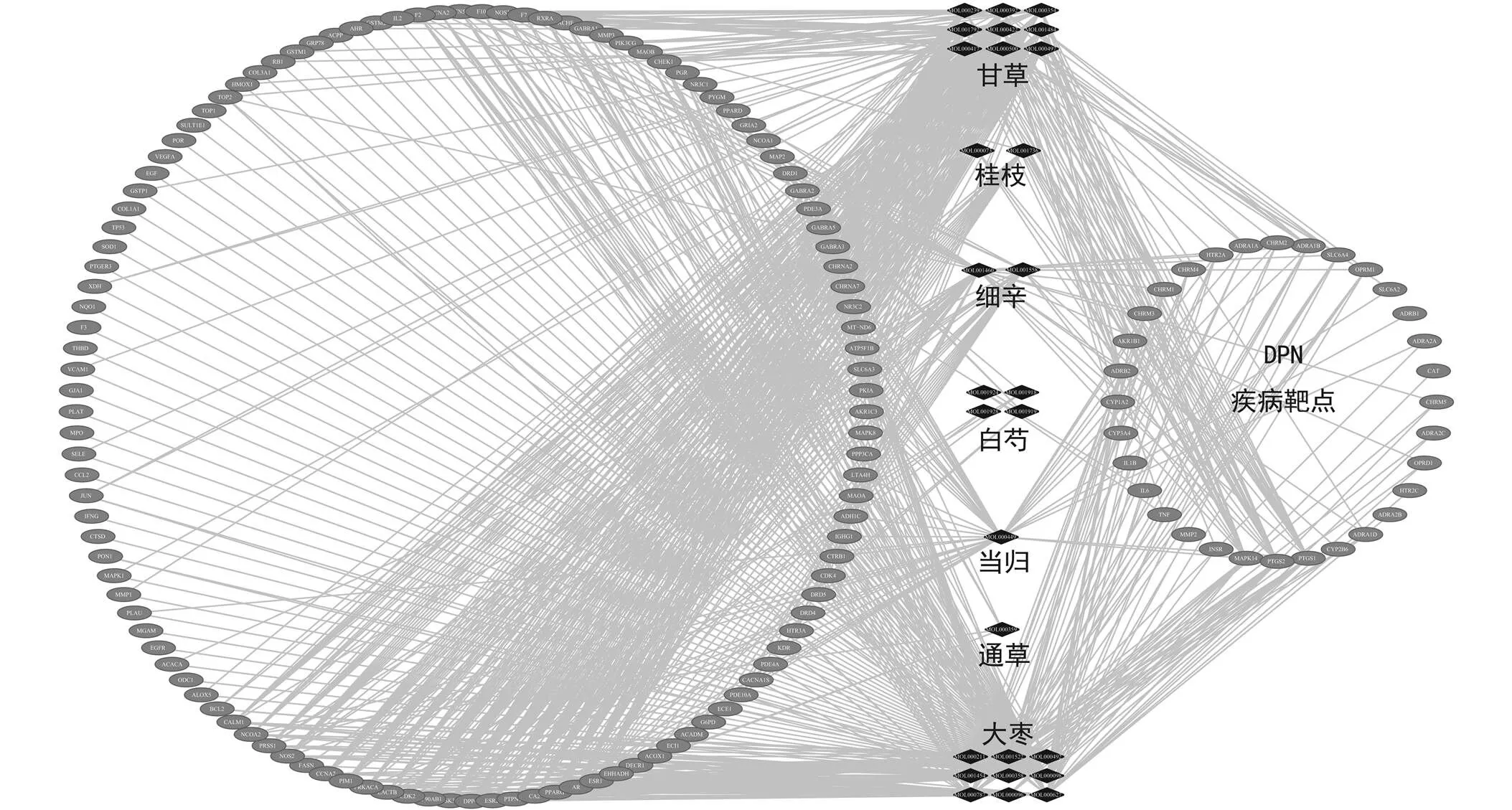
注:菱形代表化合物,椭圆代表靶点

图2 当归四逆汤治疗DPN靶点GO生物过程富集分析

图3 当归四逆汤治疗DPN靶点KEGG通路富集分析
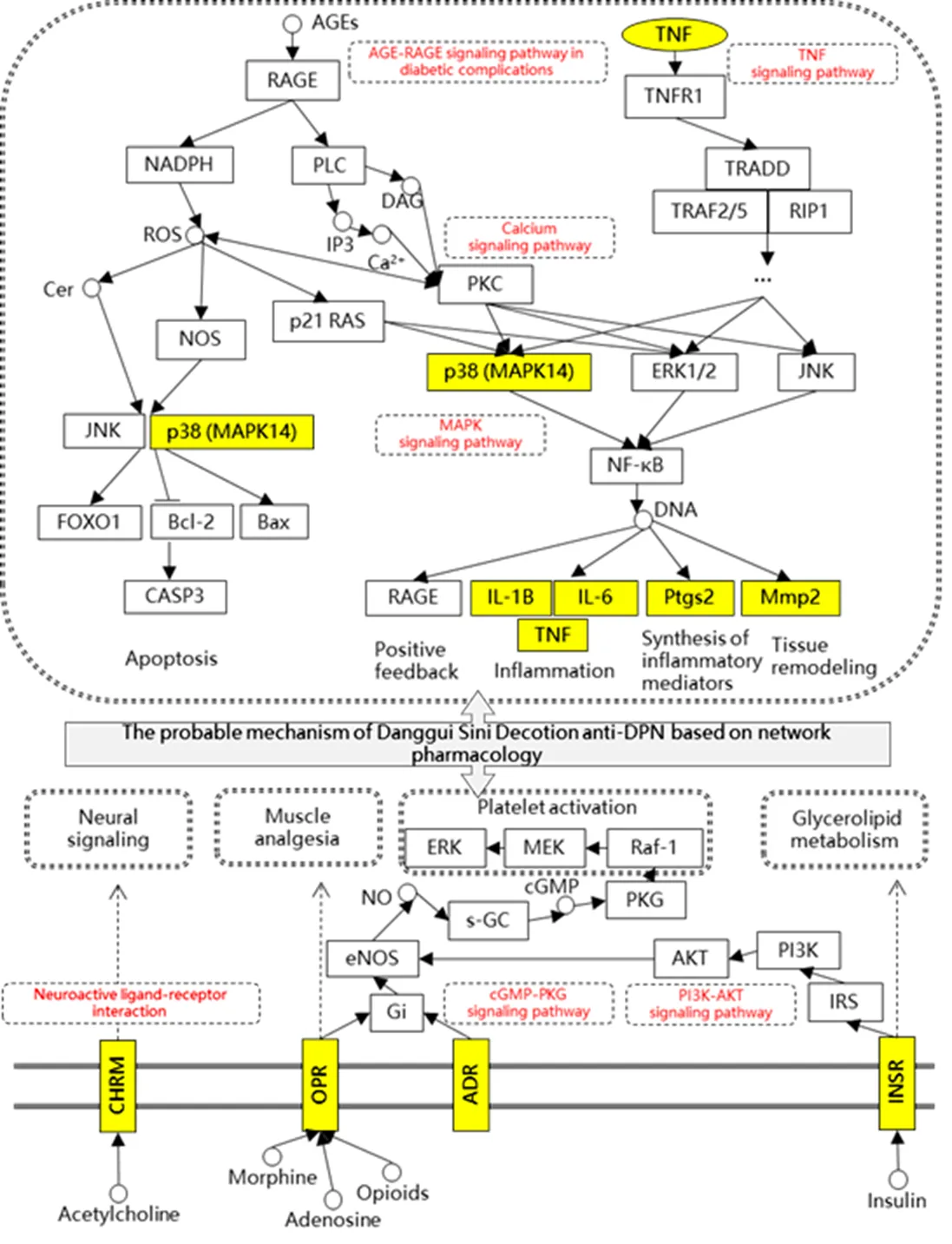
注:黄色框代表直接作用靶点,白色框代表相关作用靶点,红色字代表作用通路
3 讨论
研究显示,高血糖、胰岛素抵抗、脂代谢紊乱、神经滋养血管病变及代谢性炎症等因素可影响DPN过程[13]。高糖环境下,神经细胞外脂肪和蛋白质的AGEs与RAGEs结合,可以破坏髓鞘的完整性,影响神经组织的微管蛋白,从而引起神经分泌障碍、轴索神经传导缺陷以及轴索萎缩,使细胞内基质蛋白对周围神经纤维的营养作用受到损害,神经的再生和修复受阻[14];有研究表明,血脂紊乱能够加重外周神经功能损伤,在高糖合并高脂情况下,雪旺细胞可出现内质网应激和钙稳态失衡[15]。蛋白激酶C(PKC)是G蛋白偶联受体系统中的效应物,在高糖环境下,葡萄糖转化三磷酸甘油醛和磷脂酸,其作为PKCβ的底物转化为二酰甘油,PKC通路被激活,导致血管组织通透性增加和功能障碍[16],抑制PKC的激活能够增加皮肤微血管血流和减轻感受症状[17];也有研究表明,DPN患者血清C反应蛋白、TNF-α及IL-6浓度更高[18],这一现象可能与异常的代谢通路产生AGEs而激活NF-κB有关,NF-κB进一步增加炎症相关基因表达,刺激产生转化生长因子-β等细胞因子,单核细胞渗出,粒细胞、吞噬细胞聚集,引起局部缺血-再灌注,导致血管及神经细胞受损[19]。
当归四逆汤中主要活性成分包括Stigmasterol(豆甾醇)、taxifolin(花旗松素)、Cryptopin(隐品碱)、sitosterol(谷甾醇)、paeoniflorin(芍药苷)、quercetin(槲皮素)、licochalcone a(甘草查尔酮a)等,具有广泛的抗炎、抗氧化、镇痛、降血脂等功效[20-21]。本研究结果表明,该方中共有28个活性化合物作用于152个靶点,其中32个靶点与DPN相关,生物过程富集分析结果显示,该方可能影响腺苷酸环化酶激活肾上腺素能受体信号通路(adenylate cyclase-activating adrenergic receptor signaling pathway)、磷脂酶C激活G蛋白偶联受体信号通路(phospholipase C-activating G-protein coupled receptor signaling pathway)和MAPK级联正向调节(positive regulation of MAPK cascade)等生物过程,这些生物过程涉及细胞生长增殖、神经-激素分泌调节、能量代谢等[22-23],可能与DPN的发生和发展相关,当归四逆汤可能通过改善这些生物学过程发挥周围神经保护作用。KEGG通路富集分析结果显示,当归四逆汤活性成分作用靶点集中作用于神经活性配体-受体相互作用(Neuroactive ligand-receptor interaction)、钙离子信号通路(Calcium signaling pathway)、脂肪细胞脂解的调控(Regulation of lipolysis in adipocytes)、糖尿病并发症的糖基化终末产物-受体信号通路(AGE-RAGE signaling pathway in diabetic complications)等,提示当归四逆汤可能通过调节上述多条信号通路发挥作用。
综上,DPN涉及复杂而相互关联的发病机制,针对单一发病机制的治疗方案难以取得理想效果。当归四逆汤治疗DPN具有多成分、多靶点、多作用途径的特点,运用网络药理学方法对其作用机制和物质基础进行研究,对阐释其科学内涵具有重要意义。
[1] 许传华.伤寒经方治疗糖尿病周围神经病变的证治规律研究[D].广州:广州中医药大学,2012.
[2] 孙素云,杨叔禹.当归四逆汤治疗糖尿病周围神经病变探微[J].中医药通报,2013,12(2):14-16.
[3] 方朝晖,吴以岭,赵进东.糖尿病周围神经病变中医临床诊疗指南(2016年版)[J].中医杂志,2017,58(7):625-630.
[4] 冷启宁,温娟,李庆亮,等.当归四逆汤药理研究及临床应用新进展[J].中医临床研究,2015,7(36):108-110.
[5] 秦霞.基于组效关系和代谢组学的当归四逆汤抗凝成分及起效机制研究[D].南宁:广西医科大学,2015.
[6] 窦昌贵,成俊,黄芳,等.当归四逆汤镇痛抗炎作用的实验研究[J].中国实验方剂学杂志,1999,5(5):38-39.
[7] 蒋文仪,包艺运,都广礼.网络中药药理学研究进展[J].中医药信息, 2018,35(5):122-126.
[8] RU J, LI P, WANG J, et al. TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform,2014,6(1):13.
[9] LI Y H, YU C Y, LI X X, et al. Therapeutic target database update 2018:enriched resource for facilitating bench-to-clinic research of targeted therapeutics[J]. Nucleic Acids Research,2017,46(D1):D1121-D1127.
[10] WISHART D S, FEUNANG Y D, GUO A C, et al. DrugBank 5.0:a major update to the DrugBank database for 2018[J]. Nucleic Acids Research,2017,46(D1):D1074-D1082.
[11] PIÑERO J, QUERALTROSINACH N, BRAVO À, et al. DisGeNET:a discovery platform for the dynamical exploration of human diseases and their genes[J]. Database,2015,2015(3):28.
[12] KULESHOV M V, JONES M R, ROUILLARD A D, et al. Enrichr:a comprehensive gene set enrichment analysis web server 2016 update[J]. Nucleic Acids Res,2016,44(W1):W90-W97.
[13] EDWARDS J L, VINCENT A M, CHENG H T, et al. Diabetic neuropathy:Mechanisms to management[J]. Pharmacology and Therapeutics,2008, 120(1):1-34.
[14] CHOWDHURY S K, DOBROWSKY R T, FERNYHOUGH P. Nutrient excess and altered mitochondrial proteome and function contribute to neurodegeneration in diabetes[J]. Mitochondrion,2011,11(6):845-854.
[15] LIN W, POPKO B. Endoplasmic reticulum stress in disorders of myelinating cells[J]. Nature Neuroscience,2009,12(4):379-385.
[16] GERALDES P, KING G L. Activation of protein kinase C isoforms and its impact on diabetic complications[J]. Circulation Research,2010,106(8):1319-1331.
[17] CASELLINI C M, BARLOW P M, RICE A L, et al. A 6-month, randomized, double-masked, placebo-controlled study evaluating the effects of the protein kinase C-beta inhibitor ruboxistaurin on skin microvascular blood flow and other measures of diabetic peripheral neuropathy[J]. Diabetes Care,2007,30(4):896-902.
[18] GE S, XIE J, ZHENG L, et al. Associations of serum anti- ganglioside antibodies and inflammatory markers in diabetic peripheral neuropathy[J]. Diabetes Research and Clinical Practice,2016,115:68-75.
[19] ZOCHODNE D W. Mechanisms of diabetic neuron damage:Molecular pathways[J]. Handbook of Clinical Neurology,2014,126:379-399.
[20] 周志远,卢群,刘洋,等.豆甾醇的研究及开发进展[J].中国当代医药,2015,22(24):15-17.
[21] 孙丽荣,曹雄,侯凤青,等.芍药苷研究进展[J].中国中药杂志,2008, 33(18):2028-2032.
[22] JOHNSTON S, STAINES D, KLEIN A, et al. A targeted genome association study examining transient receptor potential ion channels, acetylcholine receptors, and adrenergic receptors in chronic fatigue syndrome/myalgic encephalomyelitis[J]. BMC Medical Genetics,2016,17(1):79.
[23] IRYNA L, FADY D, YATIN R, et al. The biased G-protein-coupled receptor agonism bridges the gap between the insulin receptor and the metabolic syndrome[J]. International Journal of Molecular Sciences,2018,19(2):575-584.
Discussion on Mechanism and Targets Forecast ofDecoction for Diabetic Peripheral Neuropathy
XING Qichang, CHEN Jia, LIU Zheng, JIANG Yaqin, LI Wei
To forecast related targets ofdiabetic peripheral neuropathy (DPN) treated byDecoction based on network pharmacology; To discuss its mechanism of action.TCMSP were used to screen active components and related target proteins ofDecoction. The targets related to DPN were searched and screened through Drugbank, TTD and DisGeNET database, and then intersection targets of active components and DPN were screened. The components-targets-disease interaction network was established by Cytoscape 3.2.1, and the GO analysis and KEGG enrichment for DPN targets treated byDecoction were conducted through online analysis tool Enrichr.Totally 28 active components inDecotion acted on 152 target proteins, 32 of which were related to DPN. The GO analysis and KEGG enrichment results showed that this prescription may play a role by acting on biological processes such as positive regulation of the MAPK cascade and signal pathways such as end-glycosylation products-receptors.The treatment ofDecotion for DPN has the characteristics of multi-target, multi-path, and overall regulation.
Decotion; diabetic peripheral neuropathy; network pharmacology; targets; mechanism

R259.872;R285
A
1005-5304(2020)06-0101-05
10.3969/j.issn.1005-5304.201905204
湖南省中医药科研计划(201999)
李伟,E-mail:67324457@qq.com
(2019-05-15)
(2019-06-04;编辑:陈静)
